
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 4. Поверхностно-активные и поверхностно- инактивные вещества
Растворенные вещества изменяют поверхностное натяжение жидкости: те, которые значительно понижают поверхностное натяжение, называются поверхностно-активными веществами (ПАВ), а те, которые несколько увеличивают поверхностное натяжение, называются поверхностно-инактивными веществами (ПИВ).
Молекулы поверхностно-активных веществ способны концентрироваться в поверхностном слое, и при этом происходит положительная адсорбция, т.е. Г > 0. Поверхностно-активные вещества, во-первых, имеют поверхностное натяжение меньше поверхностного натяжения растворителя (в противном случае накопление вещества в поверхностном слое термодинамически невыгодно) и, во-вторых, обладают сравнительно малой растворимостью (так как при хорошей растворимости они стремились бы уйти с поверхности в глубь жидкости). Взаимодействие между молекулами растворителя и поверхностно-активного вещества всегда меньше взаимодействия между молекулами растворителя, и поверхностно-активные вещества будут в основном выталкиваться из объема раствора на поверхность. На поверхности раствора происходит накопление молекул этих веществ, которые слабо взаимодействуют друг с другом. В результате уменьшения межмолекулярного взаимодействия в поверхностном слое поверхностное натяжение падает.
Поверхностно-активными веществами (ПАВ) являются органические соединения, молекулы которых построены асимметрично и одновременно содержат: активную полярную гидрофильную группу, хорошо взаимодействующую с молекулами воды, типа –ОН, –СООН, – NH2, -NO2, – SO3H, – SO3Na, – COONa и др. и неполярную гидрофобную группу – углеводородный радикал. Так, в молекуле масляной кислоты CH3–CH2–CH2–COOH полярной группой является –COOH, а неполярной – углеводородная цепь. Поэтому такие молекулы называются дифильными («любящими» два растворителя – полярный и неполярный). Дифильные молекулы обычно изображают символом


неполярная группа полярная группа
(углеводородный или (- СООН, - NH2 и др.)
ароматический радикал)
где кружок соответствуем полярной группе, а черточка – неполярному радикалу.
При растворении ПАВ как в полярном, так и неполярном растворителе, молекуле энергетически более выгодно перейти из объема в поверхностный слой (подобное растворяется в подобном).
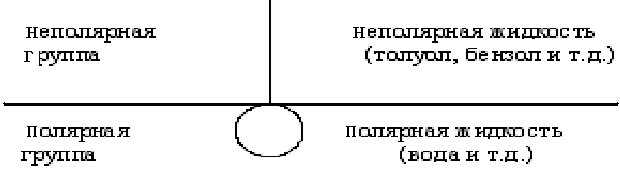
При этом образуется адсорбционный слой определенной структуры. В этих слоях молекулы ПАВ ориентируются полярными группами в сторону полярной среды (воды), а гидрофобной неполярной частью – в сторону менее полярной фазы (воздуха, углеводородной жидкости). При заполнении поверхности раздела вода – воздух молекулами ПАВ поверхностное натяжение на этой границе резко снижается.
Сравнительное изучение действия, которое оказывают на поверхностное натяжение различные члены какого-нибудь гомологического ряда, провели Дюкло в 1878 году и Траубе И. в 1884–86 гг. Исследуя поверхностное натяжение водных растворов органических соединений, они показали, что одинаковое уменьшение поверхностного натяжения воды может быть вызвано разными количествами вещества. Изучение зависимости поверхностного натяжения от концентрации водных растворов ПАВ, относящихся к одному гомологическому ряду, дало возможность обнаружить, что каждый последующий член ряда сильнее понижает поверхностное натяжение воды, чем предыдущий. ПАВ проявляют высокую поверхностную активность, которая зависит, главным образом, от длины углеводородного радикала. Эта важная зависимость была сформулирована в виде правила Дюкло-Траубе: «Дня низших членов гомологического ряда жирных кислот, спиртов и аминов с увеличением углеводородной цепи на группу – СН2 – поверхностная активность веществ на границе жидкость – газ возрастает в 3 – 3,5 раза при одинаковой молярной концентрации». Например, молекула валериановой кислоты СН3–(СН2)3–СООН содержит на одну группу – СН2 – больше, чем молекула масляной кислоты СН3 – (СН2)2 – СООН. Следовательно, поверхностная активность при переходе от раствора масляной кислоты к раствору валериановой кислоты возрастает в 3–3,5 раза (рис. 2). Качественно это правило можно объяснить уменьшением «удельной массы» полярной группы в молекуле с ростом длины цепи. С удлинением цепи в гомологическом ряду адсорбция возрастает, но для всех членов ряда кривые стремятся к одному и тому же предельному значению Г, называемому предельной адсорбцией (рис. 2).
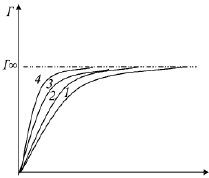
Рис. 2. Семейство изотерм адсорбции на границе раствор –
газ для гомоло- гического ряда ПАВ – органических кислот:
1 – пропионовая; 2 – масляная; 3 – валериановая; 4 – капроновая
При сравнительно высоких концентрациях растворов удельная адсорбция практически постоянна для всех членов гомологического ряда, так как при этом на поверхности раствора образуется насыщенный монослой, в котором молекулы ПАВ ориентированы перпендикулярно поверхности. При такой ориентации удельная адсорбция определяется площадью поперечного сечения молекулы ПАВ, одинаковой у всех членов одного гомологического ряда.
Это правило соблюдается в основном для истинно растворимых ПАВ и для температур, близких к комнатной. С повышением температуры поверхностная активность снижается. В результате десорбции молекул и величины поверхностной активности гомологов будут отличаться не в 3–3,5 раза, а значительно меньше, стремясь к единице.
Поверхностно-активные вещества, способные понижать межфазное поверхностное натяжение, играют важную роль в физиологических процессах, протекающих в организме. Биологические жидкости имеют поверхностное натяжение значительно меньшее, чем вода. Поэтому ПАВ (кислоты жирного ряда, стероиды) будут накапливаться у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны. Так, соки желчных кислот, обладающие высокой поверхностной активностью, обеспечивают самопроизвольное эмульгирование жиров и их всасывание. Наряду с этим, ПАВ, всасываясь через кожу, могут оказывать общее резербтивное действие на организм человека, а также стимулировать всасывание других ядовитых веществ, находящихся вместе с ПАВ в экзогенных загрязнениях среды. Высокие концентрации ПАВ и продолжительное их действие на организм приводят к развитию аллергического состояния.
ПАВ – это самый массовый и самый распространенный сегодня источник загрязнения биосферы (сточные воды, фабрики-прачечные и т. д.). Наличие ПАВ в природных водоемах нарушает их кислородный режим – ведет к гибели флоры и фауны, изменяет качество воды; пена ПАВ может стать источником инфекции. В связи с этим на ПАВ введены жесткие предельно допустимые концентрации (ПДК) – 0,5 мг/л, а в промышленности разрешается применять только те ПАВ, которые практически разлагаются в природных условиях.
Молекулы поверхностно-инактивных веществ стремятся уйти с поверхности жидкости в объем и при этом происходит отрицательная адсорбция, т.е. Г < 0. Поверхностно-инактивные вещества, во-первых, имеют поверхностное натяжение больше поверхностного натяжения растворителя (в противном случае они накапливались бы в поверхностном слое самопроизвольно) и, во-вторых, обладают обычно высокой растворимостью (это содействует их стремлению перейти с поверхности в объем). Взаимодействие между молекулами растворителя и поверхностно-инактивных веществ всегда больше, чем взаимодействие между самими молекулами растворителя, и поверхностно-инактивные вещества всегда будут стремиться уйти с поверхности в объем раствора. Если растворителем является вода, то поверхностно-инактивными веществами в отношении нее являются кислоты, щелочи, соли – электролиты, диссоциирующие в воде на хорошо гидратирующиеся ионы (одновалентные ионы приводят к небольшому повышению поверхностного натяжения, двухвалентные – повышают его больше). В неводных растворителях неорганические электролиты также увеличивают поверхностное натяжение, и это увеличение зависит от природы растворителя. Кроме того, к поверхностно-инактивным веществам в отношении воды относятся некоторые ионизирующиеся органические вещества, у которых неполярная часть молекулы отсутствует или очень мала. Например, муравьиная и аминоуксусная кислоты.
В случае, если вещества распределяются равномерно между поверхностным слоем и объемом раствора, т.е. не влияют на поверхностное натяжение растворителя, то для них Г = 0. Эти вещества имеют поверхностное натяжение по величине близкое к поверхностному натяжению растворителя. Например, при растворении сахаров в воде, ее поверхностное натяжение почти не изменяется. Хотя сахара мало активны в отношении воды на границе водный раствор – воздух, они могут быть поверхностно-активными на границе водный раствор – твердая фаза или водный раствор – другая жидкость. Различные вещества в крови и протоплазме клеток, адсорбируясь положительно и отрицательно, играют большую роль в живых организмах.
