
студ ивт 22 материалы к курсу физики / belonuchkin_ve_zaikin_da_tsipeniuk_ium_kurs_obshchei_fiziki
.pdf8.4 ] |
Задачи |
131 |
В результате при наблюдении в перпендикулярном направлении мы увидим три линейно-поляризованных волны.
Таким образом, энергетические уровни частиц (любых — это могут быть и ядра, и молекулы), обладающих ненулевыми магнитными моментами, во внешнем магнитном поле испытывают зеемановское расщепление. Если облучать такие частицы внешним электромагнитным излучением с частотой, равной энергии переходов между подуровнями:
|
, |
(8.17) |
||
|
|
Б |
|
|
|
|
|
||
то будет происходить резонансное поглощение излучения. В зависимости от сорта частиц это может быть ЭПР — электронный парамагнитный резонанс, либо ЯМР — ядерный магнитный резонанс. В последнем случае масштаб измерения магнитных моментов определяется не магнетоном Бора, а так называемым ядерным магнетоном я 2 , где — масса протона, т. е. ядерный магнетон примерно в 1800 раз меньше магнетона Бора: он равен 5,05 10 27 Дж/Тл 5,05 10 24 эрг/Гс.
Обычно опыты проводят так, что частота генератора, создающего переменное электромагнитное поле, держится постоянной, а меняется внешнее магнитное поле . В образце энергия атомов с 0 зависит от ориентации магнитных моментов. Если приложено внешнее поле, то после установления теплового равновесия в соответствии с больцмановским распределением заселенности уровней число частиц с моментами, ориентированными вдоль поля, оказывается больше числа частиц с противоположной ориентацией магнитных моментов. Таким образом, результирующий магнитный момент образца становится отличным от нуля, т. е. образец намагничивается. Этот эффект получил название парамагнитный резонанс, его впервые наблюдал советский физик Е.К. Завойский (1907–1976) в 1944 г.
Задачи
1. Какой эффект Зеемана — простой или сложный — наблюдается при расщеплении спектральной линии 1 2 1 3 в магнитном поле с индукцией1 Тл? В каких пределах должно лежать расстояние между зеркалами интерферометра Фабри–Перо, чтобы обнаружить и исследовать зеемановское расщепление рассматриваемой линии? Зеркала посеребряны так, что эффективное число отражений между ними эф 20.
Решение. Поскольку рассматриваемый переход происходит между синглетными состояниями, т. е. состояниями с нулевым спином (2 1 1), то независимо от величины магнитного поля эффект — простой. Разрешающая способность интерферометра эф , где — порядок интерференции. Необходимо, чтобы Æ, где Æ . С другой стороны,
Æ 2Æ2 должна быть меньше области дисперсии, равной .
5*

132 |
|
Атом в магнитном поле |
[ Гл. 8 |
||
Порядок интерференции . Отсюда получается |
|
||||
2 2 |
|
2 2 |
, или 0,54 мм 10,7 мм |
|
|
|
|
|
|
||
|
эф |
|
|
|
|
2. Найти зеемановское расщепление спектральной линии |
2 |
||||
3 2 |
|||||
2 1 2 . Указать число компонент в расщепленной линии.
Решение. Состояние 2 3 2 означает, что 3 2, 2, 1 2; фактор Ланде
Л 1 |
3 2 5 2 1 2 3 2 2 3 |
|
|
4 |
, |
4 |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
2 3 2 5 2 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
5 2 |
|
||||||||
Аналогично в состоянии 2 1 2: 1 2, 1, 1 2; |
|
|
|
|
|
|||||||||||||||||||||
Л 1 |
3 4 3 4 2 |
|
|
2 |
, |
|
|
|
|
2 |
|
|
|
|
|
|||||||||||
3 2 |
3 |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 2 |
|
|
|
|
|
|||||||||
|
|
|
13 |
, |
11 |
|
, |
1 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
15 |
|
5 2 |
|
|
|
|
|
||||||||||||||||
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
3. Оценить, какую индукцию магнитного поля звезды типа Солнца |
||||||||||||||||||||||||||
(период вращения 106 с, радиус |
108 |
|
м, температура поверхности |
|||||||||||||||||||||||
6 103 К) можно обнаружить, используя |
измерения эффекта Зеемана |
|||||||||||||||||||||||||
в оптической области спектра ( 1015 с |
1). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Решение. Для обнаружения зеемановского расщепления, необходимо, чтобы оно было больше доплеровского уширения в результате теплового движения атомов и вращения звезды, т. е.
|
|
2 Б |
|
|
|
|
теп |
|
вращ |
|
теп |
, |
|
|
|
|
|
|
|||||||
|
|
|
теп |
вращ |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
поскольку нетрудно убедиться, что вращ 2 теп 3 Б 2 , где— масса атома водорода, из которого в основном и состоит наружная
оболочка Солнца. В результате
|
|
|
3 Б |
0,2 Тл 2000 Гс |
|
2 |
2 |
||||
|
|
||||
|
Б |
|
|
||
4. При наблюдении ядерного магнитного резонанса на ядрах 25Mg обнаружено резонансное поглощение излучения частоты 1,4 МГц в поле
5,4 10 4 Тл. Спин ядра 25Mg равен 5 2. Найти магнитный момент и-фактор ядра.
Решение. я , т. е. я , где я — ядерный магнетон. В результате 0,34. Магнитный момент (точнее его максимальная проекция) я 0,85 я.

Г л а в а 9
КВАНТОВАЯ МЕХАНИКА МОЛЕКУЛ
9.1. Роль обменной энергии в образовании молекул
Почему нейтральные атомы часто объединяются в молекулы? Ответ на этот вопрос дала квантовая механика. Раньше химики лишь констатировали тот факт, что одни атомы легко объединяются в молекулы, другие, например, благородные газы, в обычных условиях находятся только в атомарном состоянии.
Принципиальным моментом в данном вопросе является тождественность одинаковых частиц, которая приводит в квантовой механике к специфическому взаимодействию между ними, называемому обменным взаимодействием. Рассмотрим происхождение этого взаимодействия на примере системы из двух электронов. Волновая функция такой системы может быть представлена как произведение функции , зависящей от координат частиц, и функции , зависящей от их спинов. Электроны являются фермионами, и поэтому, как было показано в § 7.1, согласно принципу Паули волновая функция системы должна быть антисимметричной — при перестановке координат частиц и спиновых переменных она должна менять знак. Это возможно в двух случаях: либо спиновая функция антисимметрична, а координатная симметрична, либо, наоборот, спиновая функция симметрична, а координатная антисимметрична. В первом случае спины электронов антипараллельны (так называемое парасостояние), а во втором — параллельны (ортосостояние).
Волновые функции отдельных электронов могут перекрываться, а это означает, что существует конечная вероятность того, что каждый электрон какое-то время проводит не только у своего ядра, но и у соседнего. Именно этот факт и является причиной возникновения обменного взаимодействия. Таким образом, обменная энергия обусловлена спецификой квантовых законов движения систем одинаковых частиц. Обменная энергия обладает
следующими основными свой- |
|
|
|
ствами. Во-первых, она |
отли- |
|
|
чается от нуля только |
в том |
|
|
случае, когда волновые функции отдельных электронов
и (или, более наглядно, «электронные облака») перекрываются (рис. 9.1). Это означает, что некоторую долю времени частицы

134 Квантовая механика молекул [ Гл. 9
проводят в одной и той же области пространства. Чем больше степень перекрытия волновых функций, тем больше обменная энергия. Во-вторых, обменная энергия в отличие от обычной может иметь любой знак в зависимости от того, симметрична или антисимметрична спиновая функция. Поэтому благодаря обменной энергии в одной и той же системе могут существовать как силы притяжения, так и силы отталкивания.
Обменная энергия обусловливает большой круг явлений. Она заметно влияет на энергию стационарных состояний во всех атомах, начиная с гелия. Ей принадлежит главная роль в образовании ковалентной химической связи в молекулах и кристаллах. Эта энергия имеет также важное значение во внутриядерных взаимодействиях и т. д.
Рассмотрим качественно роль обменного взаимодействия в образовании типичной гомеополярной молекулы — молекулы водорода. График потенциальной энергии взаимодействия двух атомов водорода в зависимости от расстояния между протонами для случаев симметричной координатной волновой функции
сим и антисимметричной асим приведен на рис. 9.2.
|
|
Как видно из приведенного графика, об- |
|
|
|
разование молекулы в случае параллельных |
|
r0 |
r |
||
спинов невозможно. Если же спины электро- |
|||
|
|
||
|
|
нов антипараллельны, то энергия сим имеет |
|
|
|
минимум. Следовательно, на некотором рас- |
стоянии 0 друг от друга ядра будут находиться в состоянии устойчивого равновесия, и при этом образуется молекула водорода H2.
Будут ли ядра притягиваться или отталкиваться друг от друга, зависит от знака обменной энергии. Притяжение ядер атомов водорода друг к другу в случае антипараллельных спинов электронов и отталкивание при параллельных спинах можно наглядно объяснить следующим образом. На рис. 9.3 изображены симметричные (спины электронов антипараллельны) и антисимметричные (параллельные спины)
координатные волновые функции электронов. Обе комбинации координатной и спиновой части волновой функции обеспечивают антисимметрию полной волновой функции. Когда атомы находятся далеко друг от друга, волновые функции их электронов не перекрываются. Квадрат волновой функции отражает вероятность нахождения частицы в данном месте пространства.

9.1 ] |
Роль обменной энергии в образовании молекул |
135 |
При сближении атомов водорода координатная часть волновой функции существенно отличается для параллельных и антипараллельных спинов. Энергия электрона состоит из двух частей — электростатической потенциальной энергии электрона
вполе двух протонов и кинетической энергии, пропорциональной
2 (кинетическая энергия пропорциональна квадрату импульса частицы, а оператор импульса в квантовой механике равен
). При антипараллельных спинах оба эти слагаемые становятся меньше, так как вероятность пребывания электронов
вобласти между ядрами достаточно велика и, находясь в ней, электроны притягивают ядра к себе, что приводит к уменьшению потенциальной энергии, а кинетическая энергия уменьшается,
так как в области между ядрами 2 0. Если же спины параллельны, то волновая функция обращается в нуль посередине между ядрами, плотность электрического заряда электронного облака между ядрами минимальна, и они отталкиваются друг от друга, тем самым потенциальная энергия увеличивается, и кинетическая энергия электронов в этом случае также становится больше.
Итак, нейтральные атомы могут притягивать друг друга, образуя молекулы, и это является чисто квантовомеханическим свойством — появлением обменного взаимодействия. Остается выяснить, почему же атомы благородных газов являются химически инертными, почему они «отталкивают» другие атомы? В химии данное свойство называют насыщением химических сил.
Рассмотрим сначала простой пример: взаимодействие атома гелия (He) с атомом водорода (H). В своем основном состоянии He имеет два электрона, оба на нижнем уровне. В соответствии с принципом Паули, электроны должны иметь антипараллельные спины, и атом находится в 1 -состоянии. Если атом H приблизить настолько, что будет иметь место взаимодействие, то можно ожидать проявления эффекта обмена. В противоположность случаю двух атомов H, здесь возможен только один вид взаимодействия. Правило сложения векторов для спинов сразу же показывает, что существует только одно значение для полного спина системы, а именно — 1/2, спин ато-
ма He равен нулю. Какого же типа будет взаимодействие, притяжением или отталкиванием? Мы можем решить этот вопрос следующим образом. Пусть, например, спин атома H ориентирован вверх (рис. 9.4). Казалось бы, такой электрон может быть обменен
с любым из двух электронов атома He. Однако это не так. Если, например, электрон атома H будет обменен с электроном ато-
136 |
Квантовая механика молекул |
[ Гл. 9 |
ма He, имеющим спин вниз, то возникнет состояние атома He, в котором два электрона имеют одинаковые направления спинов (оба вверх), а оно запрещено принципом Паули. Отсюда следует, что электрон атома H может быть обменен только с электроном атома He, имеющий то же направление спина вверх. Но на примере двух атомов H мы видели, что обмен двух электронов
спараллельными спинами ведет к отталкиванию. Таким образом, атом He и атом H отталкивают друг друга. Эти рассуждения сразу же можно обобщить на все благородные газы. Благородные газы имеют только замкнутые электронные оболочки, и все электроны располагаются на них парами с антипараллельными спинами. Поэтому атом благородного газа отталкивает любой другой атом. Это находится в полном согласии с химическим поведением благородных газов, атомы которых не вступают в соединение ни с одним из других атомов.
Совершенно аналогичная ситуация возникает и при взаи-
модействии атома H c молекулой H2. Распределение электронов в молекуле водорода соответствует синглетному состоянию
сдвумя электронами, образующими пару с антипараллельными спинами. Это сходно с распределением электронов в атоме He (во всяком случае, в отношении спинов). Электрон атома H
может быть обменен только с тем электроном молекулы H2, который имеет то же направление спина, а, следовательно, атом H
отталкивается молекулой H2. Этим и объясняется свойство насыщения. Как только молекула H2 образована, она уже не может связаться с третьим атомом. Правда, следует заметить, что приведенные рассуждения справедливы только до тех пор, пока
атом H находится относительно далеко от молекулы H2. Если же расстояние между H и H2 становится сравнимым с молекулярным расстоянием H2, то положение осложняется. Действительно, вначале при сближении третий атом водорода отталкивается, но как только барьер «отталкивания» преодолен, становится возможным образование связанного состояния.
Теперь, поняв причину объединения атомов в молекулы, мы можем перейти к рассмотрению возбужденных состояний молекул.
9.2. Вращательные и колебательные уровни молекул
В качестве модели двухатомной молекулы рассмотрим два тела массы , соединенных невесомым жестким стержнем (ротатор). Определим, какие вращательные возбуждения (вращательные уровни) допустимы для него квантовой механикой. Выражение для оператора вращательной энергии нетрудно написать, используя известную из механики связь этой энергии

9.2 ] Вращательные и колебательные уровни молекул 137
с моментом импульса :
|
|
2 |
(9.1) |
|
|
вр |
|
, |
|
|
||||
|
2 |
|
||
|
|
|
||
где — момент инерции ротатора. Из формулы (9.1) сразу видно, что энергия вращательного движения квантуется точно так же, как квадрат момента импульса, т. е. спектр вращательных уровней имеет вид
|
2 |
|
|
2 1 |
(9.2) |
Таким образом, вращательный спектр не эквидистантен, как у гармонического осциллятора, а расстояние между вращательными уровнями растет по мере увеличения квантового числа :
1 |
2 |
1 |
1 |
2 |
|
2 |
(9.3) |
|
2 |
2 |
|||||||
|
|
|
|
|
||||
Теперь мы можем качественно описать характерные черты спектра возбуждений молекулы. Энергия стационарного состояния молекулы является суммой трех энергий — электронной (энергии электронов в атомах, образующих молекулу), энергии колебаний атомов друг относительно друга и вращательной энергии молекулы. Найдем относительный масштаб этих возбуждений.
Сначала рассмотрим энергию коле- |
|
|
баний атомов в молекуле. На рис. 9.5 |
|
|
качественно показана зависимость по- |
|
|
тенциальной энергии взаимодействия |
|
|
атомов, образующих молекулу. Пунк- |
|
|
тиром изображена параболическая ап- |
U0 |
|
проксимация потенциальной ямы (гар- |
||
|
||
моническое приближение). |
|
|
Появление потенциальной ямы в |
|
|
энергии взаимодействия атомов есть |
Рис. 9.5 |
|
следствие двух факторов: на малых |
||
|
расстояниях одноименно заряженные ядра атомов отталкиваются, а на больших расстояниях — притягиваются в результате обменного взаимодействия и сил статического или динамического диполь-дипольного взаимодействия. Для нас сейчас несущественна природа образования связанного состояния атомов в молекулах, мы можем рассматривать результат образования молекул просто как экспериментальный факт. Из измерений энергии диссоциации молекул следует, что минимум потенциальной энергии 0 по порядку величины совпадает с энергией ионизации атомов, а размер молекул 0 по порядку величины

138 |
Квантовая механика молекул |
[ Гл. 9 |
равен характерному размеру атомов 0. В окрестности минимума потенциальная энергия может быть аппроксимирована параболой вида
|
|
0 |
2 |
|
|
|
|
, |
(9.4) |
||
|
02 |
|
|||
0 |
|
|
|
|
где — постоянная Ридберга. Эта аппроксимация дает правильный порядок необходимых нам величин: при смещении атомов на 0 0 изменение энергии взаимодействия порядка постоянной Ридберга, т. е. 0 .
Движение в параболической яме соответствует гармоническим колебаниям, и, чтобы найти энергию колебательного движения, необходимо оценить жесткость нашей системы. Как хорошо известно, энергия колебаний 2 2, где — жесткость системы, а — смещение. Отсюда следует, что в нашем приближении жесткость молекулы равна
|
2 |
|
(9.5) |
2 |
|||
|
0 |
|
|
Вспомним соотношение между боровским радиусом и постоянной Ридберга:
0 |
|
, |
|
2 2 |
|
(9.6) |
|
|
2 |
||||||
|
|
|
|
|
Здесь — постоянная тонкой структуры, а — масса электрона. Подставляя эти выражения в (9.5), получаем
|
2 |
2 |
|
2 |
|
2 |
2 |
|
||
|
|
|
|
2 2 2 |
|
|
|
|
|
(9.7) |
|
|
|
|
|
||||||
2 |
|
|
|
|
||||||
Теперь мы можем найти выражение для частоты колебаний атомов массы
|
|
|
2 2 |
|
|
|
|
|
|
|
|
|
|
|
||
кол |
|
|
|
|
2 |
|
|
|
|
(9.8) |
||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||
Характерная энергия возбуждений атомных электронов
|
(9.9) |
Это означает, что энергия колебательного движения примерно
враз меньше. Так как масса атома по порядку величины
в103 раз больше массы электрона, а частота переходов лежит
ввидимой части спектра, то частоты колебательных возбужде-
ний лежат в инфракрасной области (длины волн соответствующего излучения примерно в 30 раз больше длин волн видимого света).
9.2 ] Вращательные и колебательные уровни молекул 139
Обратимся теперь к вращательной энергии. Согласно формуле (9.2) масштаб энергии вращательных уровней можно оценить
из соотношения |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вр |
|
|
|
|
|
(9.10) |
|||
|
|
|
|
|
|
вр |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поскольку |
2 |
, то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 2 2 |
(9.11) |
||||||||||
|
вр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 02 |
|
|
2 |
|
2 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Таким образом, характерная частота вращательного движе-
ния еще в раз меньше, что соответствует далекой инфракрасной области спектра.
Теперь мы знаем соотношение между характерными частотами (энергиями) всех трех типов возбуждения:
|
вр |
1 |
(9.12) |
кол |
|
|
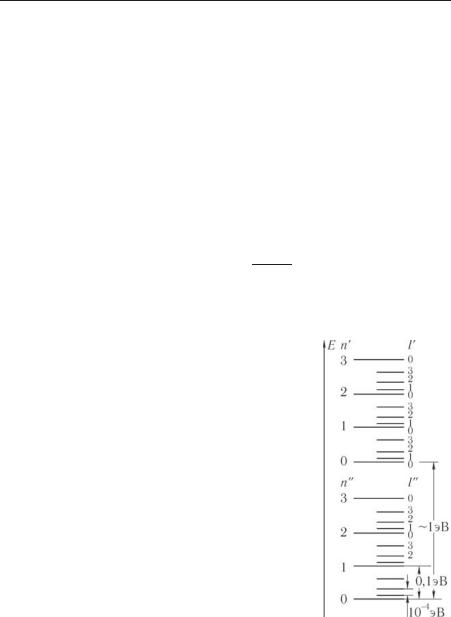
Схематически уровни энергий молекулы выглядят так, как это показано на рис. 9.6. На каждом электронном состоянии имеется эквидистантная полоса колебательных возбуждений, и, кроме того, на каждом колебательном уровне имеется еще вращательная полоса.
При возбуждении молекулы возникают целые серии переходов, образующих коле- бательно-вращательную полосу.
Теперь на квантовом языке очень легко объяснить комбинационное рассеяние света, которое часто называют рамановским´ рассеянием по имени индийского физика Ч. Рамана (1888–1970), открывшего его одновременно с советскими физиками Л.И. Мандельштамом (1879–1944) и Г.С. Ландсбергом (1890–1957). Комбинационное рассеяние представляет собой неупругое рассеяние фотонов, при котором фотон либо отдает молекуле часть своей энергии (стоксовая линия, частота рассеянного света равна 0 ), либо отбирает энергию у молекулы ( 0 , антисток-
совая линия). Мы упомянули здесь комбинационное рассеяние, поскольку оно является одним из основных экспериментальных методов исследования молекулярных спектров: спектры комбинационного рассеяния несут в себе информацию о колебатель- но-вращательных полосах молекул.

140 |
Квантовая механика молекул |
[ Гл. 9 |
Задачи
1.Определить для молекулы HCl вращательные квантовые числа двух соседних уровней, разность энергий которых равна 7,86 10 3 эВ. Расстояние между ядрами молекулы равно 1,275 10 10 м.
Ответ: 2 и 3.
2.Вычислить отношение энергий, которые необходимо затратить для возбуждения молекулы иода на первый колебательный и первый вращательный
уровни. Межъядерное расстояние 2,7 10 10 м, собственная частота колебаний 215 см 1.
Ответ: кол 2 3200, где — масса атома иода.
вр 2
3. При комбинационном рассеянии излучения от ртути с длиной волны
Æ
3650 А на молекулах кислорода наблюдается спутник — линия с длиной волны
Æ
3870 А. Определить частоту собственных колебаний молекулы кислорода. Ответ: 4,66 1013 с 1.
