
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
RHal + 2Na ® R–Na + NaHal,
2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
RHal + R–Na ® RR + NaHal.
В зависимости от природы R и условий проведения реакции вторая стадия процесса может протекать по ионному либо по радикальному механизму.
Присоединение реактива Гриньяра к альдегидам и кетонам
Присоединение R-MgHal к формальдегиду приводит к образованию первичных спиртов:

Из альдегидов получаются вторичные спирты:

В реакции с кетонами образуются третичные спирты:
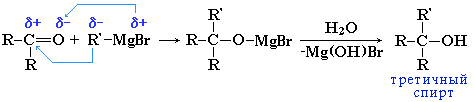
Одноатомные спирты: строение, физические свойства. Химические свойства: кислотность и основность, нуклеофильные реакции, реакции отщепления, окисление первичных, вторичных, третичных спиртов. Проба Лукаса. Способы получения.
Предельные одноатомные спирты - это производные предельных углеводородов, в молекуле которых один атом водорода замещён на гидроксильную группу.
Общая формула: CnH2n+1OH
Виды изомерии спиртов:
· Изомерия углеродного скелета
СН3- СН2-СН2-СН2-ОН – бутанол1
· Изомерия положения функциональной группы ОН
СН3-СН2-СН2-ОН пропанол1,
· Межклассовая изомерия с простыми эфирами
СH3CH2OH – этиловый спирт СH 3 - O -CH3 - диметиловый эфир
Этано́л — C2H5OH
Физические свойства: в обычных условиях представляет собой бесцветную жидкость с характерным запахом, может растворяться в воде, высокая температура плавления и кипения. Молекулы спирта между собой связаны водородной связью.
Химические свойства:неэлектролит, не обладает ярко выраженными основными свойствами или кислотными, не изменяют окраску индикаторов.
· Со щелочными и щелочно-земельными металлами:
2C2H5OH + 2К → 2С2Н5ОК + Н2
· Горение:
C2H5OH+3O2 →2CO2+ H2O
· C галогеноводородами:
C2H5OH+HBr → C2H5Br+H2O
· C кислотами (образуются сложные эфиры):
· C2H5OH+СH3COOH →CH3COOC2H5
· Окисление:
C2H5OH+CuO →CH3COH+H2O+Cu
+ Ме щелочной металл
+ O2 (горение)
+НСl, HBr
+спирт (образуется простой эфир)
+карбоновая кислота (образуется сложный эфир)
+СuO (качественная реакция) – образуется альдегид
Применение:
· Производство синтетического каучука
· Материал для получения медикаментов, духов, лаков, красителей
· Получают уксусную кислоту и др. вещества
· Растворитель лекарственных препаратов
· Дезинфицирующее средство
· Используют для приготовления экстрактов и настоек
· Спиртные напитки
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
С–ОН с отщеплением ОН-группы
О–Н с отщеплением водорода.
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона Н+ проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О - свойства основания и нуклеофильного реагента.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксисоединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных соединений.
1. Кислотные свойства гидроксисоединений
Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли - алкоголяты (алкоксиды):
2R–OH + 2Na→ 2RO–Na+ + H2
2C2H5OH + 2K → 2C2H5O–K+ + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
C2H5OК + H2O→ C2H5OH + КOH
Спирты – более слабые кислоты, чем вода, т.к. алкильный радикал, проявляя +I-эффект, повышает электронную плотность на атоме кислорода и уменьшает полярность связи О–Н. Поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются:
![]()
(равновесие этой реакции сдвинуто влево,
т.к. соли спиртов в воде гидролизуются)
Кроме того, спирты способны вытеснять углеводороды, которые можно рассматривать как еще более слабые кислоты, из их солей (например, из реактивов Гриньяра RMgHal):
R–OH + R'MgBr →R'H + Mg(OR)Br
Кислотность одноатомных спиртов убывает в ряду:
CH3OH > первичный > вторичный > третичный.
2. Образование сложных эфиров
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).

![]()

Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
3. ОкислениеОкислители - KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду:
первичные > вторичные > третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Предельное окисление происходит при горении, например:
2CH3OH + 3O2 → 2CO2 + 4H2O
4. Реакции замещения ОН-группы
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований.
![]() Механизм
реакции - нуклеофильное
замещение SN.
Механизм
реакции - нуклеофильное
замещение SN.
Нуклеофил – хлорид-анион Cl:– – замещает группу HO:–
Данная реакция является одним из способов получения галогеноуглеводородов.
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.

5. Реакции дегидратации спиртов
Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная илимежмолекулярная реакция.
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 °С.
Например:
 В
тех случаях, когда возможны 2 направления
реакции, например:
В
тех случаях, когда возможны 2 направления
реакции, например: дегидратация
идет преимущественно в направлении I,
т.е. по правилу
Зайцева – с образованием более
замещенного алкена (водород отщепляется
от менее гидрогенизированного атома
углерода).
дегидратация
идет преимущественно в направлении I,
т.е. по правилу
Зайцева – с образованием более
замещенного алкена (водород отщепляется
от менее гидрогенизированного атома
углерода).
Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров:

Спирты растворимы в холодной концентрированной серной кислоте. Это свойство характерно также для алкенов, аминов и практически для всех соединений, содержащих кислород, а также для легкосульфируемых соединений. (Спирты, как и другие кислородсодержащие соединения, образуют оксониевые соли, которые растворимы в сильнополярной серной кислоте.)
Спирты не окисляются холодным разбавленным нейтральным раствором перманганата (хотя первичные и вторичные спирты окисляются в более жестких условиях). Спирты часто содержат примеси (разд. 6.23), которые окисляются в этих условиях, и поэтому реакцию с перманганатом следует интерпретировать с осторожностью.
Спирты не обесцвечивают раствора брома в четыреххлористом углероче. С помощью этой реакции спирты можно отличить от алкенов и алкинов.
Кроме
того, спирты можно отличить от алкенов
и алкинов — и в действительности от
почти любого другого класса соединений
![]() по их окислению хромовым ангидридом
по их окислению хромовым ангидридом
![]() в водном растворе серной кислоты:
в течение двух секунд прозрачный
оранжевый раствор становится
голубовато-зеленым и мутнеет.
в водном растворе серной кислоты:
в течение двух секунд прозрачный
оранжевый раствор становится
голубовато-зеленым и мутнеет.
Третичные спирты не дают этой реакции. Альдегиды дают эту реакцию, но их легко можно отличить другими методами (разд. 19.19).
Реакция спиртов с металлическим натрием с выделением газообразного водорода редко используется для определения спирта, поскольку любое влажное соединение будет реагировать с натрием до тех пор, пока не прореагирует вся вода.
Наличие в молекуле ОН-группы часто обнаруживают по образованию сложного эфира при действии хлористого ацетила или ангидрида (разд. 18.16). Некоторые сложные эфиры имеют приятный запах; другие представляют собой твердые вещества с четкими температурами плавления, и их можно использовать в качестве производных для идентификации. (Если установлены молекулярные формулы исходного и конечного веществ, то можно рассчитать, сколько имеется ОН-групп.)
(см. скан)
Является ли спирт первичным, вторичным или третичным, можно установить с помощью пробы Лукаса, которая основана на различной реакционной способности трех классов спиртов по отношению к галогеноводородам (разд. 16.4). Спирты (с числом атомов углерода не более шести) растворимы в реактиве Лукаса — смеси концентрированной соляной кислоты и хлористого цинка. (Почему они растворимы в этой смеси лучше, чем в воде?) Соответствующие алкилхлориды нерастворимы. Об образовании галогенида из спирта можно судить по помутнению раствора вследствие выделения хлорида; следовательно, время, необходимое для появления мути, является мерой реакционной способности спирта.
Третичные спирты реагируют с реактивом Лукаса сразу же, вторичные — в течение 5 мин, а первичные спирты при комнатной температуре заметно не реагируют. Выше уже говорилось о том, что бензиловый и аллиловый спирты реагируют с реактивом Лукаса с такой же скоростью, как третичные спирты; хлористый аллил, однако, растворим в реагенте. (Почему?)
О наличии в спирте одной определенной структурной единицы можно
судить
по нодоформиой реакции. Спирт
обрабатывают иодом и едким натром
(гипоиодитом натрия
![]() спирты, имеющие структуру
спирты, имеющие структуру
дают
желтый осадок йодоформа
![]() например:
например:
(см. скан)
Реакция протекает через стадии окисления, галогенирования и расщепления
Как
и следовало ожидать на основании
написанных уравнений, соединение,
имеющее структуру
![]() алкил или арил), также дает положительную
реакцию с
алкил или арил), также дает положительную
реакцию с
![]() (разд. 19.19).
(разд. 19.19).
Иногда
эту реакцию используют не как характерную
пробу, а для синтеза карбоновой кислоты
![]() В этих случаях применяют более дешевые
гипобромиты и гипохлориты.
В этих случаях применяют более дешевые
гипобромиты и гипохлориты.
