- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
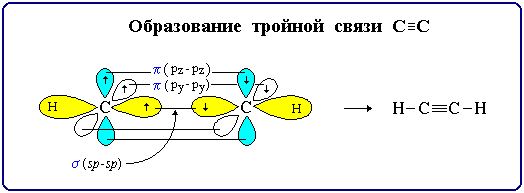
Строение тройной связи
Тройная связь является комбинацией из одной s-и двух p-связей, образуемых двумя sp-гибридизованными атомами.
s-Связь возникает при осевом перекрывании sp-гибридных орбиталей соседних атомов углерода; одна из p -связей образуется при боковом перекрывании рy-орбиталей, другая – при боковом перекрывании
рz-орбиталей.
Образование связей на примере молекулы
ацетилена ![]() можно
изобразить в виде схемы:
можно
изобразить в виде схемы:
s-связь (перекрывание 2sp-2sp),
p-связь (2рy-2рy),
p-связь (2рz-2рz),
С–Н s-связь (перекрывание 2sp-АО углерода и 1s-АО водорода).
См. аним. 6.1.1 (58992 байт).
p -Cвязи
располагаются во взаимно перпендикулярных
плоскостях.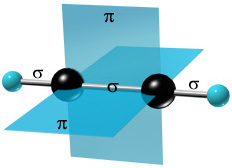
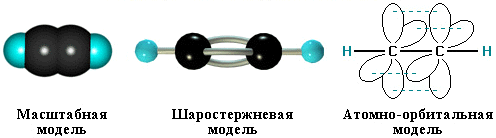
s-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются на одной прямой (под углом 180° друг к другу). Поэтому молекула ацетилена имеет линейное строение:
Номенклатура алкинов
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин:
2 Атома с → этан → этин;
3 Атома с →пропан → пропин и т.Д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. Например:
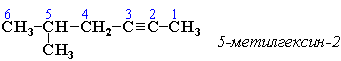
Для простейших алкенов применяются также исторически сложившиеся названия:ацетилен (этин), аллилен (пропин), кротонилен(бутин-1), валерилен (пентин-1).
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкинов:
![]()
Кислотные свойства
Как мы уже говорили, в терминальных алкинах (с тройной связью на конце цепи)
концевой атом водорода проявляет слабокислотные свойства. Соответственно такие алкины могут вступать в реакции с сильными основаниями и образовывать соли —ацетилениды:
R-CC-H+NaNH2R-СC-Na++NH3
Несколько иного типа реакция происходит между терминальными алкинами иаммиачными растворами оксида серебра или хлорида меди(I):
R-CC-H + [Ag(NH3)2]+ОН-R-CC-Ag+2NH3+H2O
R-CC-H+2[Cu(NH3)2]+OH-R-CC-Cu + 4NH3+2H2O
Образование осадка при реакции с одним из этих растворов может служить для
качественного определения алкинов (особенно когда их нужно отличить от алкенов).
Хотя эти реакции также связаны с кислотностью алкинов, получающиеся соединения не являются, строго говоря, солями — характер связи C-Ag или С-Cu в значительной
степени ковалентНый. Однако при реакции с сильными кислотами эти соединения ведут себя как соли слабой кислоты:
R-CC-Ag+HClR-CCH+AgCl
Ионные ацетилениды (щелочных и щелочноземельных металлов) легко разлагаются даже водой и не могут быть получены реакцией с обычными щелочами Реакции образования-разложения ацетиленидов меди или серебра могут служить для выделения алкинов из сложных смесей.
Реакции электрофильного присоединения.
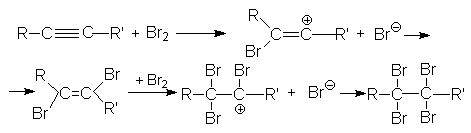
Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам, участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:
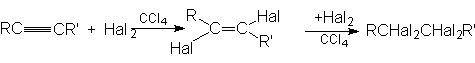
Промежуточный дигалогенид может быть получен присоединением одной молекулы галогена к алкину при низких температурах, причем реакция протекает преимущественно как транс-присоединение.
Реакции присоединения галогенов к алкинам как и другие реакции электрофильного присоединения, происходят медленнее, чем реакции присоединения к алкенам.
HCº C-CH2-CH=CH2![]() HCº C-CH2-CHBr-CH2Br
(90%)
HCº C-CH2-CHBr-CH2Br
(90%)
Такое соотношение реакционных способностей связано с различием устойчивости карбкатионов, образующихся при присоединении электрофильного реагента к кратным связям
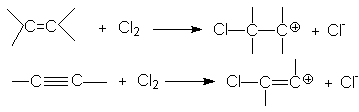
Можно видеть, что винил-катион менее устойчив по сравнению с алкил-катионом, поэтому образование последнего характеризуется более низким энергетическим барьером. В целом механизм галогенирования алкина (на примере бромирования) может быть представлен следующими стадиями: