
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
Нитросоединениями называются органические вещества, в молекуле которых содержится функциональная группа NO2. Нитрогруппа может быть соединена с органическими радикалами различного строения, т.е. нитросоединения различаются на алифатические, непредельные, ароматические:

Получение нитросоединений
Нитроалканы могут быть получены как нитрованием алканов (свободнорадикальное замещение водорода), так и нуклеофильным замещением галогена или другой уходящей группы. В реакции нитрования во всех случаях кроме метана образуется смесь изомеров. Эта реакция была открыта Михаилом Коноваловым и имеет огромное историческое значение, т.к. способствовала интенсивному развитию химически мало активных парафинов.

Реакции имеет свободнорадикальный характер и зачастую сопровождаются разрывом углерод-углеродной цепи. Нитрование по Гессу, заключающееся в действии на алканы концентрированной азотной кислотой при высокой температуре, приводит к образованию целого спектра продуктов, значительная часть которых образуется в результате нитрования фрагментов молекулы исходного алкана:

В лабораторной практике чаще всего используются реакции замещения галогена в галгеналканах действием солей азотистой кислоты. Анион O=N-O- относится к амбидентным реагентам, поэтому в зависимости от условий реакций и структуры субстрата, в синтезе наряду с нитроалканами образуются алкилнитриты – алкиловые эфиры азотистой кислоты.

Алкилнитриты проявляют меньшую устойчивость, чем нитроалканы, они способны претерпевать перегруппировку в нитроалканы и гидролизоваться с образованием спирта и азотистой кислоты.
Собственно нитрометан на практике синтезируют из монохлоруксусной кислоты по схеме:

Нитроалкены чаще всего образуются при самопроизвольной дегидратации β-нитроспиртов, которые могут быть получены конденсацией нитроалканов с альдегидами.
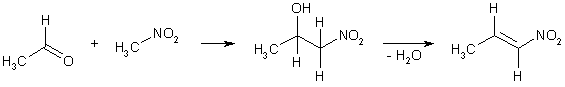
Нитроарены могут быть получены либо электрофильным замещением водорода, либо посредством нуклеофильного замещения функциональных групп (галогены, диазогруппа) в ароматическом кольце. Следует отметить, что реакция нитрования ароматических соединений находит большее применение в практике, чем свободнорадикальное нитрование алканов, т.к. зачастую протекает избирательно и с хорошим выходом.

В зависимости от количества и концентрации используемой HNO3 и условий реакции (температура, катализатор) в ароматическое ядро можно ввести разное количество нитрогрупп. Электрофильное нитрование неприменимо лишь в случае сильно активированных субстратов, которые легко окисляются азотной кислотой (например, ариламинов) (см. главу Амины).
В реакцию нуклеофильного замещения нитрогруппой легче всего вовлекается диазониевая группа, а соли диазония могут быть получены практически из любых ароматических аминов. Катализатором превращения служат ионы одновалентной меди (реакция Т. Зандмейера).
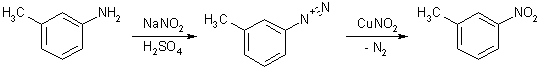
Строение нитросоединений
Нитрогруппа имеет плоскую геометрию, атом азота и оба атома кислорода находятся в состоянии sp2-гибридизации. Атомы кислорода нитрогруппы, как и в карбоксилат-ионе, эквивалентны. Дипольные моменты нитросоединений имеют величину в пределах 3,15 – 3,7 D, что объясняется высокой полярностью нитрогруппы, которую можно представить как N-оксид нитрозогруппы

Длина связи N-O одинакова для обоих атомов кислорода и составляет 122 пм, порядок p-связей равен 0,25, угол ONO составляет 125°. Согласно квантово-химическим расчетам избыток электронной плотности сосредоточен на атомах кислорода (0,16), на атоме азота наведен положительный заряд. Ввиду того, что нитрогруппа построена из трех атомов более электроотрицательных элементов, чем углерод, она обладает сильными (-)I- и (-)M-эффектами. Проявление мезомерного эффекта обусловлено тем, что спиновая плотность π-связи N-O смещена к атому кислорода. Нитрогруппа относится к самым сильным мезомерным акцепторам электронов среди незаряженных функциональных групп.
НИТРОЗОСОЕДИНEНИЯ
(С-нитрозосоединения), содержат в молекуле одну или неск. нитрозогрупп —N=O, связанных с атомами углерода. Известны также N- и О-нитрозосоединения (см. Нитрозамины и Нитриты органические). Обычно Н. существуют в виде равновесной смеси мономера и димера (для последнего характерна геом. изомерия):

Назв. мономерных Н. производят прибавлением префикса "нитрозо" к назв. соединения-основы.
В индивидуальном состоянии большинство Н. находятся в виде димеров, однако введение электроноакцепторных заместителей в орг. остаток приводит к преобладанию мономеров (напр., трихлор- и трифторнитрозометаны). В димер-ных Н. транс-изомеры стабильнее цис-изомеров. В р-рах или при нагревании димерные Н. диссоциируют, по крайней мере частично. Вицинальные ароматические Н. или непредельные димерные Н. димеризуются специфически, давая фуроксаны, а перфторалкильные Н. при облучении димеризуются в соответствующие О-нитрозогидроксиламины, напр.:
![]()
Нитрозогруппа в мономерных и димерных Н.-плоская, напр. для нитрозометана длины связей 0,149 нм (С—М) и 0,122 нм (N—О), угол CNO 112,6°.
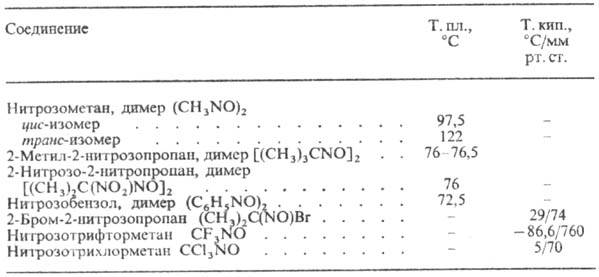
Физические свойства. Мономерные Н.-газы или жидкости голубого или зеленого цвета, хорошо раств. во мн. орг. р-рителях, димерные Н.-бесцв. кристаллы, раств., как правило, в полярных р-рителях. Св-ва нек-рых Н. приведены в таблице.
В И К спектрах Н. присутствуют интенсивные полосы, соответствующие валентным колебаниям группы NO: для мономерных алифатических и ароматических Н. при 1540-1620 или 1500-1512 см-1 соотв.; для транс-димеров алифатических и ароматических Н. при 1176-1290 и 1253-1299 см-1; у цис-димеров эти полосы смещены в область больших частот и проявляются в виде дублетов при 1323-1344 и 1330-1420 см-1 (алифатические Н.) и 1389 и 1409 см-1 (ароматические Н.).
СВОЙСТВА НЕКОТОРЫХ НИТРОЗОСОЕДИНЕНИЙ
В
УФ спектрах мономерных Н. наблюдаются
три максимума: 630-790 нм (e ![]() 45-60, п
45-60, п![]() p-переход),
270-290 нм (e
p-переход),
270-290 нм (e![]() 80, о
80, о![]() p*-переход)
и 220 нм (e
p*-переход)
и 220 нм (e![]() 5.103, п
5.103, п![]() p*-пере-ход).
Для транс-димеров
lмакс 280-300
нм (e
p*-пере-ход).
Для транс-димеров
lмакс 280-300
нм (e ![]() 5.103 -—
12.103,
p
5.103 -—
12.103,
p![]() p*-переход),
а для цис-димеров
этот максимум сдвинут в коротковолновую
область на 10-15 нм.
p*-переход),
а для цис-димеров
этот максимум сдвинут в коротковолновую
область на 10-15 нм.
В спектрах ПМР Н. хим. сдвиги a-Н-атома близки к хим. сдвигам аналогичных протонов в соответствующих нитро-соед., причем они различны для мономеров и цис-, и таранс-димеров Н., что позволяет оценить их количественно в равновесной смеси. В спектре ЯМР на ядрах N хим. сдвиги Н. весьма характерны, хотя и проявляются в широком диапазоне в значительно более сильных полях, чем в соответствующих нитросоед. (5 от 300 до 550 м.д.).
Химические свойства. Особенность алифатических Н., содержащих a-Н-атом,-их необратимая изомеризация в оксимы:
![]()
реакция
катализируется основаниями, водой и
полярными р-рителями. Окислители (О3,
Н2О2,
орг. перкислоты, О2 воздуха
и др.) окисляют Н. в соответствующие
нитросоединения. Восстановление Н. в
зависимости от восстановителя приводит
к гидроксиламинам [NaBH4,
арсенат (III) и т. п.] или к аминам (металл
в к-те, Н2 над
Ni-Ренея и др.), причем процесс осложняется
конденсацией Н. с промежуточными и
конечными продуктами соотв. в азокси-
и азосоединения. При действии производных
Р(III) происходит дезоксигенирование Н.
с образованием нитренов ![]() ,
к-рые далее конденсируются с исходным
Н. или вступают во взаимод. с р-рителем.
,
к-рые далее конденсируются с исходным
Н. или вступают во взаимод. с р-рителем.
Н. взаимод. с N,N-дигалогенаминами в присутствии солей Сu+ с образованием азоксисоед. RN(O)=NR'. Для Н. характерны р-ции по кратным связям. Так, с олефинами возможны три типа превращений: а) 1,2-присоединение с образованием оксазетидинов; б) 1,4-присоединение (диеновый синтез) с образованием дигидрооксазинов; в) конденсация двух молекул Н. с одной молекулой олефина, приводящая к дигидро-1,3-диокса-2,4-диазинам:
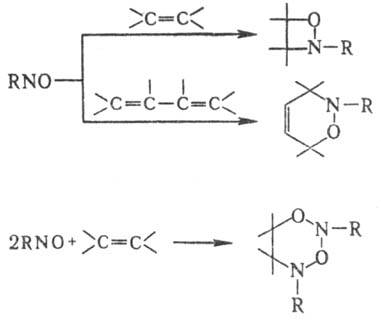
Направление р-ции зависит от природы Н. и олефина.
С илидами серы Н. взаимод. по схеме переилидирования, давая нитроны, а с илидами фосфора - по типу р-ции Витти-га, образуя азометины:

Ароматические Н. реагируют с соед. с активной метиле-новой группой в присутствии основных катализаторов, образуя N-ариламины или нитроны:

Н. присоединяют HN3 по связи N=O и нек-рые др. к-ты, а также реактивы Гриньяра.
Третичные и ароматические Н. с активными радикалами R. образуют стабильные нитроксильные радикалы, напр.:

Это св-во позволяет использовать Н. в спиновых ловушек методе.
Получение. Общий способ получения Н.-окисление первичных аминов к-той Каро (выход Н. 30-70%) или гидро-ксиламинов орг. перкислотами, Наl2, HgO и др. Можно использовать окисление орг. перкислотами азометинов, нитронов (окислителем м. б. также О3) и диметилсульфид-иминов (в неполярном р-рителе), напр.:

Н. получают также введением нитрозогруппы в молекулу орг. соед. путем замещения атома водорода (нитрозирование). Для синтеза функционально замещенных алифатических Н. используют нитрозирование соед., содержащих активирующие группы [COR, NO2, CN, C(R)=NH] у нитро-зируемого атома углерода; нитрозирующие агенты-N2O3 или NaNO2/H2SO4. Нитрозирование этими же реагентами вторичных нитросоед.- общий способ получения псевдонит-ролов RR'C(NO)NO2. Для получения алифатических Н. можно использовать радикальное нитрозирование углеводородов, а также действие NO на алхилиодиды (в синтезе перфторалкилнитрозосоед.), напр.:

При действии на кетоксимы галогенов образуются a-хлор-нитрозосоед., в присутствии N2O4 — псевдонитролы, при действии тетраацетата Pb-a-ацетоксинитрозосоед., напр.:
![]()
Вицинальные хлор- или нитрозамещенные Н. получают с хорошим выходом присоединением соотв. NOCl или N2O3 к олефинам. При действии этих же реагентов на Ag-соли или ангидриды карбоновых к-т карбоксильная группа заменяется на группу NO, напр.:

Однако этот метод синтеза Н. менее распространен.
Нек-рые Н. можно получить действием NOCl на ртутьорг. производные, напр.:
![]()
Специфич. методы синтеза ароматических Н.-нитрозирование ароматич. аминов или фенолов действием NaNO2/ H2SO4 с образованием соотв. пара- и орто-замещенных продуктов. Для получения ароматических Н. иногда используют внутримол. диспропорционирование, напр.:
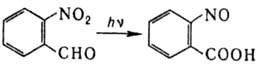
Свойства соединений, имеющих α-водородные атомы.
1. Альдольная конденсация. Под действием каталитических количеств водной кислоты или основания альдегиды превращаются в β-оксиальдегиды. Этот процесс носит название альдольной конденсации:
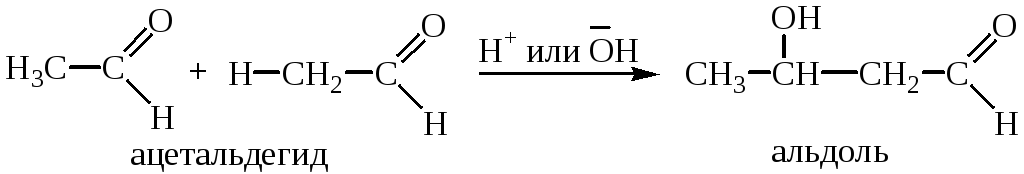
Альдольная конденсация, катализируемая основаниями. Катализируемая основаниями альдольная конденсация начинается с образования енолят-иона альдегида (стадия 1). Поскольку енолят-ион является нуклеофилом, то он атакует карбонильную группу другой молекулы альдегида. В результате образуется алкоксид-ион (стадия 2). Далее происходит протонирование алкоксид-иона водой, при этом образуется конечный продукт – альдоль и регенерируется катализатор (ОН-) (стадия 3). Это происходит потому, что алкоксид-ион является более сильным основанием, чем гидроксид-ион.
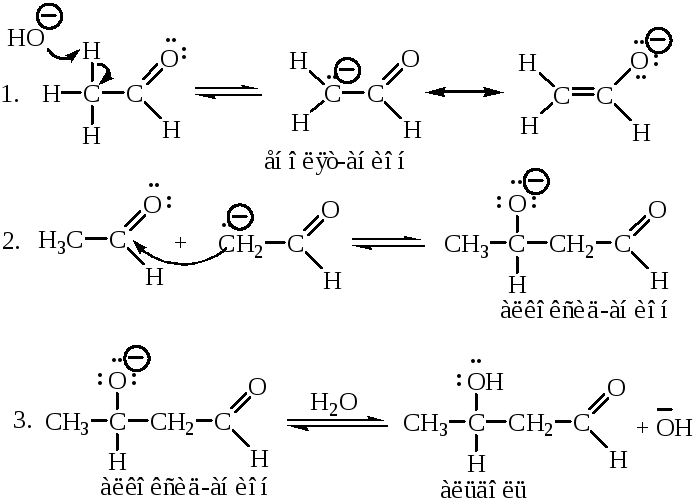
При нагревании в присутствии основания альдоли легко отщепляют воду, образуя ,-ненасыщенные альдегиды. Дегидратация протекает легко благодаря кислому характеру атома водорода у -углеродного атома углерода и вследствие того, что образующийся продукт содержит сопряженную систему двойных связей:

Этот тип конденсации получил название кротоновой.
Альдольная конденсация, катализируемая кислотами. Механизм альдольной конденсации, катализируемой кислотами, включает две основных стадии: превращение кето-формы альдегида в енольную форму (стадия 1) и атака образовавшимся енолом карбонильной группы альдегида (стадия 2):

Альдоль под действием разбавленной кислоты отщепляет воду даже при комнатной температуре, поэтому конденсацию, катализируемую кислотой, практически невозможно остановить на стадии -оксиальдегида:

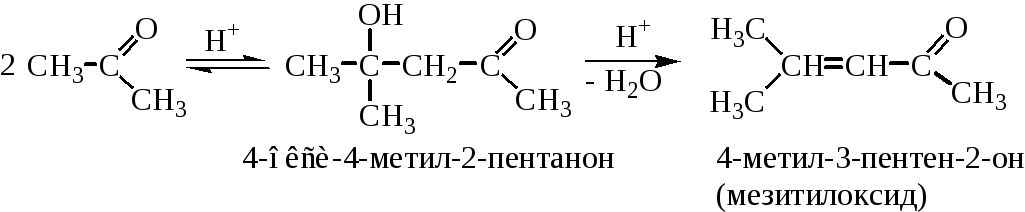
Кетоны вступают в альдольную конденсацию значительно труднее, чем альдегиды. Однако, при катализе кислотами образующийся в небольших количествах 4-окси-4-метил-2-пентанон (продукт альдольной конденсации) будет быстро дегидратироваться в 4-метил-3-пентен-2-он (мезитилоксид):
Нитроловые кислоты и псевдонитролы.
представляют вещества общей формулы ![]() . Для получения их смешиваютраствор первичного нитросоединения (см.) в едком кали с раствором азотистой соли и подкисляют сернойкислотой; сначала появляется кроваво-красное окрашивание, исчезающее, как скоро жидкость становитсякислой; образовавшаяся Н. кислота может быть из водного раствора извлечена эфиром (Виктор Мейер, Черняк, Констан, Цюблин, Демоль). Н. кислоты — бесцветные вещества, легко растворимые в воде, обладающие сильно кислой реакцией и сладким вкусом; некоторые очень хорошо кристаллизуются. Характеризуются Н. кислоты кроваво-красным окрашиванием водных растворов щелочных солей; последние, а равно и соли тяжелых металлов, до сих пор не получены в чистом состоянии.При нагревании Н. кислоты распадаются с бурным выделением газов, состоящих из азота и двуокиси азота, и образованием соответственных жирных кислот:
. Для получения их смешиваютраствор первичного нитросоединения (см.) в едком кали с раствором азотистой соли и подкисляют сернойкислотой; сначала появляется кроваво-красное окрашивание, исчезающее, как скоро жидкость становитсякислой; образовавшаяся Н. кислота может быть из водного раствора извлечена эфиром (Виктор Мейер, Черняк, Констан, Цюблин, Демоль). Н. кислоты — бесцветные вещества, легко растворимые в воде, обладающие сильно кислой реакцией и сладким вкусом; некоторые очень хорошо кристаллизуются. Характеризуются Н. кислоты кроваво-красным окрашиванием водных растворов щелочных солей; последние, а равно и соли тяжелых металлов, до сих пор не получены в чистом состоянии.При нагревании Н. кислоты распадаются с бурным выделением газов, состоящих из азота и двуокиси азота, и образованием соответственных жирных кислот:  ; принагревании с водой или кислотами тоже образуются жирные кислоты, а азот выделяется в виде закиси азота
; принагревании с водой или кислотами тоже образуются жирные кислоты, а азот выделяется в виде закиси азота ![]() ; очень вероятно, что образованию закиси азота предшествуетобразование гидроксиламина и азотистой кислоты (В. Мейер) по уравнению:
; очень вероятно, что образованию закиси азота предшествуетобразование гидроксиламина и азотистой кислоты (В. Мейер) по уравнению:
![]()
,
а затем гидроксиламин с азотистой кислотой выделяет закись азота: H2N.OH+HNO2=N2О+2Н2О. Привосстановлении Н. кислот главными продуктами тоже являются жирные кислоты и аммиак (гидроксиламин илиазотистая кислота, смотря по условиям), но кроме того образуются в небольшом количестве какие-то, покамало известные вещества, содержащие меньше кислорода, чем Н. кислоты. Строение Н. кислот, данноевыше, основывается главным образом на том, что они могут быть получаемы при действии гидроксиламинана дибромопроизводные первичных нитросоединений (см.):

.
Более характеризованы: метилнитроловая кислота — СН.(NO2)(NOH), представляющая иглы, пл. при 64°С илегко растворимые в воде, и этилнитроловая кислота — CH3.C(NO2)(NOH) = C2H4N2O3, которая может бытьполучена в очень больших, желтоватых, блестящих кристаллах, пл. при 81° — 82° с разложением; придействии амальгамы натрия этилнитроловая кислота образует (В. Мейер, Констан, Тер-Меер) этилазауроловую кислоту — (C2H4N2O)2=C4H8N4O2, которая может дальше перейти в этиллеиказон — C4H7N3O, вещества, строение которых до сих пор совершенно неизвестно. Н. кислоты, благодаря окраскещелочных солей, применяются, как качественная проба на первичные нитросоединения.
