
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
Способы получения и природные источники
Важнейшими природными источниками алканов являются нефть и природный газ. Нефть — не только топливо, но и ценное химическое сырьё для органического синтеза. Однако она относится к невозобновляемым ресурсам. Кроме того, алканы входят в состав природного горючего газа, попутного нефтяного газа, озокерита, горючих сланцев.
При разгонке нефти получаются различные смеси алканов, которые используются в виде следующих фракций: бензин (углеводороды С5—С11), лигроин (углеводороды С8—С14), керосин (углеводороды С12—С18), дизельное топливо (углеводороды С14—С25), смазочные масла (углеводороды С20—С34), вазелин, твёрдый парафин, гудрон. Высшие фракции разгонки нефти подвергают крекингу для получения высокосортных бензинов.
Попутными нефтяными газами являются, главным образом, растворённые в нефти метан, этан, пропан, бутан и пентан примерно в равных количествах, но обычно с преобладанием метана (иногда до 50%).
Метан встречается в природе также в виде болотного газа и рудничного газа. Наибольшее содержание метана в природном горючем газе (от 60% до 99%), а этан, пропан и бутан встречаются в нём в качестве примеси.
Перспективным источником получения метана и ряда других веществ, представляющих интерес как топливные материалы, является микробиологический способ переработки, в том числе и биоотходов. Ежегодный прирост биомассы на Земле составляет более 200 млрд т. При воздействии анаэробных микробов (развивающихся без доступа кислорода), например на целлюлозу, образуется в качестве одного из продуктов метан:
(C6H10O5)n + n H2O ® 3n CO2 + 3n СН4
Алканы могут быть получены из метана, который подвергают конверсии с водяным паром на никелевом катализаторе при температуре 1000—1050 К.
CH4 + H2O ® CO + 3 H2
Образующийся при этом синтез-газ в более мягких условиях (в присутствии никелевого или кобальтового катализатора при температуре 450—500 К) превращается в углеводороды и водяной пар:
n CO + (2n+1) H2 ® CnH2n+2 + n H2O
Этот метод используется в технике для получения синтетического бензина.
Другими синтетическими способами получения алканов являются:
гидрирование непредельных углеводородов в присутствии катализатора (Ni, Pt, Pd):
СН2=СН2 + Н2 ® СН3СН3
СНºСН + 2 Н2 ® СН3СН3
(подробнее эти реакции будут рассмотрены в свойствах соответствующих углеводородов);
восстановлением йодоводородом при нагревании производных алканов (йодалканов, спиртов — гл. 3.2.2.3, 3.3.3.1):
R–I + HI ® RH + I2
R–OH + 2 HI ® RH + I2 + H2O
из галогеналканов (гл. 3.2.2.3):
а) через магнийорганические соединения
R–Br + Mg ® R–MgBr
R–MgBr + H2O ® RH + Mg(OH)Br
б) по реакции Вюрца*
2 R–Br + 2 Na ® R–R + 2 NaBr
при сплавлении солей карбоновых кислот со щелочами в лабораторных условиях при 500—600 К можно получить метан:
 ,
,
но эта реакция может быть использована и для получения других низших алканов (подробнее будет рассмотрена в свойствах карбоновых кислот — гл. 6.4.4.4);
гидролиз карбида алюминия ¾ удобный способ получения метана в лаборатории:
Al4C3 + H2O ® CH4 + Al(OH)3
электролиз натриевых и калиевых солей монокарбоновых кислот по Кольбе* ¾ способ получения алканов с чётным числом атомов углерода в молекуле:
![]()
R× + × R ® R–R ;
из альдегидов и кетонов по реакции Кижнера*-Вольфа*:

Механизмы реакции нуклеофильного замещения у sp3 гибридизированного атома углерода: мономолекулярное, биомолекулярное, внутримолекулярное замещение. Примеры механизмов реакций и свойств спиртов, простых эфиров, галогеноалканов, галогеноалкенов.
Галогеноалканы: классификация, номенклатура, изомерия (структурная, конформационная) строение (первичные, вторичные, третичные, алкилгалогениды). Реакции нуклефольного замещения и отщепления. Способы получения: из алканов, алкенов, алкинов, спиртов – механизм реакции. Реакция Вюрца. Получение реактива Гриньяра и использование его для спиртов.
Галогеналканы
Галогеналканы, или алкилгалогениды, — это галогенопроизводные предельных углеводородов (алканов), то есть это продукты замещения одного или нескольких атомов водорода в молекуле алкана атомом (или атомами) галогена.
3.2.1. Классификация, номенклатура, изомерия
В зависимости от числа атомов галогена и от их природы галогеналканы можно разделить на
моногалогеналканы, содержащие один атом галогена, и
ди-, три- и полигалогеналканы, в молекулах которых несколько атомов галогена.
Моногалогеналканы классифицируют на первичные, вторичные и третичные в зависимости от природы атома углерода, у которого находится галоген.
Среди дигалогеналканов выделяют геминальные, в которых атомы галогена находятся у одного атома углерода, и вицинальные с расположением атомов галогена у соседних углеродных атомов, например,
CH3-CH2-CHCl2 1,1-дихлорпропан (геминальный) |
CH3-CHCl-CH2Cl 1,2-дихлорпропан (вицинальный) |
В зависимости от природы атомов галогена различают фтороалканы, хлороалканы, бромоалканы и йодоалканы. (А такие полигалогеналканы, как, например, CClF3, могут быть одновременно отнесены и к фтороалканам, и к хлороалканам.)
Для названия галогеналканов применяются как заместительная, так и радикало-функциональная номенклатуры ИЮПАК. Для низших и наиболее распространённых представителей приемлемыми являются и тривиальные названия, например, фтороформ, хлороформ, бромоформ, йодоформ, фторотан. В заместительной номенклатуре наличие атома галогена в молекуле обозначается приставкой, например, хлор(о)-. При этом соединительная гласная «о» при написании и при произношении часто опускается. Пример:
|
2-хлоробутан (или 2-хлорбутан) |
По радикало-функциональной номенклатуре к названию углеводородного радикала добавляется название галогена в анионной форме. Например, название этого же соединения по радикало-функциональной номенклатуре — втор-бутилхлорид.
Принципиального отличия в существовании того или иного вида изомерии у галогеналканов от алканов нет. Так, структурная изомерия галогеналканов представлена изомерией углеродного скелета и изомерией положения атома галогена. При этом среди дигалогенопроизводных вицинальные изомерны геминальным. Стереоизомерия связана как с наличием асимметрического атома углерода (в упомянутом выше 2-хлоробутане такой атом углерода есть, а значит, существуют оптические изомеры), так и с возможностью существования различных конформеров (относительно каждой углерод-углеродной связи).
3.2.2. Строение и свойства
В молекулах галогеналканов связь атома углерода с галогеном полярна:

В зависимости от природы галогена от фтора к йоду полярность связи C–Hal уменьшается (так как уменьшается электроотрицательность галогена), но возрастает её поляризуемость и увеличивается длина (так как увеличивается радиус атома галогена), а прочность связи при этом уменьшается (табл. 3.1).
Таблица 3.1
Характеристика связей C–Hal в молекулах галогеналканов
Связь |
Длина, нм |
Энергия диссоциации, кДж/моль |
C—F C—Cl C—Br C—I |
0.142 0.177 0.191 0.213 |
448 326 285 213 |
Поскольку в молекулах имеются центры с повышенной и пониженной электронной плотностью, межмолекулярное притяжение галогеналканов сильнее, чем межмолекулярное притяжение алканов, поэтому температуры кипения галогенопроизводных в целом выше, чем незамещённых углеводородов. Среди моногалогенопроизводных только фторо-, хлоро- и бромометаны — газы, остальные — жидкости и твёрдые вещества. Температуры кипения зависят от природы галогена и увеличиваются от фторопроизводных к йодопроизводным, так как с увеличением геометрических размеров молекул и их поляризуемости возрастают силы сцепления между молекулами. Температуры кипения зависят также от строения углеводородного радикала и уменьшаются от первичных к третичным по той причине, что молекулы становятся более компактными и уменьшается возможность для взаимодействия между их отдельными атомами и группами.
Так как поляризуемость связи C–I наибольшая, то при растворении йодоалканов в полярных растворителях эта связь легко поляризуется вплоть до гетеролитического разрыва, то есть до гетеролитической диссоциации йодоалкана: R–I R+ + I¯. При этом химические свойства соединений сильно зависят от их поляризуемости.
Галогеналканы бесцветны (только полийодпроизводные имеют желтую окраску), со своеобразным сладковатым запахом, нерастворимы в воде, но растворяются в органических растворителях, а некоторые из них сами являются прекрасными растворителями.
Химическая активность галогеналканов обусловлена взаимодействием структурных составляющих молекулы. Реакции нуклеофильного замещения и отщепления являются важнейшими среди химических свойств галогеналканов, хотя далеко не единственными среди них. Рассмотрение химических свойств начнём с примеров наиболее характерных SN- и Е-реакций.
3.2.2.1. Примеры реакций нуклеофильного замещения
1) Гидролиз галогеналканов — это превращение их в спирты по схеме:
R-Hal + H2O R-OH + HHal
Возможно протекание реакции как в нейтральной, так и в кислой и щелочной средах. Механизм реакции: SN1 или SN2 — определяется, в основном, структурой субстрата, а также другими факторами. Например, щелочной гидролиз бромэтана (SN2-механизм):

Кислотный гидролиз 2-бром-2-метилпропана (SN1-механизм):

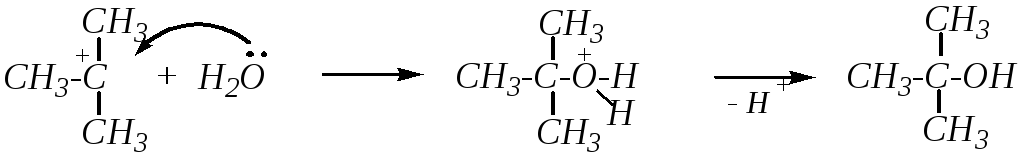
2) Алкоголиз галогеналканов — это взаимодействие галогеналканов с алкоголятами металлов (реакция Вильямсона*), приводящее к образованию простых эфиров:
R-Hal + R-O¯Na+ R-O-R + NaHal
Реакция осуществляется по одному из механизмов нуклеофильного замещения. В ней нуклеофильной частицей является алкоголят-анион R-O¯. При этом при синтезе смешанных эфиров (с разными R и R) необходимо осуществить правильный выбор галогеналкана и алкоголята (RHal и R-O¯ или RHal и R-O¯ — в зависимости от структуры углеводородных радикалов) для того, чтобы реакция протекала с наибольшей скоростью.

