
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
2 . Эффект сопряжения
Теория парциальных валентностей.Вещества с сопряженными двойными связями обладают характерной особенностью: они способны вступать в реакции присоединения таким образом, что присоединение происходит к первому и четвертому атомам углерода, при этом между вторым и третьим атомами углерода возникает двойная связь:
Т еория,
объясняющая эту особенность соединений
с сопряженными двойными связями,
была развита Тиле (1899). В наши дни она
во многом устарела, однако в свое время
сыграла важную роль в химии диенов.
Согласно этой теории, у каждого из атомов
углерода, соединенных двойной связью,
остается способность к присоединению,
так называемая остаточная, или парциальная,
валентность. Она условно обозначается
пунктиром:
еория,
объясняющая эту особенность соединений
с сопряженными двойными связями,
была развита Тиле (1899). В наши дни она
во многом устарела, однако в свое время
сыграла важную роль в химии диенов.
Согласно этой теории, у каждого из атомов
углерода, соединенных двойной связью,
остается способность к присоединению,
так называемая остаточная, или парциальная,
валентность. Она условно обозначается
пунктиром:
В![]() молекуле дивинила у каждого из атомов
углерода ест) парциальные валентности:
молекуле дивинила у каждого из атомов
углерода ест) парциальные валентности:
П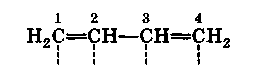 арциальные
валентности второго и третьего атомов
углерода насыщают друг друга, вследствие
чего образуется некоторое подобие
двойной связи. Чтобы отличить эту двойную
связь от обыкновенной двойной связи,
Тиле обозначал ее дугообразной линией:
арциальные
валентности второго и третьего атомов
углерода насыщают друг друга, вследствие
чего образуется некоторое подобие
двойной связи. Чтобы отличить эту двойную
связь от обыкновенной двойной связи,
Тиле обозначал ее дугообразной линией:
Т аким
образом, незамкнутые парциальные
валентности остаются лишь у первого и
четвертого атомов углерода, к которым
и присоединяются оба атома брома при
бромировании. При этом двойные связи
между первым и вторым и между третьим
и четвертым атомами углерода разрываются.
Освободившиеся валентности второго
и третьего атомов углерода насыщают
друг друга, между этими атомами возникает
обычная двойная связь, и у каждого из
них остаются парциальные валентности:
аким
образом, незамкнутые парциальные
валентности остаются лишь у первого и
четвертого атомов углерода, к которым
и присоединяются оба атома брома при
бромировании. При этом двойные связи
между первым и вторым и между третьим
и четвертым атомами углерода разрываются.
Освободившиеся валентности второго
и третьего атомов углерода насыщают
друг друга, между этими атомами возникает
обычная двойная связь, и у каждого из
них остаются парциальные валентности:

Сопряженные диены. Химические свойства: реакции присоединения, окисления, димеризации, диеновый синтез. Полимеризация.
В сопряженных диенах p-электронные облака двойных связей перекрываются между собой и образуют единое p-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):
![]()
Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С-С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p-электронов и тем устойчивее
Наибольшее значение имеют диеновые углеводороды с сопряжёнными двойными связями, в их молекулах двойные связи разделены одной одинарной связью. Например, дивинил СН2=СН–СН=СН2, изопрен СН2=С(СН3)–СН=СН2 и др.
Электрофильное присоединение галогеноводородов
Реакция идет легко. При этом образуется смесь продуктов 1,2- и 1,4-присоединения. Их соотношение зависит от природы реагента и условий проведения реакции.
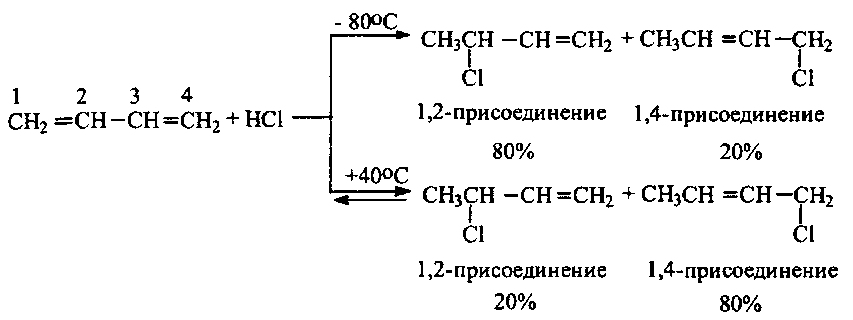
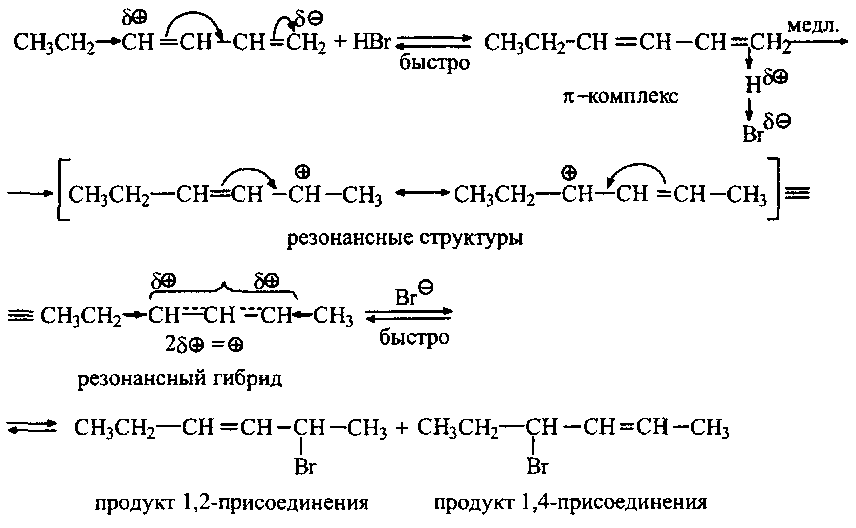
Реакции сопряженных диенов с галогеноводородами идут по механизму электрофильного присоединения (Ae). Полярная молекула Hδ+ →Xδ-своим положительно заряженным концом притягивается π-электронным облаком диена с образованием π-комплекса, который затем медленно перегруппировывается в карбокатион.

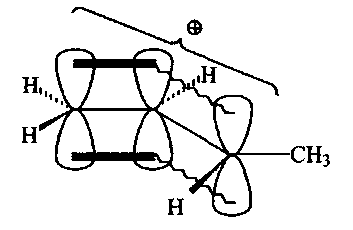
Атомно-орбитальная модель мезомерного карбокатиона аллильного типа
Вследствие сопряжения карбокатионного центра с соседней π-связью положительный заряд распределяется также и на 4-й атом углерода (структура II).
Строение образовавшегося карбокатиона условно изображают двумя предельными структурами I, II. Как уже отмечалось в введении,такие структуры называют резонансными. Ни одна из них не отражает строение реального карбокатиона, которое является промежуточным между двумя граничными состояниями. Это промежуточное состояние карбокатиона отражает формула III - резонансный гибрид. В этой формуле пунктирные линии между атомами показывают, что пара электронов л-связи делокализована в поле трех ядер, а положительный заряд распределен между атомами 2 и 4, что обозначают знаками §+. Карбокатион такого строения называют резонансно-стабилизированным. На последней стадии к электронодефицитным атомам 2 и 4 присоединяется хлорид-анион и образуются два продукта.
Карбокатионы, стабилизированные резонансом, более устойчивы, чем третичные. Этим объясняется более высокая реакционная способность в реакциях присоединения сопряженных диенов по сравнению с алкенами.
Реакции присоединения галогеноводородов к несимметричным диенам протекают по правилу Марковникова с промежуточным образованием наиболее устойчивого карбокатиона. Направление реакций в таких системах определяется также влиянием заместителя на распределение электронной плотности в цепи сопряжения:
Присоединение галогенов
Реакции присоединения хлора и брома протекают аналогично реакциям с галогеноводородами. Соотношение продуктов 1,2- и 1,4-присоединения также зависит от природы реагентов и условий проведения реакции:

В присутствии избытка реагента к оставшейся двойной связи в продуктах 1,2- и 1,4-присоединения может присоединиться еще одна молекула реагента:

Реакции окисления:
Кумулированные диены легко окисляются водным раствором перманганата калия в нейтральной или слабощелочной среде, а также раствор перманганата калия в уксусной кислоте или пиридине вызывают расщепление до карбонильных соединений.

Реакцию димеризации
диенов можно рассматривать как
частный случай диенового синтеза –
соединение 2-х молекул в одну (димер)
Диеновый синтез, реакция 1,4-присоединения диеновых углеводородов с сопряжёнными двойными связями (диенов) к ненасыщенным соединениям (диенофилам). В результате Диеновый синтез образуются шестичленные циклы, содержащие двойную связь между вторым и третьим атомами углерода исходного диена. Типичный пример Диеновый синтез — получение ангидрида тетрагидрофталевой кислоты (III) из бутадиена-1,3 (I) и малеинового ангидрида (II):

Диенофилами обычно служат соединения, содержащие этиленовую или ацетиленовую связь, активированную электроотрицательной группой (— CO —, — COOR, — CN, — NO2 или др.). С такими диенофилами Диеновый синтезосуществляют простым смешением или нагреванием реагентов при 100—120°С. При отсутствии активирующей группы в диенофиле для Диеновый синтез необходимы жёсткие условия. В качестве диенофилов можно применять также карбонильные соединения, например гексафторацетон (CF3)2C = О, нитрозосоединения, например нитрозобензол C6H5— N = О, азосоединения, например гексафторазометан CF3 — N = N — CF3 и др. Роль диенов могут выполнять гетероциклические соединения, например фуран.
Диеновый синтез широко применяют в синтетической органической химии, в том числе для синтеза стероидов.
Полимеризация диенов:
Радикальный механизм

Аллены
В аллене центральный атом углерода находится в третьем валентном состоянии, то есть его атомные орбитали sp-гибридизованы. Все три атома углерода находятся на одной прямой, а плоскости p-связей взаимно перпендикулярны. Длина C=C-связи меньше, чем в алкенах, и это объясняется меньшей протяжённостью sp-гибридной орбитали центрального атома углерода, за счёт которой образуется эта связь.
Благодаря такому строению для замещённых алленов характерна стереоизомерия. Например, приведённые ниже структуры являются зеркальными отображениями друг друга:

В молекулах таких алленов нет центров хиральности. Их асимметрия определяется характером расположения заместителей относительно оси C—C—C, называемой осью хиральности.
Из-за образования одним атомом углерода двух p-связей в молекулах алленов возникает дополнительное напряжение, делающее их менее стабильными по сравнению с другими диеновыми углеводородами. По этой причине реакции, являющиеся общими для углеводородов с двойными связями, для алленов протекают несколько легче.
Гидратация приводит к получению кетонов:

Здесь наблюдается быстрая изомеризация непредельного спирта (енола) в ацетон.
Изомеризация
Под действием оснований аллены изомеризуются в ацетиленовые углеводороды — более устойчивые соединения:

