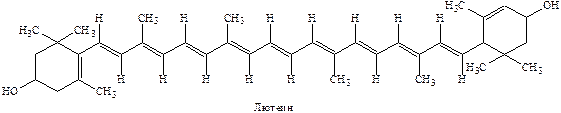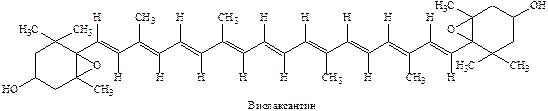- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
Алициклические углеводороды (циклоалканы) – насыщенные углеводороды, молекулы кот.представляют собой цикл углеродных атомов.
НОМЕНКЛАТУРА.
П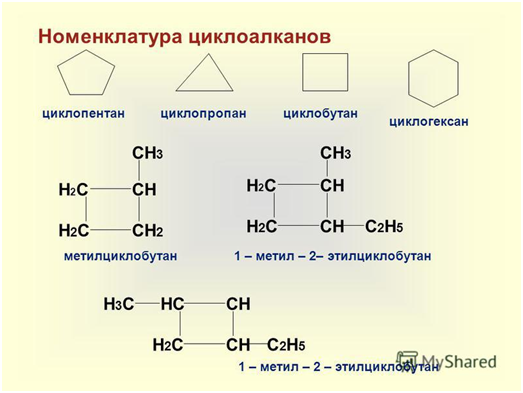
 о
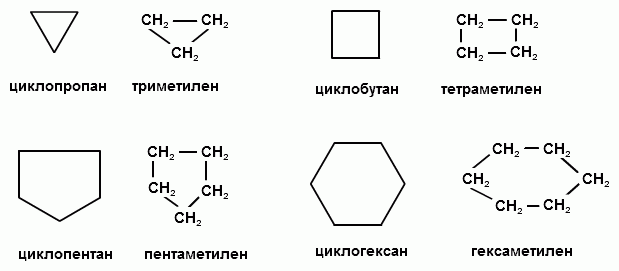
рациональной номенклатуре циклоалканы
рассматриваются как замкнутые цепочки,
состоящие из метиленовых групп
СН2(триметилен,
тетраметилен, пентаметилен, гексаметилен
и т.д.).
о
рациональной номенклатуре циклоалканы
рассматриваются как замкнутые цепочки,
состоящие из метиленовых групп
СН2(триметилен,
тетраметилен, пентаметилен, гексаметилен
и т.д.).
При наличии в молекуле циклоалкана двух и более заместителей, их положение нумеруют таким образом, чтобы сумма номеров была наименьшей. При этом наименьший номер получает младший заместитель.

1,3-диметилциклогексан 1-метил-2-этилциклопентан
СТРОЕНИЕ

СВОЙСТВА.
ФИЗ.При обычных условиях:
С3, С4 – газы;
С5-С16 – жидкости;
С17 и выше – твердые вещества.
Температуры плавления и кипения выше, чем у алканов.
ХИМ.
Малые и обычные циклы имеют различные свойства.
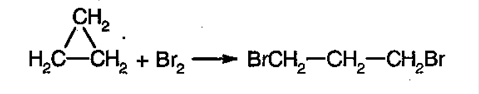
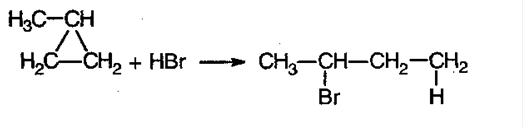
МАЛЫЕ ВЕДУТ СЕБЯ НЕ КАК АЛКАНЫ, А КАК АЛКЕНЫ. Например, для циклобутана и циклопропана свойственна реакция присоединения:
А) брома:
Б) водорода (в присутствие никелевого катализатора):
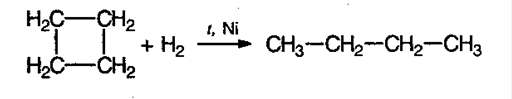
В) галогенводорода (по правилу Марковникова):
Реакция замещения свойственна для обычных циклов, т.к. они более устойчивы:
![]()
Дегидрирование:
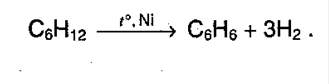
Под воздействием окислителей образуется кислота:
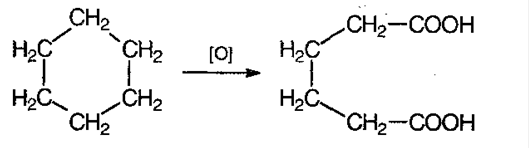
УЧЕБНИК СТР 104.
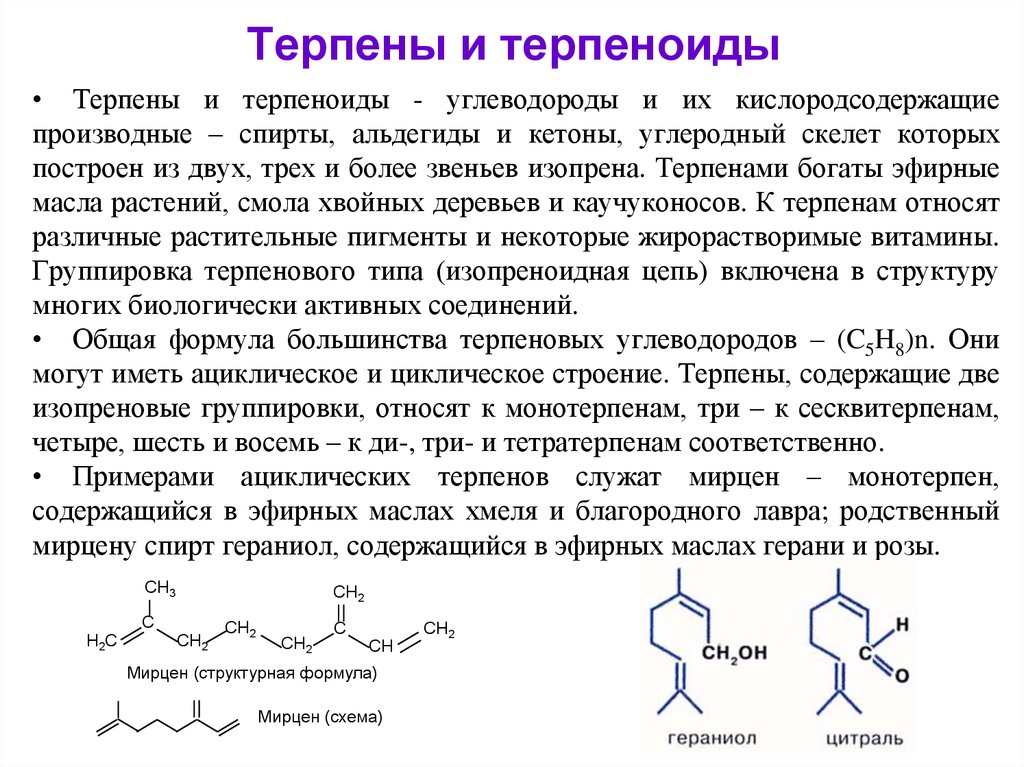
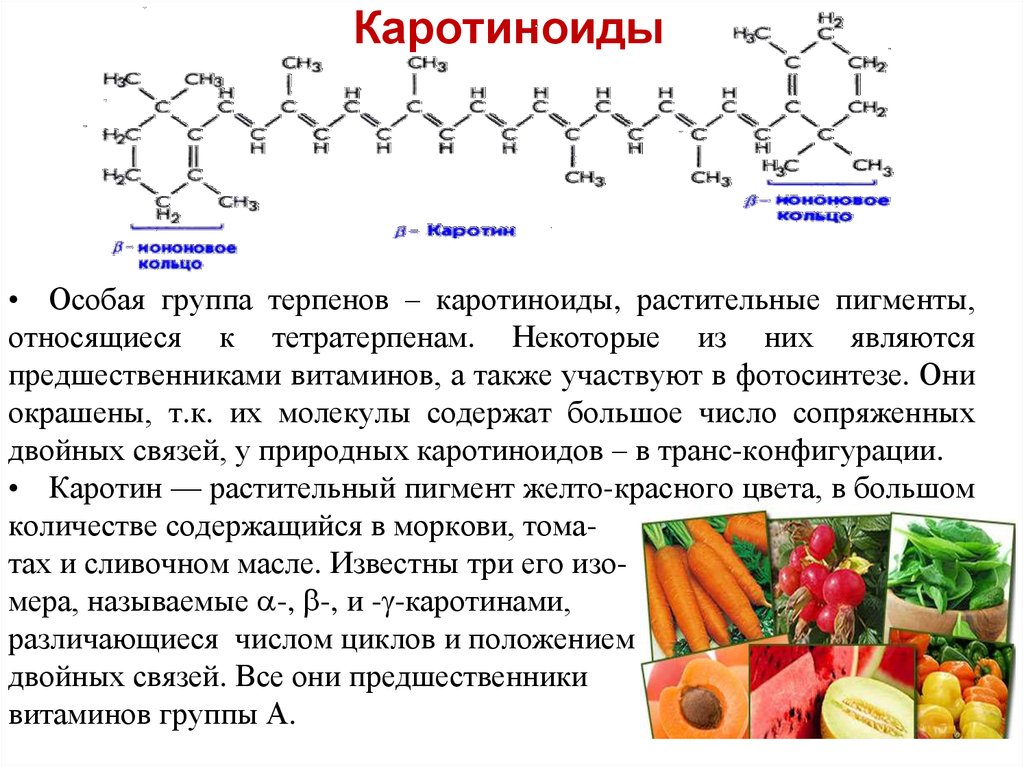
Каротиноиды делят на две группы: каротины и ксантофиллы. Каротины, например α-каротин (С40Н56) представляет собой чистые углеводороды (тетратерпены):
|
|
тогда как ксантофиллы: лютеин С40Н56О2 и виолоксантин С40Н56О4являются окисленными соединениями. Каротины имеют оранжевую или красную окраску, а ксантофиллы – желтую.
|
|
α-Каротин имеет одно β-иононовое кольцо (двойные связи между С5 и С6), а второе – ε-иононовое (двойные связи между С4 и С5). β-Каротин отличается от α- тем, что имеет два β-иононовых кольца.
Ксантофиллы отличаются значительно большим разнообразием, чем каротины, поскольку входящие в их состав кислородосодержащие группы могут быть самыми разнообразными: это может быть гидроксильная группа, кетогруппа, эпоксигруппа и метаксильная группа.
35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
Бензол (циклогексатриен – 1,3,5) – органическое вещество, простейший представитель ряда ароматических углеводородов.
Формула – С6Н6 (структурная формула – рис. 1). Молекулярная масса – 78, 11.
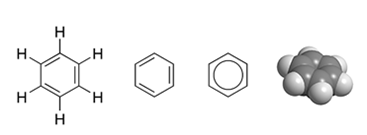
Рис. 1. Структурные и пространственная формулы бензола.
Все шесть атомов углерода в молекуле бензола находятся в sp2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла. Углеводородный радикал, полученный от бензола носит название C6H5 – — фенил (Ph-).
Химические свойства бензола
Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3)
C6H6 + Cl2 = C6H5-Cl + HCl;
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
![]()
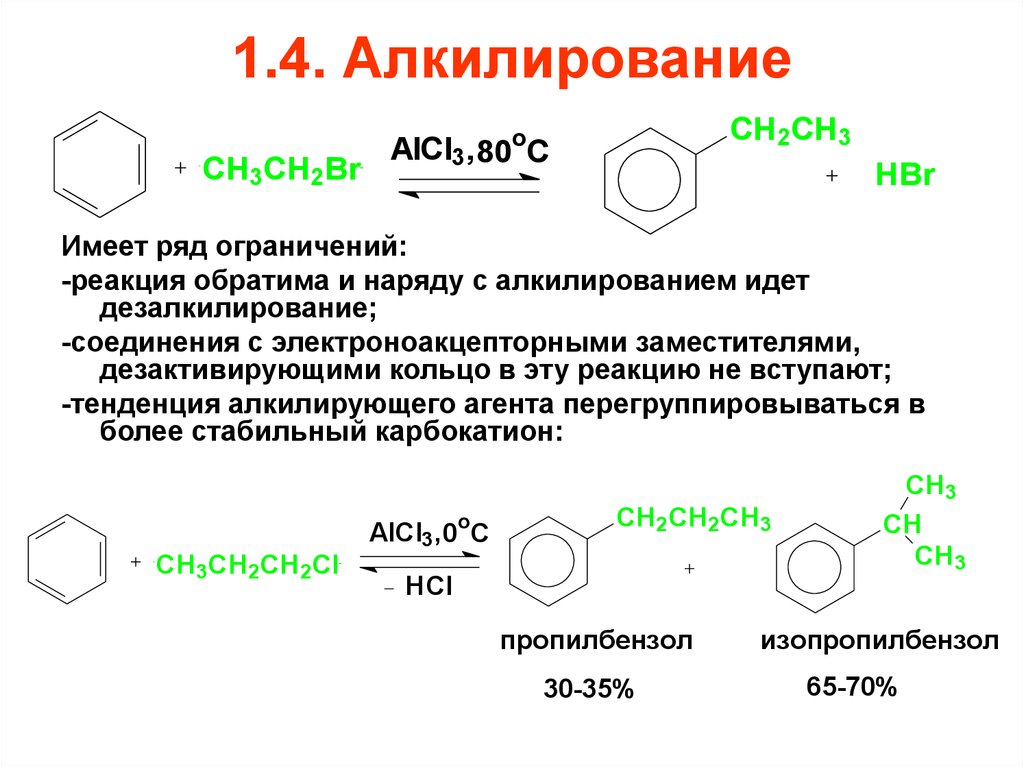
— алкилирование по Фридею-Крафтсу
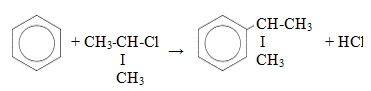
— алкилирование алкенами
C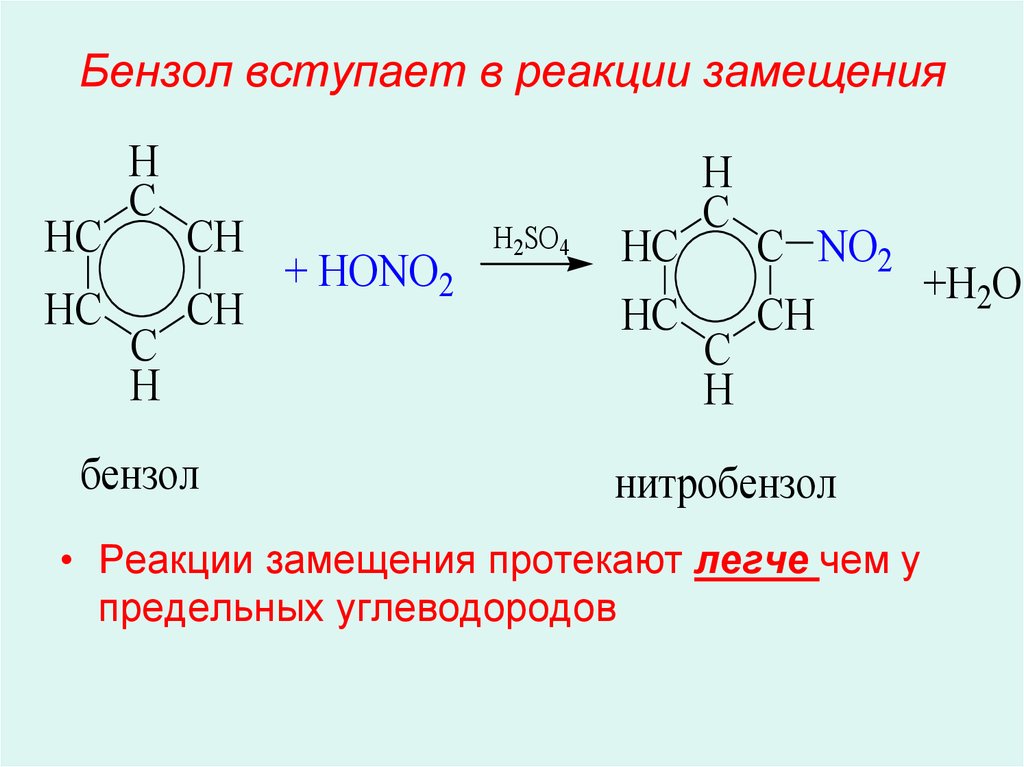 6H6+
CH2 =
CH-CH3 →
C6H5-CH(CH3)2;
6H6+
CH2 =
CH-CH3 →
C6H5-CH(CH3)2;
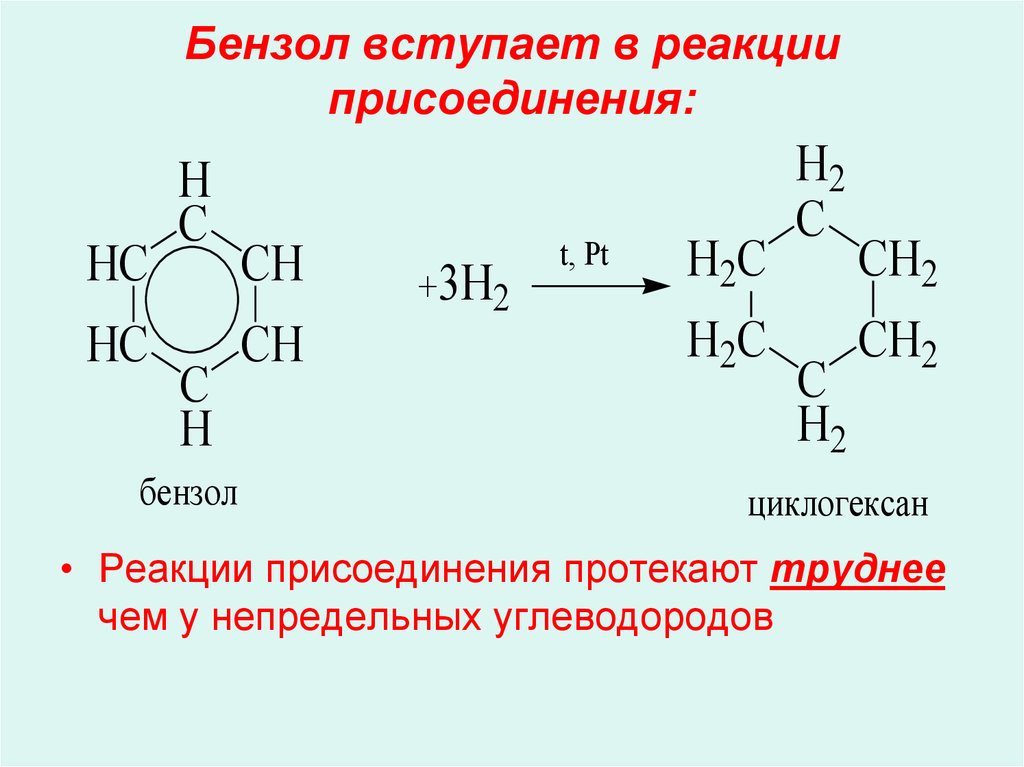
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор – Pt)
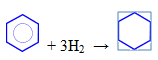
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
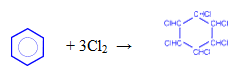
Как и любое органическое соединение бензол вступает в реакцию горения с образованием в качестве продуктов реакции углекислого газа и воды (горит коптящим пламенем):
2C6H6 +15O2 → 12CO2 + 6H2O.

Ф изические
свойства бензола
изические
свойства бензола
Бензол
– жидкость без цвета, но обладающая
специфическим резким запахом. Образует
с водой азеотропную смесь, хорошо
смешивается с эфирами, бензином и
различными органическими растворителями.
Температура кипения – 80,1 С,
плавления – 5,5
С
С,
плавления – 5,5
С .
Токсичен, канцероген (т.е. способствует
развитию онкологических заболеваний).
.
Токсичен, канцероген (т.е. способствует
развитию онкологических заболеваний).
20
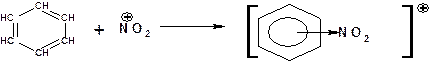
1. На первой стадии образуется электрофильный реагент. В условиях реакции нитрования электрофильным реагентом является нитроний–катион. Образуется нитроний–катион в результате взаимодействия двух молекул азотной кислоты или взаимодействия молекулы азотной кислоты и молекулы серной кислоты:

2. На второй стадии образуется π-комплекс между молекулой бензола и электрофильным реагентом. Особенность π-комплекс в том, что все атомы углерода в молекуле субстрата находятся в состоянии sp2-гибридизации:
3. На третье стадии один атом углерода бензольного кольца переходит в состояние sp3-гибридизации. При этом образуется σ-комплекс или бензенониевый (аренониевый) ион:
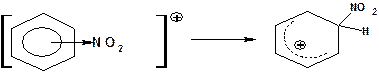
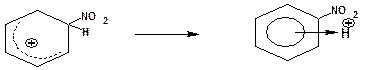
4. На четвертой стадии σ-комплекс перегруппировывается во второй π-комплекс с замещенным атомом углерода:
5. На пятой стадии π-комплекс диссоциирует с образованием конечного продукта замещения:
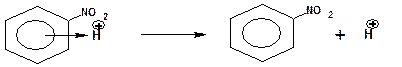
На четвертой стадии механизма σ-комплекс мог бы присоединить нуклеофильный реагент, что привело бы к образованию продукта присоединения и разрушению ароматической системы. Система предпочитает сохранить ароматическую систему, и сама делает выбор в пользу замещения.
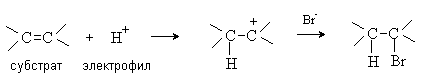
Электрофильная частица (электрофил) — это частица, имеющая незаполненный внешний электронный уровень. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи за счет электронов той частицы, с которой он взаимодействует. В электрофильных реакциях атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой или катионом (Cl2, SO3, BF3, H+, Br+, R+, NO2+, и др.). Все электрофилы – кислоты Льюиса. Электрофил атакует в субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад, а образование новой связи происходит за счет пары электронов субстрата. Пример электрофильной реакции – электрофильное присоединение (символ AdE) к С=С связи:
СЛАБЫЕ ЭЛЕКТРОЛИТЫ в водных растворах лишь частично (обратимо) диссоциируют на ионы. При написании уравнений диссоциации слабых электролитов ставят знак обратимости. К слабым электролитам относятся: · Почти все органические кислоты и вода (Н2О); · Некоторые неорганические кислоты: H2S, H3PO4,HClO4, H2CO3, HNO2, H2SiO3 (смотри кислоты-слабые электролиты в таблице растворимости); · Нерастворимые гидроксиды металлов (Mg(OH)2,Fe(OH)2, Zn(OH)2) (смотри основания-cлабые электролиты в таблице растворимости).
Замещение атома водорода или металла в молекуле органического соединения на ацильную группу называется реакцией ацилирования. РазличаютС-, N- и О-ацилирование. Условно они могут быть представлены следующей схемой:
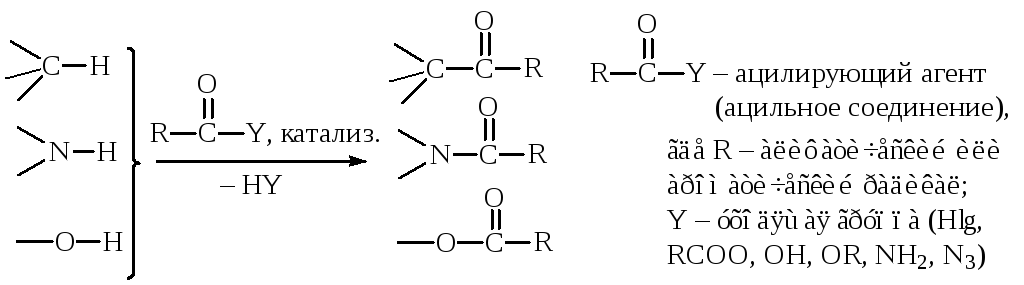
Ацилирующими
агентами являются
соединения общей формулыR–CO–Y, гдеR=
алкил, арил, гетероциклический радикал;Y—
уходящая группа =Hlg,R–COO-,OH,OR,NH2,NHR,NR2,
а такжеN3.
Ацилирование аренов по Фриделю-Крафтсу (синтез ароматических кетонов) может быть представлено схемой:
![]()
Ацилирующими агентамиявляются, в основном, карбоновые кислоты, их ангидриды и хлорангидриды. Реакция родственна алкилированию по Фриделю-Крафтсу, используется для изменения углеродного скелета молекулы, идет по механизмуэлектрофильного замещения, но в отличие от алкилирования, реакция ацилирования необратимая:
 Замена
атома водорода в молекуле органического
соединения у атома углерода, азота,
кислорода на нитрозогруппу, называется,
соответственно, С-, N-, и
О-нитрозированием. Большинство
реакций нитрозирования формальноможно
отнестик реакциям электрофильного
замещения.
Замена
атома водорода в молекуле органического
соединения у атома углерода, азота,
кислорода на нитрозогруппу, называется,
соответственно, С-, N-, и
О-нитрозированием. Большинство
реакций нитрозирования формальноможно
отнестик реакциям электрофильного
замещения.
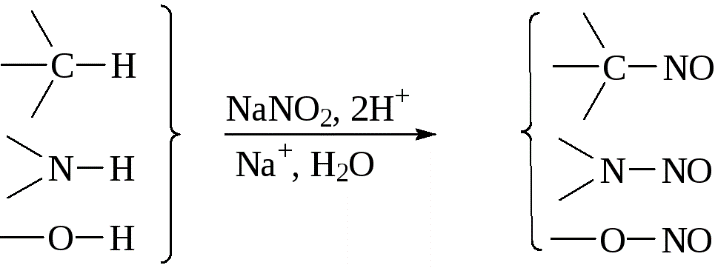
Реакцией азосочетания называют получение азосоединений взаимодействием диазосоединений с веществами, способными замещать атом водорода или другой заместитель у атома углерода.
![]()
Амин, из которого образуется диазосоединение - активный компонент реакции, называют диазосоставляющей. Вещество, с которым диазосоединение реагирует с образованием азосоединения – субстрат, называютазосоставляющей.