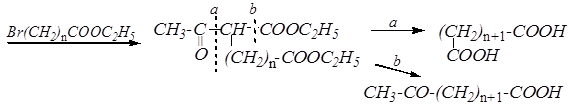- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
Ацетоуксусная
кислота (формула СН3·CO·СН2СООН)
— органическая кетокислота; промежуточный
продукт о бмена
жирных кислотиаминокислот. Ацетоуксусная
кислота — органическое соединение из
группы β-кетокислот.
бмена
жирных кислотиаминокислот. Ацетоуксусная
кислота — органическое соединение из
группы β-кетокислот.
Для ацетоуксусной кислоты характерна кето-енольная таутомерия. В результате индуктивного эффекта кетогруппы ацетоуксусная кислота является более «кислой», чем её основа - масляная кислота.
![]()
Ацетоуксусная кислота реагирует с галогенами(хлором или бромом), которые разлагают её до соответствующе гогалогеноводорода, углекислого газа и галоидацетона (хлор- или бромацетона):

Ацетоуксусная кислота — органическое соединение из группы β-кетокислот. Густая жидкость; хорошо растворима в воде, спирте и эфире. В водных растворах при нагревании разлагается на ацетон (см.) и CO2. В организме образуется как промежуточный продукт обмена жирных кислот и аминокислот лейцина, фенилаланина, тирозина и др. Количество ацетоуксусной кислоты в крови 0,3—2 мг% ; с мочой выделяется 3—15 мг за сутки. Содержание ацетоуксусной кислоты в крови и в моче увеличивается при истощении в печени углеводных резервов (гликогена) вследствие голодания, острых лихорадочных процессов (особенно часто у детей) и др. Очень значительно (до 6 г и более в сутки) выделение ацетоуксусной кислоты с мочой при тяжелых формах сахарного диабета.
Способы получения
Присоединение этилового спирта к дикетену

Сложноэфирная конденсация Кляйзена
Ацетоуксусный эфир образуется при конденсации двух молекул этилацетата под действием этилата натрия:
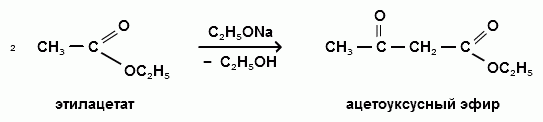
Синтез.
За счёт подвижного атома водорода метиленовой группы и образования енольной формы ацетоуксусный эфир образует металлические производные. Так, с ионами Cu2+ или Fe3+ образуются внутренние комплексы — хелаты. Например:

Синтез одноосновной кислоты или монокетона из ацетоуксусного эфира может быть представлен следующей схемой:
CH3-CO-CH2-COOC2H5 ![]() [CH3-CO-CH-COOC2H5]¯ Na+ ®
[CH3-CO-CH-COOC2H5]¯ Na+ ®
![]() CH3-CO-CHR-COOC2H5
CH3-CO-CHR-COOC2H5 ![]() CH3-CO-CHR-COO¯
®
CH3-CO-CHR-COO¯
®
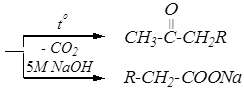
При этом, как видно из схемы, гидролиз сложного эфира проводят в щелочной среде, а так как для осуществления кетонного расщепления необходимо затем провести декарбоксилирование, то реакционная среда для этого не должна быть сильно щелочной. В слабо щелочной среде присутствуют неионизированные молекулы алкилацетоуксусной кислоты, которые и подвергаются декарбоксилированию.
Синтез двухосновных кислот и дикетонов может проводиться тремя методами:
а) с использованием двух молей ацетоуксусного эфира и дигалогеналкана. В этом случае целесообразно в синтезируемой дикарбоновой кислоте или дикетоне выделить по два (или соответственно – три) концевых атома углерода, приходящих в неё из ацетоуксусного эфира, например:
![]()
или
![]()
Центральная часть углеводородной цепи достраивается с помощью соответствующего дигалогенопроизводного Br–CHR–CHR¢–Br. Схема синтеза дикарбоновой кислоты из двух молей ацетоуксусного эфира приобретает следующий вид:
2 CH3-CO-CH2-COOC2H5 ![]()
® 2 [CH3-CO-CH-COOC2H5]¯ Na+ ![]()

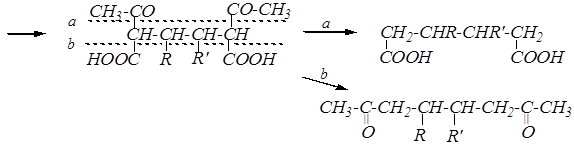
Синтез оксокислоты из ацетоуксусного эфира может быть осуществлён с использованием одного моля ацетоуксусного эфира и эфира галогенозамещённой карбоновой кислоты — путь b. (Этот метод также может быть применён для синтеза дикарбоновых кислот — путь а.)
CH3-CO-CH2-COOC2H5 [CH3-CO-CH-COOC2H5]¯ Na+ ®