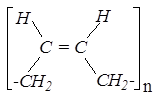- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
4.3.3. Строение и свойства сопряжённых диенов
|
Электронное строение сопряжённых диенов является примером неполярного p-p-сопряжения, которое было рассмотрено ранее (гл. 1.4). В связи с этим сопряжённый фрагмент в молекулах этих углеводородов планарен, двойные связи имеют бóльшую длину, чем углерод-углеродная связь в этилене, а связь между вторым и третьим атомами углерода в этом сопряжённом фрагменте, напротив, короче обычной ординарной связи:

Сравните с длинами связей в этилене и этане (гл. 1.2).
Кроме того, энергетический барьер вращения вокруг связи С2–С3 в бутадиене-1,3 (»21 кДж/моль) значительно больше, чем в этане (»12.6 кДж/моль). Поэтому бутадиен-1,3 по сравнению с этаном может дольше находиться в форме энергетически выгодных конформеров.
Химические реакции сопряжённых диенов, как правило, затрагивают общую систему p-связей. Поэтому при протекании реакций, являющихся общими для непредельных углеводородов, необходимо учитывать некоторые особенности, обусловленные наличием сопряжённого фрагмента.
Гидрирование
Присоединение водорода на катализаторах (гл. 4.1.4.4) приводит к получению насыщенных углеводородов (гидрируются сразу две двойных связи), при этом выделяется значительно меньше тепловой энергии в расчёте на одну связь, чем при гидрировании этилена, что говорит о низкой потенциальной энергии таких молекул и, соответственно, их стабильности вследствие сопряжения.
Восстановление атомарным водородом (водородом в момент выделения), то есть при использовании для восстановления металлического натрия в спирте или цинка в серной кислоте, протекает более избирательно. Взаимодействие диена здесь происходит не с атомом водорода, как это иногда представляют, а с активным металлом:
![]()

Аналогично происходит восстановление сопряжённых триенов. Так, при взаимодействии гексатриена-1,3,5 с цинком в серной кислоте первоначально образуется сопряжённый диен, который затем гидрируется до этиленового углеводорода:
Н2C=CH-CН=СН-CH=CН2 ![]() Н3C-CH=CН-СН=СН-CH3 ®
Н3C-CH=CН-СН=СН-CH3 ®
Н3C-CH2-CН=СН-CH2-CН3
Электрофильное присоединение
Направление присоединения электрофилов к сопряжённым диенам имеет некоторые особенности. В качестве примера рассмотрим взаимодействие бутадиена-1,3 с бромоводородом. Реакция начинается с атаки протоном одной из связей субстрата и после p-комплекса образуется s-комплекс, представляющий собой карбокатион аллильного типа (от назв. соответствующего радикала «аллил» — гл. 4.2.1), стабилизированный р-p-сопряжением:
Н2C=CН-СН=СН2 + Н+ ® Н3C-+CH-СН=СН2
Однако вследствие сопряжения возможна и другая граничная структура такого катиона с переносом положительного заряда:
[Н3C-+CH-СН=СН2 « Н3C-CH=СН-+СН2]
Поскольку в карбокатионе положительный заряд распределён главным образом между двумя атомами углерода, то карбокатион может атаковаться бромид-ионом по двум направлениям:

Первое направление (а) именуют 1,2-присоединение, так как реагент (бромоводород) присоединяется к первому и второму атомам в сопряжённом фрагменте диенового углеводорода; второе направление (b) называют 1,4-присоединение — в этом случае реагент (бромоводород) присоединяется к первому и четвёртому атомам в сопряжённом фрагменте.
В общем случае реакция может идти как по направлению а, так и по направлению b. Однако 1,2-присоединение протекает легче, с большей скоростью, но при этом образующийся продукт малоустойчив и может распадаться на исходные вещества. В противоположность этому 1,4-присоединение протекает медленнее, но продукт реакции термодинамически более стабилен.
На энергетической диаграмме показана потенциальная энергия субстрата при превращении по пути а и по пути b (см. рис. 4.1).
Таким образом, при низких температурах, когда равновесие ещё не достигнуто, образуется преимущественно продукт 1,2-присоединения (его называют кинетически контролируемым), а при обычных или повышенных температурах, то есть при установлении равновесия (чем выше температура, тем быстрее устанавливается равновесие) — продукт 1,4-присоединения (его называют термодинамически контролируемым).
Образовавшийся 1,2-продукт постепенно, через стадию образования карбокатиона, превращается в более устойчивый 1,4-продукт.
Аналогично присоединению бромоводорода преимущественное направление 1,4-присоединения характерно и для других реакций электрофильного присоединения.
При использовании избытка реагента реакция присоединения может идти дальше до полного насыщения кратных связей.
Энергия |
|
Рис. 4.1. Энергетическая диаграмма реакции бутадиена-1,3 с бромоводородом
Образование стабильных аллильных катионов при протонировании сопряжённых диенов даёт возможность протекания реакций алкилирования непредельных углеводородов (алкенов, алкадиенов) и их производных, приводящих к наращиванию углеродной цепи. Этот процесс важен в биосинтезе терпенов и стероидов (о терпенах и стероидах — гл. 8.5, 8.7). Механизм реакции можно рассматривать как типичное электрофильное присоединение:


Радикальное присоединение
Присоединение галогенов, галогеноводородов и других реагентов в условиях гомолитического разрыва ковалентной связи, а значит, по механизму AdR, также сопровождается преимущественным образованием продукта 1,4-присоединения. Например:
R-CН=CН-СН=СН2 +
Br2 ![]() R-CHBr-СН=СН-CH2Br
R-CHBr-СН=СН-CH2Br
Избыток брома приводит к полному насыщению кратных связей.
Диеновый синтез
Реакции диенового синтеза часто называют реакциями Дильса*–Альдера* по имени учёных, внёсших существенный вклад в их изучение. Эти реакции представляют также 1,4-присоединение к диеновым углеводородам с образованием циклических систем. В роли реагента здесь выступает другой непредельный углеводород или, что чаще бывает, его функциональное производное с электроноакцепторными группами. Такие реагенты, взаимодействующие с диенами, в этой реакции называются диенофилами.
Наиболее вероятным здесь является синхронный механизм. Реакция протекает через образование циклического переходного состояния, в котором происходит частичное перекрывание р-орбиталей диена и диенофила:
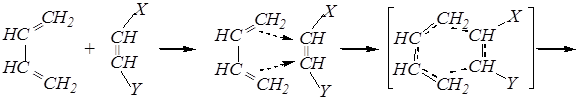
диен диенофил

Удаётся осуществить диеновый синтез и с этиленом, но при повышенных температуре и давлении:
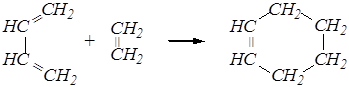
Реакция Дильса–Альдера применяется на первых стадиях синтеза морфина (гл. 12.6), разработанного М. Гейтсом:

За открытие и развитие метода диенового синтеза К. Альдер и О. Дильс были удостоены Нобелевской премии по химии в 1950 году.
Реакция Дильса–Альдера может использоваться для характеристики диенов-1,3.
Реакции полимеризации также протекают преимущественно по направлению 1,4-присоединения. При этом образуются ненасыщенные полимерные углеводороды, обладающие многими ценными качествами, в том числе эластичностью. При полимеризации бутадиена-1,3 образуется эластичный материал, по многим характеристикам близкий к натуральному каучуку; он был назван бутадиеновым синтетическим каучуком. Возможно образование как цис-, так и транс-структур:
|
|
цис- |
|
|
|
транс- |
|
Полимеризация изопрена также может приводить к получению разных стереоизомерных продуктов. В процессе полимеризации по радикальному механизму образуются полимеры с нерегулярной структурой. Однако в присутствии катализаторов Циглера*–Натта* (алюминий- и титанорганические соединения) образуются почти исключительно продукты цис-1,4-присоединения:

Механизм полимеризации здесь карбанионный (гл. 4.1.4.2), инициаторами процесса являются карбанионы R¯.
Такой полимер почти идентичен натуральному каучуку. Высокая его эластичность определяется цис-конфигурацией. В природе также встречается транс-полиизопрен, называемый гуттаперчей, который имеет худшие механические свойства, в частности, не проявляет высоких эластических свойств.
16.Алкины:строение,номенклатура. Кислотные свойства. Реакции электрофильного присоединения в сравнение с алкенами. Реакция Кучерова. Реакции нуклеофильного присоединения. Реакции окисления, изомеризации, полимеризации, комплексообразования. Способы получения.
Алкины (ацетиленовые углеводороды) – углеводороды, молекулы которых содержат тройную связь углерод-углерод. Общая формула алкинов – CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Простейшие представители:

Тройную
связь ![]() осуществляют
6 общих электронов:
осуществляют
6 общих электронов: ![]() .
.

В образовании такой связи участвуют атомы углерода в
sp-гибридизованном состоянии. Каждый из них имеет по две sp-гибридных орбитали, направленных друг к другу под углом 180°, и две негибридных р-орбитали, расположенных под углом 90° по отношению друг к другу и к sp-гибридным орбиталям: