
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
R-Hal
+ NН3
[R-NН3]+Hal¯
![]() R-NН2
+
NН4Hal
R-NН2
+
NН4Hal
Это также типичная SN-реакция. Образовавшийся первичный амин R-NН2 также является нуклеофилом и может вступать в реакцию с галогеналканом R-Hal с образованием вторичного амина R2NН и далее — до третичного амина R3N и солей четвертичного аммония [R4N]+Hal¯. (Такие превращения аминов ещё известны как алкилирование аминов по Гофману — см. также свойства аминов в главе 3.7.3.3.)
4) Замена одного атома галогена на другой. При реакции галогеналканов с галогеноводородом или с галогенид-ионом, где атом галогена отличается от субстратного по своей природе, происходит превращение одного галогеналкана в другой, например:
R-Br + I¯ R-I + Br¯
Скорость и направление реакции сильно зависят от природы обменивающихся атомов галогена и условий проведения реакции (в частности, природы растворителя), так как нуклеофильность галогенид-ионов уменьшается в ряду I¯>Br¯>Cl¯>F¯(гл. 3.1.1), кислая среда и протонные растворители в большей степени способствуют замещению атома фтора, а высокополярные апротонные растворители, наоборот, атома йода.
5) Взаимодействие с цианидами — это взаимодействие галогеналканов с солями синильной кислоты, приводящее к образованию органических цианидов (нитрилов) или изоцианидов. Цианид-ион является амбидентным нуклеофилом, то есть, способен проявлять свои нуклеофильные свойства, как за счёт атома углерода, так и за счёт атома азота:
¯:CN :C=N: ¯
В SN1-реакции с карбокатионом преимущественно взаимодействует реакционный центр с наибольшей электронной плотностью (т.е. реакция осуществляется по наиболее электроотрицательному атому). При SN2-процессе реагирует атом с большей нуклеофильностью (т. е. в данном случае с наибольшей поляризуемостью). Таким образом, изменяя механизм реакции, можно изменять относительную реакционную способность двух реакционных центров.
В данном случае азот является более жёстким, а углерод — более мягким нуклеофильным центром. Следовательно, азот будет предпочтительно взаимодействовать с сильно полярным (жёстким) кислотным центром (положительно заряженный атом углерода в карбокатионе) — механизм SN1. Это приводит к образованию изоцианидов (изонитрилов):
R+ + :C=N: ¯ R-N=С:
Углерод, как относительно мягкий центр нуклеофильной частицы, будет предпочтительно взаимодействовать с атомом углерода значительно менее поляризованной молекулы субстрата (механизм SN2):
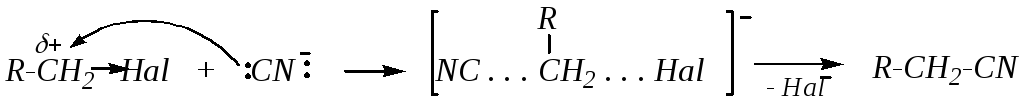
При этом образуются цианиды (нитрилы).
6) Взаимодействие с нитритами. Нитрит-анион, так же как и рассмотренный выше цианид-анион, является амбидентным нуклеофилом. Поэтому его взаимодействие с галогеналканами может привести либо к нитросоединениям, либо к эфирам азотистой кислоты:
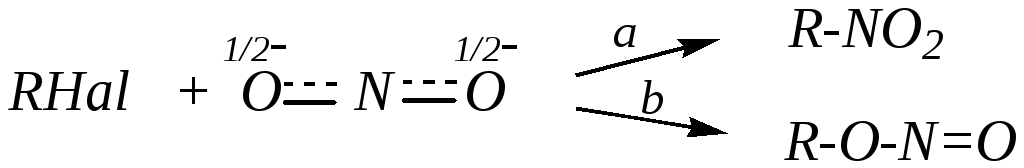
в зависимости от того, с каким нуклеофильным центром в нитрит-анионе происходит взаимодействие галогеналкана. Если внешние факторы способствуют протеканию реакции по SN2-механизму, то субстрат реагирует преимущественно с мягким нуклеофильным центром — атомом азота; это приводит к образованию нитросоединений (путь а). Если же в субстрате достаточно полярная связь С–Hal и возможна его диссоциация по условиям проведения процесса (механизм SN1), то карбокатион субстрата будет взаимодействовать с более жёстким нуклеофильным центром — атомом кислорода; это приводит к образованию алкилнитритов (эфиров азотистой кислоты) (путь b).
Определённую роль при этом может играть также и катион металла. Так, катион Ag+ способствует отщеплению галогенид-иона, то есть диссоциации исходного галогеналкана и образованию карбокатиона. Таким образом, применение нитрита серебра в качестве реагента повышает вероятность образования эфиров азотистой кислоты. Катион Na+, напротив, не способствует отщеплению галогенид-иона. Поэтому замена нитрита серебра на нитрит натрия в этой реакции приведёт к уменьшению доли алкилнитрита и увеличению доли нитросоединения в качестве продукта реакции.
Рассмотренные здесь реакции нуклеофильного замещения галогеналканов могут использоваться для получения других функциональных производных алканов: спиртов, простых эфиров, аминов, органических цианидов и изоцианидов, нитроалканов и алкилнитритов.
3.2.2.2. Пример реакции отщепления
Дегидрогалогенирование галогеналканов. Взаимодействие галогеналканов с твёрдой или спиртовой щёлочью протекает по схеме:
R-CH2-CH2Cl + KOH R-CH=CH2 + KCl + H2O
Возможен как механизм Е1, так и Е2. Нуклеофильное содействие может осуществляться и другими нуклеофильными реагентами. Возможна реакция отщепления для галогеналканов при действии, например, алкоголят-ионов. При этом для вторичных и третичных алкилгалогенидов наблюдается отщепление как по правилу Зайцева (с образованием термодинамически наиболее устойчивого алкена), так и по правилу Гофмана (с разрывом наиболее полярной С–Н-связи). Для реакций галогеналканов это зависит от основности атакующего нуклеофила и его пространственного объёма.
Данная реакция может применяться как способ получения алкенов.
помимо SN- и Е-реакций, для галогеналканов характерны некоторые радикальные реакции, такие как, например, образование металлорганических соединений, и реакции восстановления.
3.2.2.3. Радикальные реакции
1. Образование литийорганических соединений:
R-Cl + 2 Li R-Li + LiCl
Реакция начинается с одноэлектронного переноса, то есть с передачи атомом лития одного валентного электрона алкилхлориду:
RCl + Li [RCl]־+ Li+
Образовавшийся анион-радикал распадается на хлорид-ион и алкил-радикал, который затем взаимодействует со вторым атомом лития:
[RCl]־R + Cl¯
R + Li R-Li
2. Образование реактива Гриньяра*. Реактивами Гриньяра называют магнийорганические соединения — галогениды алкилмагния, которые получают в среде диэтилового эфира, являющегося для них хорошим растворителем, например, по схеме:
R-Cl + Mg R-MgCl
хлорид алкилмагния
Реактивы Гриньяра нашли широкое применение в синтезе представителей различных классов органических соединений. Например, их гидролиз приводит к образованию алканов
R-MgCl + H2O R-H + Mg(OH)Cl
и может в некоторых случаях использоваться как способ получения предельных углеводородов; окисление с последующим гидролизом может использоваться как способ получения первичных спиртов:
R-MgHal
![]() [R-O-O-MgHal]
[R-O-O-MgHal]
![]() 2ROMgHal
2ROMgHal
![]()
2ROH + 2Mg(OH)Hal;
карбоксилирование с последующим гидролизом — как способ получения карбоновых кислот:
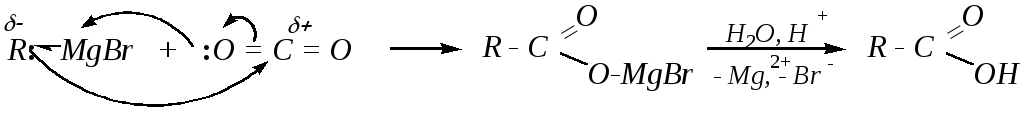
Французский химик В. Гриньяр за открытие магнийорганических соединений, названных впоследствии его именем, был удостоен Нобелевской премии по химии в 1912 г.
3. Реакция Вюрца. Здесь по радикальному механизму протекает образование натрийорганического соединения (аналогично литийорганическому), а дальнейшее его взаимодействие со следующей молекулой галогеналкана с образованием алкана — это уже нуклеофильное замещение:
(SR) R-Cl + 2Na R-Na + NaCl
(SN) -R:Na + +RCl R-R + NaCl
Поэтому в ряде случаев реакция Вюрца используется как способ получения алканов.
4. Восстановление йодоалканов йодоводородом. Реакция происходит при нагревании йодоалканов с йодоводородной кислотой:
R-I + HI RH + I2
Вследствие высокой поляризуемости связь C–I может претерпевать гомолитический разрыв, и реакция с йодоводородом протекает по радикальному механизму:
R-I R + I
R + H-I RH + I
Йодоводородом можно восстанавливать и другие галогеналканы, но в этом случае сначала происходит нуклеофильное замещение:
R-X + HI R-I + HX,
а затем уже восстановление.
3.2.3. Способы получения
1. Одним из способов получения галогеналканов является прямое галогенирование предельных углеводородов, например:
R-H + Br2 R-Br + HBr
Закономерности протекания этих реакций были рассмотрены в свойствах алканов (гл. 2.4.1).
