- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
37.Монозамещенные бензола
Монозамещенные бензолы С6Н5Х могут быть менее или более реакционноспособными, чем сам бензол.
Когда монозамещенные бензолы C6H5Y подвергаются дальнейшему электрофильному замещению, например нитрованию, то новый заместитель может вступать в орто -, мета - или пара-положение, а суммарная скорость замещения может быть больше или меньше скорости замещения самого бензола. Экспериментально установлено, что при наличии заместителя в кольце замещение проходит так, что в основном образуется либо мета-изомер, либо смесь орто - и пара-изомеров. В первом случае суммарная скорость реакции всегда меньше, чем скорость реакции с самим бензолом, а во втором - суммарная скорость обычно больше, чем скорость реакции с бензолом. Основное влияние, как было показано, оказывает уже находящийся в кольце заместитель Y. В молекуле бензола π-электронное облако распределено равномерно между всеми атомами углерода. Но если в бензольное кольцо ввести какой-нибудь заместитель, то равномерность распределения π-электронной плотности нарушается. В результате этого бензольное кольцо становится частично поляризованным, и место вступления нового заместителя определяется природой уже имеющегося заместителя. По своему направляющему действию все заместители делятся на две группы: ориентанты I рода и ориентанты II рода.

Ориент анты I рода
Эти заместители смещают электронную плотность в сторону бензольного кольца. Облегчая вхождение электрофильных реагентов в бензольное кольцо, они ориентируют новый заместитель в орто- и пара-положения.

Ориентанты I рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Ориентанты II рода (мета— ориентанты) – это группировка атомов, способные оттягивать (принимать) электроны от бензольного ядра (электроноакцепторы). Эти заместители смещают электронную плотность от бензольного кольца, особенно в орто- и пара-положениях на себя, создавая частичный отрицательный заряд в мета-положении. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше.

Все ориентанты II рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений ниже, уменьшается в ряду:
толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2
38. Ароматические углеводы.
Ароматические углеводороды представляют собой большую группу веществ, содержащих в своей структуре чаще всего бензольный цикл или систему нескольких бензольных циклов. В рассмотренной ранее схеме последовательного дегидрирования циклогексана до циклегексена, циклогексадиена и циклегексатриена (бензола) первые две стадии эндотермичны, а стадия дегидрирования циклогексадиена с образованием бензола протекает с выделением энергии, что указывает на необычайно высокую энергетическую устойчивость бензола по отношению к другим участникам реакции и обуславливает специфические химические и физические свойства соединения, его так называемый ароматичеcкий характер.

Ароматический ряд объединяет соединения различных классов: углеводороды, галоген-, гидроксил-, карбонилпроизводные, карбоновые кислоты, амины и т.д. Вещества всех этих классов являются производными ароматических углеводородов.
Методы получения
– Ацетилен превращается в бензол при значительном нагревании и воздействии активированного угля как катализатора.

– Наиболее распространённым способом синтеза гомологов бензола является реакция алкилирования бензола галогеналканами, спиртами или олефинами в присутствии катализаторов (например, галогенидов алюминия).
![]()
Алкилированием бензола этиленом и пропиленом получают этилбензол и изопропилбензол.

Дегидрирование этих продуктов даёт стирол и α-метилстирол – ценные мономеры для получения синтетического каучука и полимерных материалов.
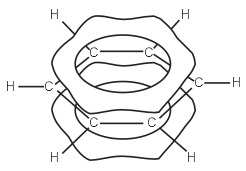
Строение бензольного кольца.
Молекула бензола неполярна. Бензол имеет ось симметрии 6-го порядка. Это означает, что ядра атомов и электроны в нём расположены совершенно симметрично. На основании рентгено- и электронограмм было установлено, что молекула бензола плоская и расстояния между центрами углеродных атомов одинаковы и равны 0,139 нм. Это почти средняя величина между длинами простой (0,154 нм) и двойной (0,134 нм) связей. Весьма интересные сведения дают термодинамические исследования. Например, образование двойной связи из простой С–С-связи, как это было показано в начале лекции, требует затраты энергии. В то же время дегидрирование 1,3-циклогексадиена с образованием бензола идет с выделением тепла. Все эти физические и химические особенности строения и свойств бензола объяснимы с точки зрения современных представлений о строении бензола. Шесть углеродных атомов бензола находятся в состоянии sр2-гибридизации. Оси всех sр2-орбит лежат в одной плоскости под углом 120° друг к другу. Перекрывание электронных sр2-облаков соседних атомов углерода создает σ-связи С–С. Все шесть σ-связей С–С одинаковы, лежат в одной плоскости. Молекула бензола, в которой углы между связями составляют 120°, не напряжена. Оси негибридизованных р-электронов шести атомов углерода перпендикулярны плоскости кольца. При боковом перекрывании р-орбиталей образуется круговая молекулярная электронная орбита, по которой свободно, не связываясь с каким-либо атомом двигаются электроны.
|
|
.При этом достигается почти идеально равномерное распределение электронной плотности в системе сопряжения, которое приводит к энергетической стабилизации молекулы бензола на ~150 кДж∙моль-1 и появлению необычных свойств, совокупность которых объединяется термином «ароматичность». Ароматичность не имеет непосредственного отношения к запаху органических соединений. Термин «ароматичность» был предложен потому, что первые представители этого класса веществ обладали приятным запахом. Наиболее важными признаками ароматичности являются повышенная устойчивость ненасыщенной циклической структуры и большая склонность ароматических соединений к реакциям замещения, сохраняющим стабилизирующую их систему сопряженных связей в цикле, а не к реакциям присоединения, разрушающим эту систему и дестабилизирующим молекулу.
Необходимым условием сопряжения в ароматических системах является параллельность осей всех р-электроных орбиталей. Циклооктатетраен, например, лишён ароматических свойств, поскольку из-за большого углового напряжения при угле 135° между связями (вместо 120°, характерных дляsр2 –гибридизации) он не может сохранить плоской структуры, и оси р-орбиталей не параллельны.


Строение винилбензола
В молекуле винилбензола углеводородный заместитель, представляющий систему с -связью, взаимодействует с -электронным секстетом ароматического кольца посредством, прежде всего, мезомерного эффекта: в данном случае наблюдается неполярное --сопряжение. Вследствие высокой подвижности -электронной плотности молекула винилбензола легко поляризуема и под действием катионов или полярных молекул облака электронов сильно смещаются в сторону поляризующего агента:
![]() Следовательно,
можно изобразить граничные структуры,
полученные при смещении таким образом
электронной плотности от винильного
радикала к бензольному кольцу
Следовательно,
можно изобразить граничные структуры,
полученные при смещении таким образом
электронной плотности от винильного
радикала к бензольному кольцу
 Граничные
структуры, полученные при обратной
поляризации (например, при взаимодействии
винилбензола с отрицательно заряженными
ионами), значительно менее вероятны,
поэтому здесь не приводятся.
Индуктивный
эффект заместителя в этой молекуле
практически не наблюдается, так как
смещение -электронов С–С1-связи,
вызванное различием электроотрицательностей
атомов углерода, почти не происходит —
все углеродные атомы находятся
вsp2-гибридном состоянии.
Поэтому
в целом, так же, как и в случае толуола,
в молекуле винилбензола алкильный
заместитель обладает электронодонорными
свойствами по отношению к бензольному
кольцу. Повышение электронной плотности
происходит главным образом в о- ип-положениях
к заместителю.
Геометрия винилбензола
определяется валентным состоянием
углеродных атомов и наличием --сопряжения.
В связи с этим все атомы данной молекулы
лежат в одной плоскости. Оси
восьми р-орбиталей, входящих в
сопряжённую систему, перпендикулярны
этой плоскости. Все валентные углы
близки к 120:
Граничные
структуры, полученные при обратной
поляризации (например, при взаимодействии
винилбензола с отрицательно заряженными
ионами), значительно менее вероятны,
поэтому здесь не приводятся.
Индуктивный
эффект заместителя в этой молекуле
практически не наблюдается, так как
смещение -электронов С–С1-связи,
вызванное различием электроотрицательностей
атомов углерода, почти не происходит —
все углеродные атомы находятся
вsp2-гибридном состоянии.
Поэтому
в целом, так же, как и в случае толуола,
в молекуле винилбензола алкильный
заместитель обладает электронодонорными
свойствами по отношению к бензольному
кольцу. Повышение электронной плотности
происходит главным образом в о- ип-положениях
к заместителю.
Геометрия винилбензола
определяется валентным состоянием
углеродных атомов и наличием --сопряжения.
В связи с этим все атомы данной молекулы
лежат в одной плоскости. Оси
восьми р-орбиталей, входящих в
сопряжённую систему, перпендикулярны
этой плоскости. Все валентные углы
близки к 120:
 39.
39.



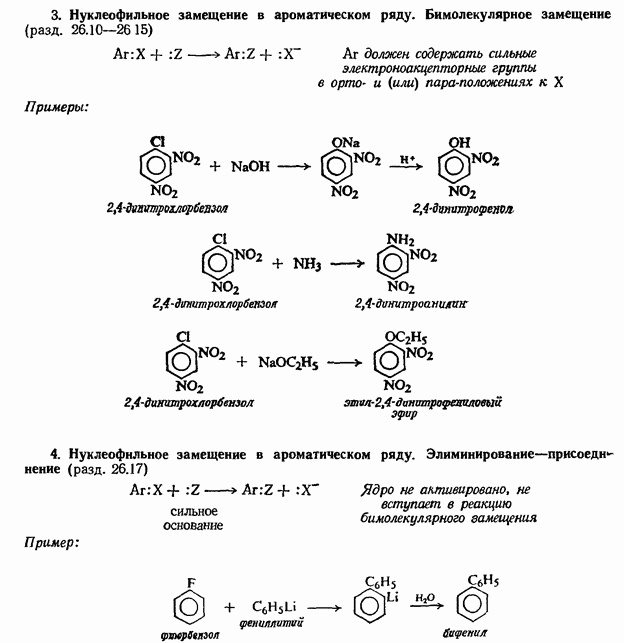
Если галоген находится в боковой цепи бензольного ядра, то он легко вступает в обычные реакции нуклеофильного замещения. Например, хлористый бензил легко гидролизуется водным раствором Na2CO3, реагирует с третичными аминами и так далее.
40. ??