
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
25.Дикарбоновые кислоты
К классу дикарбоновых кислот относятся соединения, содержащие две карбоксильные группы. Дикарбоновые кислоты подразделяют в зависимости от типа углеводородного радикала:
насыщенные;
ненасыщенные;
ароматические.
Номенклатура дикарбоновых кислот аналогична номенклатуре монокарбоновых кислот:
тривиальная;
радикально-функциональная;
систематическая.
Таблица 25 – Номенклатура дикарбоновых кислот
Структурная формула |
Название |
||
тривиальное |
систиматическая |
радикально-функциональная |
|
|
щавелевая кислота |
этандиовая кислота |
– |
|
янтарная кислота |
бутандиовая кислота |
этандикарбоновая-1,2 кислота |
Методы получения дикарбоновых кислот. Дикарбоновые кислоты получают с использованием тех же методов, что и в случае монокарбоновых кислот, за исключением нескольких специальных способов, применимых для отдельных кислот.
Общие способы получения дикарбоновых кислот
Окисление диолов и циклических кетонов:
![]()

Гидролиз нитрилов:
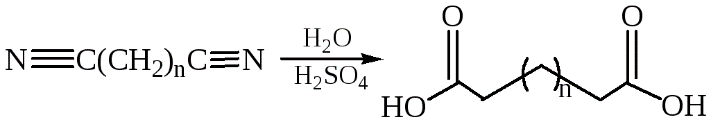
Карбонилирование диолов:
![]()
Получение щавелевой кислоты из формиата натрия сплавлением его в присутствии твердой щелочи:
![]()
Получение малоновой кислоты:
![]()
Получение адипиновой кислоты. В промышленности получается при окислении циклогексанола 50 % азотной кислотой в присутствии медно-ванадиевого катализатора:

Физические свойства дикарбоновых кислот. Дикарбоновые кислоты – твердые вещества. Низшие члены ряда хорошо растворимы в воде и лишь незначительно растворяются в органических растворителях. Растворяясь в воде, образуют межмолекулярные водородные связи. Граница растворимости в воде лежит при С6 – С7. Химические свойства. У двухосновных кислот сохраняются все общие для карбоновых кислот свойства. Дикарбоновые кислоты превращаются в соли и образуют те же производные, что и монокарбоновые (галогенангидриды, ангидриды, амиды, сложные эфиры), но реакции могут идти как по одной (неполные производные), так и по обеим карбоксильным группам. Механизм реакций образования производных тот же, что и у монокарбоновых кислот. Двухосновные кислоты обнаруживают также ряд особенностей, обусловленных влиянием двух СООН-групп.
Кислотные свойства. У дикарбоновых кислот по сравнению с предельными одноосновными кислотами повышены кислотные свойства (средние константы ионизации, таблица 26). Причиной этого является не только дополнительная диссоциация по второй карбоксильной группе, поскольку ионизация второго карбоксила протекает значительно труднее и вклад в кислотные свойства второй константы едва заметен.
Электроноакцепторная группа вызывает увеличение кислотных свойств карбоновых кислот, так как повышение положительного заряда на карбоксильном атоме углерода способствует усилению мезомерного эффекта р,π-сопряжения, усиливает поляризацию связи О–Н и облегчает ее диссоциацию. Этот эффект выражен тем больше, чем ближе друг к другу расположены карбоксильные группы. Токсичность щавелевой кислоты связана, прежде всего, с ее высокой кислотностью, величина которой приближается к таковой у минеральных кислот. Учитывая индуктивный характер влияния, понятно, что в гомологическом ряду дикарбоновых кислот кислотные свойства резко убывают по мере удаления карбоксильных групп друг от друга. Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей – кислые (с одним эквивалентом основания) и средние (с двумя эквивалентами):
![]()
![]()
Реакции нуклеофильного замещения. Дикарбоновые кислоты, подобно монокарбоновым, вступают в реакции нуклеофильного замещения с участием одной или двух функциональных групп и образуют функциональные производные – сложные эфиры, амиды, хлорангидриды.
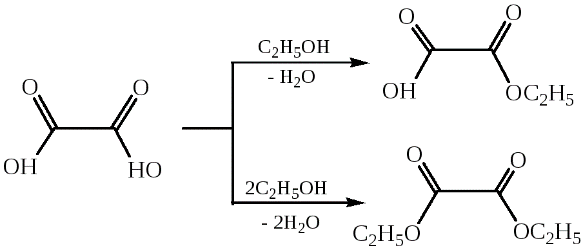
За счет высокой кислотности самой щавелевой кислоты ее сложные эфиры получают без применения кислотных катализаторов.
3. Специфические реакции дикарбоновых кислот. Взаимное расположение карбоксильных групп в дикарбоновых кислотах существенно влияет на их химические свойства. Первые гомологи, в которых СООН-группы сближены, – щавелевая и малоновая кислоты – способны при нагревании отщеплять оксид углерода (IV), в результате чего удаляется карбоксильная группа. Способность к декарбо-ксилированию зависит от строения кислоты. Монокарбоновые кислоты теряют карбоксильную группу труднее, только при нагревании их солей с твердыми щелочами. При введении в молекулы кислот ЭА заместителей склонность их к декарбоксилированию возрастает. В щавелевой и малоновой кислотах вторая карбоксильная группа выступает в качестве такого ЭА и тем самым облегчает декарбоксилирование.
3.1
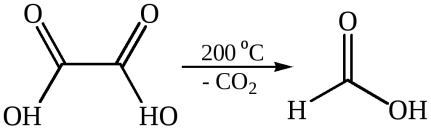
3.2

Декарбоксилирование щавелевой кислоты используется как лабо-раторный метод синтеза муравьиной кислоты. Декарбоксилирование производных малоновой кислоты является важным этапом в синтезе карбоновых кислот. Декарбоксилирование ди- и трикарбоновых кислот характерно для многих биохимических процессов. По мере удлинения углеродной цепи и удаления функциональных групп ослабевает их взаимное влияние. Поэтому следующие два члена гомологического ряда – янтарная и глутаровая кислоты – при нагревании не декарбоксилируются, а теряют молекулу воды и образуют циклические ангидриды. Такой ход реакции обусловлен образованием устойчивого пяти- или шестичленного цикла.
3.3

3.4 Прямой этерификацией кислоты могут быть получены ее полные эфиры, а взаимодействием ангидрида с эквимольным количеством спирта – соответствующие кислые эфиры:
3.4.1

3.4.2

3.5 Получение имидов. Нагреванием аммонийной соли янтарной кислоты получают ее имид (сукцинимид). Механизм этой реакции такой же, как при получении амидов монокарбоновых кислот из их солей:

В сукцинимиде атом водорода в иминогруппе обладает значительной протонной подвижностью, что вызвано электроноакцепторным влиянием двух соседних карбонильных групп. На этом основано получение N-бром-сукцинимида – соединения, широко используемого в качестве бромирую-щего агента для введения брома в аллильное положение:

К непредельным дикарбоновым кислотам относятся функционально замещенные непредельные углеводороды, содержащие две карбоксильные группы. Методы получения
1. Дегидрогалогенирование. Для получения ненасыщенных дикарбоновых кислот чаще всего используют методы введения двойной или тройной связи в молекулу насыщенной дикарбоновой кислоты или введения карбоксильных групп в ненасыщенное соединение:
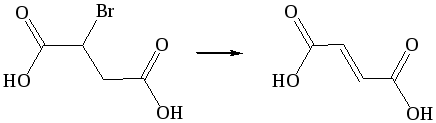
Дегидратация:

Дегалогенирование:
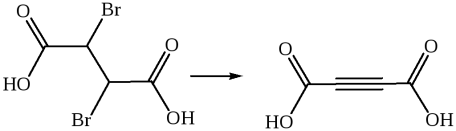
Окисление:

Химические свойства. Ненасыщенные дикарбоновые кислоты являются более сильными кислотами по сравнению с насыщенными, так как взаимное влияние двух карбоксильных групп по системе π-связей переносится сильнее. Следует обратить внимание на значения второй константы ионизации малеиновой и итаконовой кислот.
26. Малоновая кислота и малоновый эфир: строение, свойства и использование для синтезов (синтез Конрода).
Мало́новая кислота́ (пропандиовая, метандикарбоновая кислота) НООССН2СООН — двухосновная предельная карбоновая кислота.
О бладает
всеми химическими свойствами, характерными
для карбоновых
кислот.
бладает
всеми химическими свойствами, характерными
для карбоновых
кислот.
Малоновая кислота хорошо растворима в воде и этаноле, а также в пиридине и диэтиловом эфире. В бензоле малоновая кислота не растворяется.
Малоновая кислота образует два ряда производных по карбоксильным группам (кислых и полных): сложные эфиры, нитрилы, амиды, хлорангидриды.
При нагревании кислоты выше температуры плавления или нагревания её водного раствора выше 70°C малоновая кислота легко декарбоксилируется с образованием уксусной кислоты.
Малоновую (пропан-1,3-диовую) кислоту обычно синтезируют из хлоруксусной: сначала действием цианид-иона ее переводят в циануксусную, затем проводят гидролиз, либо алкоголиз в кислой среде. В первом случае получается собственно малоновая кислота, а во втором – ее диэтиловый эфир.
М алоновый
эфир, или диэтилмалонат способен под
действием оснований давать исключительно
енолят-анион, поэтому его активность
по отношению к электрофилам выше. Сильные
основания, такие как этилат натрия
(магния), металлоорганические соединения
и т.д., нацело депротонируют малоновый
эфир. Полученные таким образом
металлические производные по метиленовой
группе находят широкое применение в
синтезе, т.к. легко алкилируются и
ацилируются а образующиеся при этом
замещенные малоновые эфиры можно
подвергать гидролизу и декарбоксилированию,
получая разнообразные ценные продукты.
алоновый
эфир, или диэтилмалонат способен под
действием оснований давать исключительно
енолят-анион, поэтому его активность
по отношению к электрофилам выше. Сильные
основания, такие как этилат натрия
(магния), металлоорганические соединения
и т.д., нацело депротонируют малоновый
эфир. Полученные таким образом
металлические производные по метиленовой
группе находят широкое применение в
синтезе, т.к. легко алкилируются и
ацилируются а образующиеся при этом
замещенные малоновые эфиры можно
подвергать гидролизу и декарбоксилированию,
получая разнообразные ценные продукты.
Синтез гомологов малоновой кислоты и одноосновных кислот действием иодистых алкилов (синтезы Конрада). При действии иодистых алкилов на натриймалоновый эфир натрий замещается на алкил и получаются моноалкилмалоновые эфиры, например:

Если подействовать еще раз натрием и галоидным алкилом, можно получить диалкилмалоновые эфиры:

Так как гомологи малоновой кислоты при нагревании отщепляют СО2 и превращаются в предельные одноосновные кислоты, то этим способом можно с помощью малонового эфира синтезировать как саму уксусную кислоту, так и большое число ее гомологов, однозамещенных (т.е. жирных кислот нормального строения) и двузамещенных.
