
- •Предмет и задачи органической химиии, ее место в системе медицинского образования.
- •Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
- •Концепция электронных смещений: мезомерный эффект.
- •4. Оптическая изомерия. Хиральность. Абсолютная (r/s) и относительная (d/l) конфигурация. Способы разделения рацематов. Стереохимия реакций нуклеофильного замещения и нуклеофильного присоединения.
- •I. Алканы (предельные углеводороды, парафины)
- •Реакции синтеза алканов.
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •3) Аммонолиз галогеналканов — это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей):
- •2. Галогеналканы могут быть получены из спиртов и других галогеналканов с помощью реакции замещения, например:
- •4. Галогеналканы могут быть получены из альдегидов, кетонов и карбоновых кислот действием pCl5, pBr3 или sf4 при нагревании.
- •1) Образование металлоорганического производного (если использется металл, а не заранее приготовленное металлоорганическое соединение):
- •2) Взаимодействие образовавшегося, в данном случае, натрийорганического соединения с другой молекулой алкилгалогенида:
- •Особенности строения, изомерия, физических свойств, химического поведения многоатомных спиртов. Механизмы реакций.
- •2.Получение простых эфиров
- •III. Свойства простых эфиров
- •1. Кислотное расщепление простых эфиров
- •2. Радикальные реакции простых эфиров
- •12. Нитро- и нитрозосоединения: строение, получения, кислотно-основные свойства. Свойства соединений, имеющих α-водородные атомы. Нитроловые кислоты и псевдонитролы.
- •Получение нитросоединений
- •Псевдонитролы
- •13. Тиоспирты и тоиэфиры. Особенности строения, химических свойств. Реакции окисления. Способы получения.
- •2 . Эффект сопряжения
- •4.3.3. Строение и свойства сопряжённых диенов
- •Строение тройной связи
- •Номенклатура алкинов
- •2 Атома с → этан → этин;
- •3 Атома с →пропан → пропин и т.Д.
- •Присоединение галогенов (Cl2 и Br2)
- •2. Присоединение галогеноводородов к алкинам.
- •3. Реакция гидратации (Реакция Кучерова)
- •4. Присоединение hcn.
- •5. Присоединение спиртов.
- •Галогеналканы
- •. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •18. Особенности химического поведения непредельных спиртов
- •20.Непредельные альдегиды и кетоны: кетен, акролеин, кротоновый альдегид - особенности их свойств и способов получения
- •23. Производные карбоновых кислот.
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •25.Дикарбоновые кислоты
- •27. Гидроксикислоты: классификация, номенклатура, оптическая изомерия. Химические свойства. Отношение к нагреванию. Способы получения. Способы разделения рацематов. Нахождение в природе.
- •2.1. Получение α-гидроксикислот
- •2.2. Получение β-гидроксикислот
- •2.3. Получение γ-гидроксикислот
- •28. Оксокислоты: номенклатура, изомерия, способы получения и химические свойства.
- •29. Ацетоуксусная кислота и ацетоуксусный эфир: строение, свойства, получение и использование для синтезов.
- •Присоединение этилового спирта к дикетену
- •Сложноэфирная конденсация Кляйзена
- •30. Аминокислоты: номенклатура, изомерия. Способы получения. Химические свойства. Отношение к нагреванию. Лактим-лактамная таутомерия.
- •1. Из карбоновых кислот через их галогенопроизводные в радикале
- •2. Гидролиз пептидов и белков
- •4. Микробиологический синтез
- •Отношение к нагреванию.
- •Лактим-лактамная таутомерия.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •34. Алициклические углеводороды: номенклатура, строение, свойства. Особенности поведения малых циклов. Терпены, терпеноиды, каротиноиды.
- •35. Бензол, его строение и свойства. Ароматичность. Реакции присоединения, окисления, замещения в сравнении с предельными и непредельными углеводородами. Методы синтеза бензольного кольца.
- •37.Монозамещенные бензола
- •38. Ароматические углеводы.
- •41.Реакции нуклеофильного замещения в ароматическом кольце.
- •42. Ароматические сульфокислоты.
- •Применение
- •43. Ароматические нитросоединения
- •Свойства: Химические свойства
- •Реакции нуклеофильного замещения
- •44.Фенолы и спирты.
- •Классификация
- •Электронное строение[
- •Физические свойства
- •В живых организмах
- •Химические свойства[
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца]
- •Способы получения[
- •Применение фенолов[
- •Классификация спиртов[
- •Номенклатура спиртов[ Систематическая номенклатура[
- •Другие номенклатуры[
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •Строение и физические свойства[
- •Методы синтеза[
- •Химические свойства[
- •Применение[
- •45. Ароматические амины
- •Номенклатура ароматических аминов
- •Изомерия ароматических аминов
- •Способы получения ароматических аминов Способы получения первичных аминов
- •4. Реакция Гофмана
- •Способы получения вторичных аминов
- •Способы получения третичных аминов
- •Физические свойства ароматических аминов
- •Химические свойства ароматических аминов
- •1. Кислотно-основные свойства аминов
- •1) Основные свойства аминов
- •2. Реакции аминов как нуклеофильных реагентов
- •1. Алкилирование ароматических аминов
- •2. Ацилирование ароматических аминов
- •3. Реакции с альдегидами и кетонами
- •Окисление ароматических аминов
- •3. Реакции электрофильного замещения в бензольном кольце
- •1. Реакция галогенирования
- •2. Реакция сульфирования
- •Реакционная способность[
- •Номенклатура
- •Свойства[
- •Реакционная способность
- •Синтез[
- •Азокрасители[
- •Получение солей диазония
- •Химические свойства
- •1. Замещение на гидроксигруппу
- •2. Замещение на галоген
- •3. Замещение на cn
- •Понятие об азокрасителях
Предмет и задачи органической химиии, ее место в системе медицинского образования.
Название "органическая химия" происходит от двух слов, "органический" -живой, имеющий отношение к живому миру, "химия"- возможно имеет древнеегипетские корни и переводится на русский языык примерно как "чёрная земля". Органическая химия, наука, изучающая соединения углерода с другими элементами (органические соединения), а также законы их превращений. Название "органическая химия" возникло на ранней стадии развития науки, когда предмет изучения ограничивался соединениями углерода растительного и животного происхождения. Не все соединения углерода классифицируются как органические. Например, СО2, HCN, CS2 традиционно относят к неорганическим. Условно можно считать, что прототипом органических соединений является метан СН4. К настоящему времени число известных органических соединений превышает 10 млн. и увеличивается каждый год на 250-300 тыс. Многообразие органических соединений определяется уникальной способностью атомов углерода соединяться друг с другом простыми и кратными связями, образовывать соединения с практически неограниченным числом атомов, связанных в цепи, циклы, бициклы, трициклы, полициклы, каркасы и др., образовывать прочные связи почти со всеми элементами периодической системы, а также явлением изомерии - существованием разных по свойствам веществ, обладающих одним и тем же составом и молекулярной массой. Многообразие и громадное число органических соединений определяет значение органической химии как крупнейшего раздела современной химии. Окружающий нас мир построен главным образом из органических соединений; пища, топливо. одежда, лекарства, краски, моющие средства, взрывчатые вещества, материалы, без которых невозможно создание транспорта, книгопечатания, проникновение в космос и прочее, - все это состоит из органических соединений. Важнейшую роль органические соединения играют в процессах жизнедеятельности. На стыке органической химия с неорганической химией и биохимией возникли химия металлоорганических соединений и биоорганическая химия соответственно, широко использующие методы и представления органической химии. Отдельный раздел органической химии составляет химия высокомолекулярных соединений: по величине молекул органические вещества делятся на низкомолекулярные (с молекулярной массой от нескольких десятков до нескольких сотен, редко до тысячи) и высокомолекулярные (макромолекулярные; с молекулярной массой порядка 104-106 и более).
Концепция гибридизации атомных орбиталей: три валентных состояния атома угерода; строгая и нестрогая гибридизация. Концепция электронных смещений: индуктивный эффект.
Известно, что в большинстве органических соединений атом углерода четырёхвалентен. Однако электронная конфигурация его внешнего электронного слоя — 2s22p2, и образование четырёх ковалентных связей возможно при переходе атома углерода в возбуждённое состояние. При этом происходит «распаривание» электронов на s-подуровне, и один из них переходит на близкую по энергии р-орбиталь:
С 2s22p2 + 400 кДж/моль ® С* 2s12p3
Четыре неспаренных электрона внешнего электронного слоя заселяют разные по энергии орбитали: один электрон находится на s- и три электрона — на р-орбиталях.
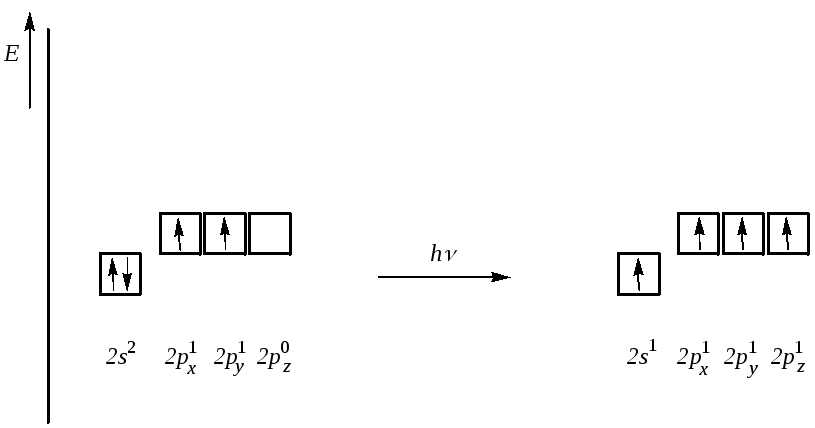
Из свойств соединений углерода известно, что если в молекуле атом углерода образует четыре ковалентные связи с четырьмя одинаковыми заместителями, то такие связи между собой абсолютно одинаковы. Например, в метане СН4 все четыре связи равноценны.
В 1931 году Л. Полинг* выдвинул гипотезу, согласно которой атомные орбитали углерода в возбуждённом состоянии как бы смешиваются, выравниваются по форме и энергии, то есть усредняются — гибридизуются.
Из одной s- и трёх р-орбиталей образуется четыре равноценных гибридных орбитали. Из четырёх разных орбиталей образуется четыре одинаковых по энергии и по форме атомных орбитали, при этом тип гибридизации здесь sp3, так как в гибридизации участие принимают одна s- и три р-орбитали. Для гибридизации, как и для возбуждения атома углерода, требуются затраты энергии.
одна s + три р ® четыре sp3
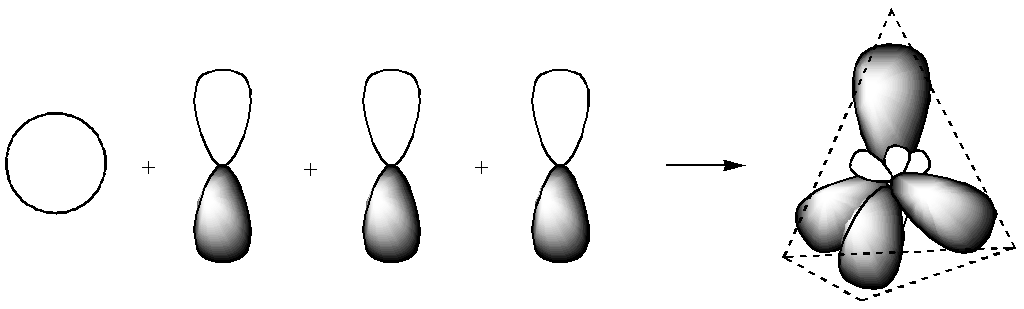
Это первое валентное состояние углерода.
Геометрическая форма sp3-гибридных орбиталей — вытянутые объёмные «восьмёрки», расположение в пространстве — на максимальном удалении друг от друга, то есть оси этих орбиталей должны быть направлены к вершинам правильного тетраэдра, и валентный угол (угол между осями орбиталей) соответствует такому пространственному их расположению и составляет 109°28¢.
Этим можно объяснить способность атома углерода образовывать четыре равноценные ковалентные связи с четырьмя другими одинаковыми атомами (как, например, с атомами водорода в молекуле метана).
При смешении, гибридизации трёх орбиталей: одной s- и двух р-орбиталей образуются три равноценные гибридные орбитали sp2-типа:
одна s + две р ® три sp2.
Геометрическая форма и расположение в пространстве sp2-гибридных орбиталей — объёмные «восьмёрки». Эти орбитали — менее вытянутые, чем орбитали sp3-типа, так как доля p-орбиталей в гибридной орбитали здесь меньше, и sp2-гибридная орбиталь менее похожа на p-орбиталь, чем орбиталь sp3-типа. Оси их лежат в одной плоскости и направлены под углом 120° друг к другу.
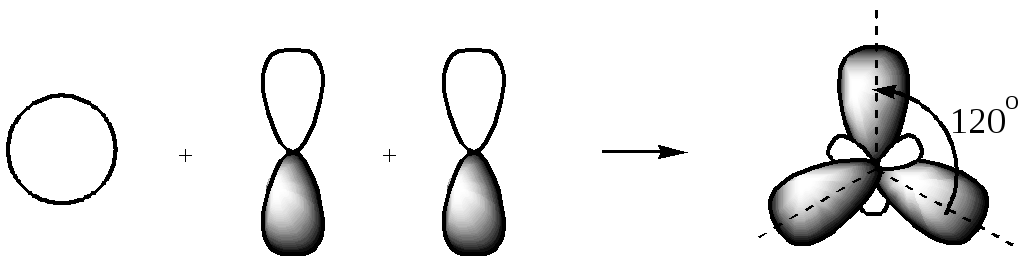
Это второе валентное состояние углерода.
В том случае, когда гибридизации подвергаются одна s- и одна р-орбиталь, образуются две sp-гибридные орбитали:
одна s + одна р ® две sp ,
оси которых находятся под углом 180°, то есть лежат на одной прямой. Это ещё менее вытянутые орбитали, чем sp2-гибридные.
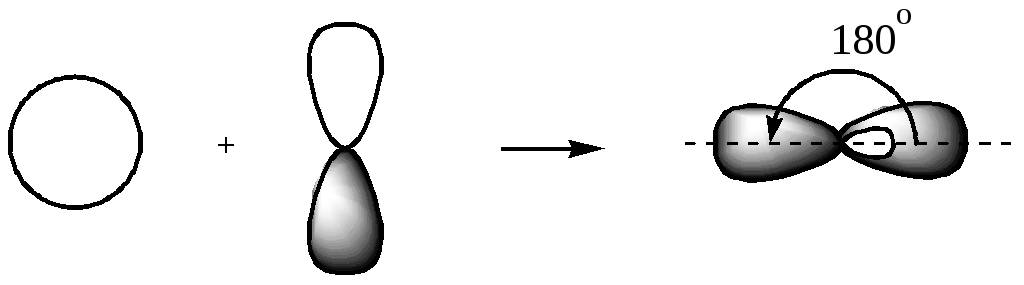
Это третье валентное состояние углерода.
Характеристика валентного состояния углерода и образуемых им связей приведена в табл. 1.1.
Таблица 1.1
Характеристика углерод-углеродных связей в молекулах этана, этилена и ацетилена
Соединение |
Гибридизация |
Вклад s-орбитали, % |
Относ. электроотр. атома С |
Характеристика связи |
|||
Связь |
Длина,нм |
Энергия,кДж/моль |
Энергия на одну связь,кДж/моль |
||||
СН3–СН3 |
sp3 |
25.0 |
2.50 |
С–С |
0.154 |
348 |
348 |
СН2=СН2 |
sp2 |
33.3 |
2.76 |
С=С |
0.134 |
607 |
304 |
СНºСН |
sp |
50.0 |
3.20 |
СºС |
0.120 |
829 |
276 |
Но данные типы гибридизации характерны
лишь для небольшого числа соединений.
Для соединений с неодинаковыми
заместителями у атома углерода имеются
отклонения от классической схемы. В
пропанеСН3-СН2-СН3,
например, из-за того, что центральный
атом углерода образует две С–С-
и две С–Н-связи, орбитали,
участвующие в образовании этих связей,
будут по-разному отталкиваться и
валентные углы искажаются: ÐНСН = 107°;
ÐССС = 112°. В данном случае говорится
о нестрогой гибридизации.
данные типы гибридизации характерны
лишь для небольшого числа соединений.
Для соединений с неодинаковыми
заместителями у атома углерода имеются
отклонения от классической схемы. В
пропанеСН3-СН2-СН3,
например, из-за того, что центральный
атом углерода образует две С–С-
и две С–Н-связи, орбитали,
участвующие в образовании этих связей,
будут по-разному отталкиваться и
валентные углы искажаются: ÐНСН = 107°;
ÐССС = 112°. В данном случае говорится
о нестрогой гибридизации.
По Полингу, степень гибридизации атомных орбиталей связана с валентным углом уравнением:
1 + liljcosqij = 0 или 1 + l2cosq = 0 ,
где li(j) — коэффициент смешения орбиталей, а l2 — степень гибридизации (здесь количество р-орбиталей, принимающих участие в гибридизации с одной s-орбиталью); qij — валентный угол (угол между i-ной и j-ной атомными орбиталями). Например,
для sp-гибридных орбиталей l2 = 1, cos q = –1, q = 180°; для sp2-гибридных — l2 = 2, cos q = –1/2, q = 120°; для sp3-гибридных — l2 = 3, cos q = –1/3, q = 109.47° (или 109°28¢).
Но в общем случае степень гибридизации может быть и дробной, так как валентные углы между разными связями в различных соединениях могут сильно отличаться от приведенных выше. В этих случаях необходимо помнить, что степень гибридизации — это лишь формальное число р-орбиталей, приходящихся в гибридизации на одну s-орбиталь.
Индуктивный эффект имеет электростатическую природу. Он передается по линии связи и ведет к появлению дробных электрических зарядов на атомах. Заряды обозначаются символами δ+ и δ-. Степень смещения электронной плотности зависит от разности электроотрицательности соответствующих атомов. Знак индуктивного эффекта определяется относительно атома или группы атомов, принятого за эталон. В качественных оценках его часто определяют относительно атома водорода. При количественном рассмотрении за стандарт принята группа СН3-. Индуктивный эффект изображают стрелкой вдоль σ-связи. Стрелка указывает направление смещения электронной плотности.
Индуктивный эффект передается по цепи σ-связей с затуханием. Наиболее подвержен действию индуктивного эффекта α-углеродный атом.
Заместители, притягивающие электроны, характеризуют отрицательным индуктивным эффектом. Их называют электроноакцепторными заместителями. Примерами электроноакцепторных заместителей, обладающих отрицательным индуктивным эффектом (-I-эффект). являются: F-; Cl-; Br-; -OH; -ОR; -COOH; -CHO; -COOR; -CN; -NO2; -NH2; СН2=СН-; С6Н5-; СНºС- В состав данных функциональных групп входят атомы с электроотрицательность более высокой, чем электроотрицательность атома углерода в метильном радикале.

Заместители, отталкивающие электроны от себя проявляют положительный индуктивный эффект (+I-эффект). Такие заместители называются электронодонорными. Положительный индуктивный эффект также определяется относительно метильной группы. Положительным индуктивным эффектом обладают атомы металлов, а также разветвленные алкильные группы:
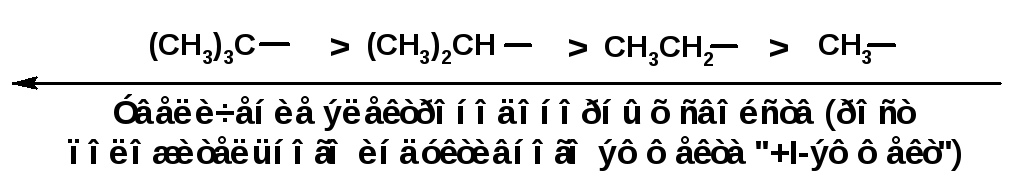
Заместители, в которых находится атом углерода в состояниях sp2-гибридизации и sp-гибридизации являются электроакцепторами по сравнению с атомом углерода в состоянии sp3-гибридизации и, соответственно, обладают отрицательным индуктивным эффектом.
Атомы с целым отрицательным зарядом обладают положительным индуктивным эффектом:
![]()
Атомы с целым положительным зарядом обладают отрицательным индуктивным эффектом.
