
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf
том, что согласно первому уравнению (100.3) сжимаемость вещества в критической точке бесконечно велика:
(102.1)
Поэтому в критической точке и в ее окрестности вещество внизу ампулы должно заметно уплотняться под действием собственного веса, а вверху становиться менее плотным. На такой «гравитационный эффект» обратил внимание бельгийский физик Гуи еще в 1892 г. Однако экспериментальное обнаружение эффекта сделано сравнительно недавно. Для того чтобы получить представление о величине эффекта, мы приводим в табл. 11 распределение по высоте плотности гептана (С7 Н16 ), измеренное А. 3. Голиком и Е. Т. Шиманской в Киевском университете .
Таблица 11
В таблице tm означает температуру исчезновения мениска, которая принимается равной критической. Критическая плотность для гептана равна 0,2355 г/см3 , критическая температура 266,8 °С, критическое давление 26,8 атм. Из таблицы видно, что при изменении высоты всего на 6,6 см плотность гептана при критической температуре изменяется на 37%, а при температуре градусом выше — на 22 %, если критическую плотность принять за 100%. Для сравнения вычислим по барометрической формуле относительное изменение плотности воздуха с той же высотой h = 6,6 см при температуре Т = 273 К. Оно равно
т. е. примерно в пятьдесят тысяч раз меньше, чем для гептана в окрестности критической точки. При интерпретации многих опытных данных гравитационный эффект не принимался во внимание, что иногда приводило к ошибочным выводам. Теперь становится ясным, что в описанных выше опытах вовсе не обязательно наполнять ампулу строго определенным количеством жидкости. Благодаря сильному изменению плотности вещества с высотой при критической температуре в ампуле может находиться в критическом состоянии (т. е. иметь еще и критическую плотность) только бесконечно тонкий слой вещества. В этом слое и происходит исчезновение мениска. Таким образом, получается совсем не жесткое требование, которое следует предъявлять к количеству налитой жидкости. Для применимости метода исчезновения мениска требуется только, чтобы упомянутый выше бесконечно тонкий слой вещества не выходил за пределы ампулы.
5. Метод исчезновения мениска удобен для точных измерений критической температуры. Определив критическую температуру, можно затем сравнительно просто измерить критическое давление. Для этого можно, например, подвергать вещество изотермическому сжатию и наблюдать, когда на критической изотерме появится точка перегиба. Наибольшие трудности представляет измерение критической плотности,

поскольку в критической точке сжимаемость вещества бесконечна. Критическую плотность молено измерить на той же установке, какая применяется в методе исчезновения мениска. Для этого надо взять много ампул и налить в них жидкости либо «слишком много», либо «слишком мало», чтобы при нагревании мениск достигал вершины или дна ампулы. В моменты, когда это происходит, ампула будет целиком заполнена либо только жидкостью, либо только насыщенным паром. Разделив в эти моменты массу вещества на объем ампулы, найдем плотность жидкости ρж и насыщенного пара ρп при соответствующей температуре. Построим теперь кривые зависимости плотности от температуры для насыщенного пара (нижняя кривая на рис. 103) и жидкости, находящейся с ним в равновесии (верхняя кривая на рис. 103). Кроме того, построим кривую А K для средней арифметической плотности жидкости и пара, т.е. для величины (1/2) (ρж + ρп ). Опыт показывает, что на самом деле она с большой точностью является прямой. Точка пересечения этой прямой с вертикальной изотермой Т = Т k и будет критической точкой.
Рис. 103
6. А. И. Надеждин (1858–1886), один из учеников профессора М. А. Авенариуса (1835–1895), применял для определения критической температуры несколько иной метод. Он изобрел прибор, названный им дифференциальным денсиметром . Устройство прибора понятно из рис. 104.

Рис. 104
Пустая трубка АА устанавливалась в горизонтальном положении с помощью грузика F . Если трубку частично заполнить жидкостью, то жидкость собирается в одном из ее концов, и равновесие нарушается. Однако при нагревании до критической температуры, когда плотности жидкости и пара выравниваются, равновесие восстанавливается вновь. Этот остроумный метод обладает тем достоинством, что он применим и для непрозрачных веществ (бром, йод), когда мениск невидим, а также в тех случаях, когда вещество разъедает стекло (вода при высоких температурах). Однако он менее точен, чем метод исчезновения мениска, и из-за гравитационного эффекта всегда дает завышенное значение критической температуры.
7. Отметим в заключение еще некоторые свойства вещества в критической точке и ее окрестности. Из формулы
(102.2)
следует, что разность теплоемкостей С P – С V в критической точке обращается в бесконечность. Действительно, изотермическая сжимаемость в этой точке бесконечно велика, а производная (дР /дТ )V никаких особенностей не имеет. Поэтому должна обращаться в бесконечность и теплоемкость С P , так как для устойчивости вещества необходимо, чтобы С V была больше нуля. Такой результат представляется совершенно естественным, если принять во внимание, что в двухфазном состоянии вещества теплоемкость С P бесконечно велика . Она остается таковой и в пределе, когда двухфазное состояние переходит в критическое. Что касается теплоемкости С V , то теоретические соображения, на которых мы останавливаться не можем, тоже приводят к заключению, что в критической точке С V = ∞. Этот вывод, по-видимому, подтверждается опытом.
Более интересной особенностью вещества в критическом состоянии является
медленность установления равновесного состояния . Например, для гептана равновесное распределение плотности вещества в поле тяжести при сохранении температуры строго постоянной устанавливается в течение не менее суток. Если после установления равновесия температура изменится хотя бы на сотые доли градуса, то также требуется время не менее суток, чтобы установилось новое равновесное состояние. С этим связано явление гистерезиса плотности . Оно состоит в следующем. Если плотность вещества в ампуле измерять в одной и той же точке, постепенно повышая температуру, а затем постепенно понижая ее, то при одной и той же температуре получатся разные значения плотности в зависимости от того, как достигнута эта температура — при нагревании или при охлаждении. Гистерезис плотности (для гептана) исчезает при температуре на 10–15 °С выше критической.
Внутренняя энергия газа Ван-дер-Ваальса
1. Если известно уравнение состояния физически однородного вещества, то с помощью общих методов термодинамически можно найти внутреннюю энергию его как функцию объема V при постоянной температуре. Для этого надо воспользоваться уравнением

Применим этот метод к газу Ван-дер-Ваальса, предполагая, что газ взят в количестве одного моля. Перепишем еще раз это уравнение:
(103.1)
Из уравнения Ван-дер-Ваальса находим
Таким образом,
(103.2)
Интегрирование вдоль изотермы дает
(103.3)
где f (T ) — «постоянная интегрирования», которая может зависеть от температуры Т . Ее можно выразить через теплоемкость газа С V .
(103.4)
Отсюда следует, что теплоемкость С V газа Ван-дер-Ваальса может зависеть только от температуры Т . Поэтому из последнего соотношения получаем
f (T ) = ∫С V (T )dT ,
и, следовательно,
(103.5)
Если можно пренебречь зависимостью теплоемкости от температуры, то эта формула переходит в более простую:
(103.6)
При выводе предполагалось, что вещество является физически однородным. Поэтому полученные результаты справедливы только для однофазных состояний вещества. Для двухфазных состояний они несправедливы. В частности, если изотерма, вдоль которой производилось интегрирование при получении формулы (103.3), пересекает двухфазную область, то интегрирование надо производить не по реальной, а по

теоретической изотерме, содержащей поднимающийся участок, соответствующий абсолютно неустойчивым состояниям вещества.
2. Формулу (103.5) можно получить также из простых молекулярно-кинетических соображений. Внутренняя энергия газа складывается из кинетической энергии теплового движения его молекул и потенциальной энергии их взаимодействия. Ввиду теоремы о равномерном распределении кинетической энергии по степеням свободы кинетическая энергия теплового движения однозначно определяется температурой газа и не зависит от его объема. Если температура поддерживается постоянной, то остается постоянной и кинетическая энергия. Если пользоваться моделью идеально твердых шаров, то силам отталкивания (развивающимся при столкновениях шаров) не будет соответствовать, никакая потенциальная энергия. Вся потенциальная энергия обусловлена только силами притяжения между молекулами. Ее можно вычислить макроскопически, так как силы притяжения между молекулами сводятся к молекулярному давлению Pi = a /V 2 , с которым поверхностный слой газа давит на остальную массу газа. Работа, которую надо затратить против этого внутреннего давления, и дает приращение потенциальной энергии при изотермическом расширении газа. При расширении от объема V 1 до объема V это приращение равно
Прибавив его к кинетической энергии теплового движения f (T ) снова придем к формуле
(103.3).
Цит. по: Общий курс физики. Учеб. пособие для вузов. В 5 т. Т. II. Термодинамика и молекулярная физика / Сивухин Д.В. / — 5-е изд., исправ. — М.: ФИЗМАТЛИТ;
Изд-во МФТИ, 2005. — С. 369–374, 377–380, 381–386, 387–392, 393–395.
Жидкость. Особенности строения жидкости и твердого тела
Газ, жидкость и твердое тело представляют собой разновидности агрегатного состояния вещества. Конкретное же состояние определяется его давлением и температурой. Считается, что жидкость по физическим свойствам ближе к твердым телам и имеет существенные различия с газом.
Для газообразного состояния в противоположность твердому и жидкому характерна способность всегда занимать весь имеющийся объем. У газообразной фазы собственных границ не существует. Объем массы газа ограничивается лишь стенками сосуда. Поэтому термодинамические функции газа не содержат параметров, связанных с поверхностными эффектами. Иными словами, свойства газообразной фазы определяются только объемными характеристиками. Молекулы газа, особенно идеального, мало связаны между собой межмолекулярными силами. И именно поэтому средняя кинетическая энергия теплового движения молекул газа значительно больше средней потенциальной энергии и к >> и п . По этой причине диффузия в газах протекает достаточно быстро. Этому способствует быстрый и значительный свободный пробег молекул. Газ в противоположность капельной жидкости способен к многократному изменению объема под действием давления. Если не принимать во внимание текучесть, объединяющую капельную и упругую жидкости, то по физическим свойствам и структуре жидкость ближе к твердому телу, особенно при температуре близкой к температуре кристаллизации.
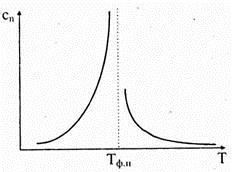
Подтверждением этому могут служить следующие факты. Плотность жидкости всего лишь на 10% отличается от плотности ее твердой фазы. В то время как при парообразовании или испарении жидкости объем среды возрастает в десятки раз. Теплоемкости вещества в твердом и жидком состояниях близки по значению, а при фазовом превращении «жидкость-пар» теплоемкость претерпевает λl -переход (рис. 7.5), Т ф.п. — температура фазового перехода.
Рис. 7.5
Структуры жидкости и твердого тела принципиально одинаковы. Жидкость, считают, обнаруживает хрупкость и прочность на разрыв. В то же время жидкость характеризуется рядом свойств, отличающих ее как от твердого тела, так и от газа. Например, резкое отличие жидкости от газа состоит в том, что вязкость жидкости понижается с ростом температуры, а вязкость газа — повышается.
У жидкости и у твердого тела всегда есть поверхность раздела, и при описании их физических свойств следует принимать во внимание энергию поверхности раздела и капиллярные силы. Силы сцепления в них между атомами, ионами, молекулами становятся основными и удерживают их на определенных расстояниях друг от друга, а соотношение между потенциальной и кинетической энергиями становится противоположным — и п > и к .
Промежуточное между кристаллическим и газообразным состояниями положение жидкости проявляется, во-первых, в определенной степени из-за упорядочения расположения структурных частиц жидкости и, во-вторых, в особенностях их теплового движения.
Если в кристаллах наблюдается ближний и дальний порядок в расположении микрочастиц, а в газах, наоборот, полная неупорядоченность, то в жидкостях имеет место ближний порядок, характеризуемый наличием предпочтительных расстояний между молекулами. Тепловое движение в кристаллах представляет колебание составляющих кристалл частиц относительно узлов кристаллической решетки с возможными диффузионными скачками частиц; в газах — трансляционное движение молекул в промежутках между столкновениями; в жидкостях — колебания структурных частиц вблизи временных положений равновесия, подобные толкучке, наряду со скачкообразными трансляционными движениями молекул. Промежуточное положение жидкости проявляется и в квазикристаллической структуре ее при температурах, близких к температуре плавления. Так, в воде обнаруживается тетраэдрическая координация молекул, образуемая в результате «размывания» колеблющимися молекулами кристаллической структуры льда. Оторвавшиеся молекулы заполняют пустоты квазикристаллической структуры, что делает воду более тяжѐлой по сравнению со льдом.
Таким образом, существенное различие между газом, жидким и твердым телами обусловлено в основном различием в характере теплового движения микрочастиц в них. Физическую сторону этого проиллюстрируем с помощью известной уже потенциальной кривой взаимодействия молекул (рис. 7.6). При этом для удобства анализа значений средней кинетической энергии <и k > теплового движения молекул рассмотрим их относительно минимальной энергии, то есть глубины потенциальной ямы | и |. Если кинетическая энергия теплового движения микрочастиц в абсолютном выражении существенно меньше потенциальной энергии взаимодействия частиц, измеряемой глубиной потенциальной ямы, то есть |<u >| < | u |, то микрочастицы совершают колебания, оставаясь в нижней части потенциальной ямы, не выходя за верхний предел <u к.т. >, что соответствует твердому состоянию вещества.
Если же средняя кинетическая энергия теплового движения молекул незначительно
меньше глубины потенциальной ямы, то есть |<u >| < | и |, то колебание молекул является более энергичным, чем в предыдущем случае. Но молекулы по-прежнему остаются в энергетическом аспекте в пределах потенциальной ямы, а случай этот соответствует жидкому состоянию вещества. И наконец, если энергия теплового движения молекул значительно превышает потенциальную энергию взаимодействия между ними, то есть |<u >| > | u |то молекулы вырвутся из потенциальной ямы, утратят в какой-то степени, а возможно, и полностью взаимосвязь между собой и станут двигаться свободно. Подобное соотношение между указанными составляющими энергии свойственно газообразному состоянию вещества.
Подводя итоги изложенному, отметим, что у молекул газа средняя кинетическая энергия теплового движения по абсолютной величине больше глубины потенциальной ямы, а у молекул жидкости и твердых тел — меньше. Это значит, что твердое состояние возникает тогда, когда потенциальная энергия связи молекул значительно больше кинетической энергии их теплового движения. В результате чего возникает упорядоченная кристаллическая структура, коренным образом отличающаяся от структуры газа. Можно считать, что в газе практически отсутствуют стационарные устойчивые связи между молекулами. Расстояние между молекулами газа больше, и они быстро меняют свое положение. В жидкостях расстояние между молекулами мало, они плотно заполняют пространство, занимаемое жидкостью, и сравнительно медленно меняют взаимное положение. В течение продолжительных промежутков времени группы молекул образуют достаточно устойчивые ассоциации, напоминающие по своим свойствам твердое тело. В целом же жидкости по своей структуре и характеру сил межмолекулярного взаимодействия проявляют как свойства газа, так и свойства твердых тел — о чем упоминалось ранее. В связи с этим теория жидкостей является наиболее трудной и наименее разработанной.
Поверхностное натяжение
Каждая из молекул жидкости взаимодействует с окружающими молекулами. И, как известно, силы взаимодействия между соседними молекулами убывают с увеличением расстояния между ними и при расстоянии 10–9 м силы притяжения между ними становятся равными нулю. Это расстояние называют радиусом молекулярного действия, а соответствующую этому радиусу сферу — сферой молекулярного действия. Силы, действующие на молекулу, находящуюся внутри жидкости, направлены по всем направлениям сферического пространства и в среднем скомпенсированы. Иными словами, результирующая сила, действующая на молекулу со стороны других молекул, расположенных в сфере молекулярного действия, равна нулю.
На периферийные же молекулы, расположенные в поверхностном слое жидкости, действуют нескомпенсированные, направленные внутрь объема, силы притяжения со стороны остальной части жидкости. Это обусловлено тем, что сфера молекулярного действия лишь частично, а для верхнего молекулярного уровня - наполовину, расположена внутри жидкости. Поскольку концентрация молекул в расположенном над жидкостью газе меньше их концентрации в жидкости, то равнодействующая сил, приложенных к каждой молекуле поверхностного слоя, не равна нулю, и направлена внутрь жидкости. И поэтому результирующие силы всех молекул поверхностного слоя оказывают на жидкость давление, называемое внутренним или молекулярным. Достигает оно десятков тысяч атмосфер. На тело, помещенное в жидкость, внутреннее давление не действует, так как обусловлено оно силами, действующими только между молекулами жидкости.
Энергия молекул жидкости складывается из кинетической энергии их теплового движения и потенциальной энергии молекулярного взаимодействия. При перемещении молекулы из глубины жидкости в поверхностный слой увеличивается ее потенциальная энергия положения относительно нулевой отметки. При этом уменьшается кинетическая энергия молекулы. Следовательно, большей потенциальной энергией обладают поверхностные молекулы, а глубинные — большей кинетической энергией. С энергией молекул поверхностного слоя жидкости связано понятие поверхностного натяжения ζ = U /S , Дж/м2 , где U — энергия молекул поверхностного слоя жидкости. По физическому содержанию поверхностное натяжение представляет собой плотность поверхностной энергии. Так как Дж/м2 = Н/м, то можно утверждать, что поверхностное натяжение равно силе поверхностного натяжения, приходящейся на единицу длины контура, ограничивающего поверхность жидкости. Поверхностное натяжение для большинства жидкостей при T = 300 К равно интервалу значений 10–2 –10–1 Н/м. С повышением температуры увеличивается среднее расстояние между молекулами и, следовательно, поверхностное натяжение уменьшается. На величину поверхностного натяжения жидкости существенное влияние оказывают примеси. Примеси, ослабляющие поверхностное натяжение жидкости, называют поверхностно-активными. По отношению к воде таковыми являются мыло, стиральные пасты и порошки, спирты, эфиры, нефть и др.
Примеси: сахар и соль, увеличивают поверхностное натяжение некоторых жидкостей, так как молекулы добавляемых веществ взаимодействуют с молекулами жидкости сильнее, чем молекулы жидкости между собой.
Следует ожидать, и ожидание подтверждает опыт, что жидкость стремится принимать объемную форму с минимальной поверхностью. В условиях невесомости капля любой жидкости и размеров имеет сферическую форму. Это доказано экспериментами на космических кораблях.
Смачивание и капиллярные явления
Смачивание обусловлено характером взаимодействия поверхностных молекул соприкасающихся сред. Для смачивающей жидкости силы притяжения между молекулами жидкости оказываются меньше сил притяжения между молекулами самой жидкости и твердого тела. Для несмачивающей жидкости имеет место обратное соотношение сил. Под действием преобладающих сил притяжения между молекулами жидкости происходит сокращение поверхности соприкосновения с твердым телом — выпуклый профиль поверхности жидкости. Поверхность жидкости, искривленную у стенки сосуда, называют мениском, а линию, по которой мениск пересекается с ограждающей поверхностью, —

периметром смачивания. Характеризуют мениск краевым углом между смоченной поверхностью стенки и касательной к мениску в точке пересечения мениска с
поверхностью стенки. Если 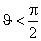 , то жидкость считается смачивающей поверхность, а
, то жидкость считается смачивающей поверхность, а
при 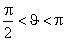 — жидкость не смачивает стенку сосуда (рис. 7.7).
— жидкость не смачивает стенку сосуда (рис. 7.7).
Рис. 7.7
Могут иметь место и предельные случаи смачивания. Например, при = 0 жидкость растекается по твердой поверхности тонкой пленкой. Полным смачиванием обладает керосин на поверхности стекла. При = π наблюдается обратное явление — полное несмачивание. Здесь жидкость стягивается в сферическую каплю и имеет точечное соприкосновение с поверхностью твердого тела. Подобным образом ведет себя капля воды на поверхности парафина. Смачивание и несмачивание относительно — жидкость смачивает одну поверхность и не смачивает другую. Так, вода смачивает чистую поверхность стекла и не смачивает его при жировых загрязнениях; ртуть не смачивает стекло и смачивает чистые поверхности металлов.
Смачивание жидкостью твердой поверхности имеет важное значение при организации пленочной или капельной, более эффективной в тепловом отношении, конденсации, например, водяного пара в конденсаторах паротурбинных установок тепловых и атомных электрических станций. Кроме того, практическое применение рассмотренное явление находит еще в методе флотационного обогащения руды. Отделение раздробленной руды от пустой породы осуществляется следующим образом: вначале производится перемешивание руды и породы в жидкости, смачивающей пустую породу и не смачивающей руду; затем — отстаивание с продувкой всей системы воздухом. При этом смоченные жидкостью частицы породы оседают на дно, а крупинки минералов «прилипают» к пузырькам воздуха и всплывают на поверхность. И последний пример практического приложения явления смачивания. Механическая обработка металлов облегчается и ускоряется при смачивании их специальными жидкостями.
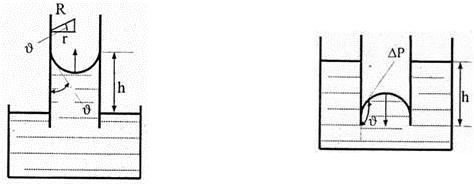
Искривленная поверхность оказывает на жидкость добавочное давление, обусловленное силами поверхностного натяжения. Это давление для выпуклого сферического мениска положительно, а для вогнутого — отрицательно и соответственно равно:
P = ± 2ζ /R , Па. (7.2)
Следовательно, для вогнутой сферической поверхности жидкости давление под поверхностью меньше на величину Р .
Формула (7.2) является частным случаем формулы П. Лапласа, определяющей избыточное давление, создаваемое силами натяжения на произвольной поверхности жидкости двоякой кривизны
Р = ζ(1/R 1 + 1/R 2 ), Па,
где R 1 и R 2 — радиусы кривизны двух сечений, взаимно перпендикулярных, нормальных поверхности жидкости в данной точке. Радиус кривизны может быть положительным, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицательным в противоположном случае.
Очевидно, что при R 1 = R 2 = R формула Лапласа переходит в P = ± 2ζ /R . Под действием указанного перепада давлений жидкость в трубке малого диаметра — капилляре, находящемся одним концом в сосуде с жидкостью, может подниматься или опускаться на высоту h . В жидкости под вогнутой поверхностью в капилляре появится отрицательное избыточное давление. Наличие этого давления приводит к подъему жидкости в капилляре на высоту h , так как под плоской поверхностью жидкости в широком сосуде избыточного давления нет (рис. 7.8). В случае, когда жидкость не смачивает стенки капилляра, положительное избыточное давление приведет к опусканию жидкости в нем на высоту h относительно уровня жидкости в сосуде (рис. 7.9). Из изложенного очевидно, что гидростатическое давление столба жидкости в капилляре уравновешивается избыточным давлением Р : 2ζ /R = ρgh . Так как cos = r /R и R = r /cos , то h = 2ζcos /(ρgr ), м. Очевидно, что высота поднятия или опускания жидкости в капилляре обратно пропорциональна его радиусу. В тонких капиллярах жидкость поднимается высоко.
Рис. 7.8 |
Рис. 7.9 |
Явления изменения высоты уровня жидкости в капиллярах называют капиллярными или просто капиллярностью. Они играют немалую роль в природе и технике. Влагообмен в почве и растениях осуществляется за счет поднятия воды по тончайшим капиллярам. Действие фитилей, впитывание влаги бетоном и другими материалами также происходит за счет капиллярности.
Осмос. Осмотическое давление
Среди биологических тканей есть своеобразные пленки, которые обладают способностью пропускать через себя молекулы воды, оставаясь непроницаемыми для молекул растворенных в воде веществ. Свойства таких пленок являются причиной физических явлений, называемых осмотическими, или просто осмосом.
