
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf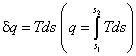
В необратимых процессах в изолированной системе состояния меняются так, что их термодинамическая вероятность, а значит, и суммарное значение энтропии растет, ds > 0. В обратимых процессах в изолированной системе любое состояние является равновероятным, ds = 0. В общем случае имеет место принцип возрастания энтропии — ds ≥ 0. Получен тот же результат, что и при феноменологическом толковании энтропии.
Таким образом, возрастание энтропии изолированных систем указывает на наиболее вероятное направление протекания естественных процессов. Наиболее вероятным является равновесное состояние, при котором система будет иметь максимальное значение энтропии. При этом не исключается возможность маловероятных событий, называемых флуктуациями, когда ds < 0 и имеет место несоблюдение второго закона термодинамики.
Кстати, мир Земли — мир постоянной энтропии, так как практически всю теплоту, получаемую от Солнца и от земных источников и в том числе за счет необратимых процессов (горение, механическое трение, электрическое сопротивление, теплообмен, ...), наша планета излучает в космос. В результате такого переизлучения энтропии в природе остаются изменения, по которым можно судить об эволюции природы.
Некоторые свойства энтропии
Энтропию нельзя измерить, ее смысл практически невозможно продемонстрировать. Но, несмотря на многоликость энтропии, ее можно понять по следующим интерпретациям. Вначале для иллюстрации сказанного используем уже известные определения энтропии, как функции состояния.
1.Энтропия — индикатор направленности процессов термического взаимодействия системы со средой: ds > 0 при δq > 0, ds < 0 при δq < 0, ds = 0 при δq = 0.
2.Энтропия — индикатор направленности необратимых процессов в теплоизолированной системе ds > 0 при δq = 0.
3.Энтропия — мера необратимости реальных процессов, мера потери работоспособности системы (потери работы вследствие необратимости), мера обесценивания энергии для потребителя, ее деградации, то есть мера рассеивания энергии. Эта характеристика следует из принципа возрастания энтропии — ds > 0. Чем более необратим процесс в изолированной системе, тем больше возрастает энтропия и тем
большая часть энергии , не переходя в работу, рассеивается в окружающей среде. Следовательно, энтропия позволяет оценить энергетические возможности термодинамических систем.
4.Энтропия — мера трудности возврата системы в первоначальное состояние с начальной энтропией. Под «трудностью возврата» понимают количество энергии, необходимое для этого.
5.Энтропия — мера вероятности данного состояния системы. В теплоизолированной системе при протекании необратимых процессов состояния меняются так, что термодинамическая вероятность и энтропия возрастают. При обратимых процессах в теплоизолированной системе любое из состояний равновероятно и энтропия системы неизменна.
6. Энтропия — мера ценности теплоты, ее работоспособности и технологической эффективности. Опыт свидетельствует о том, что чем выше температура теплоносителя при том же количестве теплоты, то есть чем меньше энтропия (s = q /T ), тем теплота ценнее, поскольку может быть использована не только для технологических нужд — выплавки металла, выпечки хлеба, отопления, но и для получения работы, например, в силовой установке летательного аппарата.
Таким образом, два энергетически эквивалентных количества теплоты q l = q 2 , совсем не эквивалентны по содержащейся в них энтропии: то количество теплоты, которое связано с большей температурой, несет в себе меньше энтропии, чем то, которое связано с меньшей температурой.
7. Энтропия — мера беспорядка (порядка) в системе. Это так называемая структурная энтропия. Она является мерой неупорядоченности строения систем. До сих пор приходилось иметь дело с тепловой энтропией. При подводе теплоты к системе энтропия ее возрастает, так как увеличивается хаотичность теплового движения микрочастиц, порядок в системе при этом уменьшается. Наоборот, охлаждение системы при постоянном объеме есть отвод теплоты от системы, а следовательно, и энтропии; упорядоченность системы при этом за счет уменьшения кинетической энергии и хаотичности движения микрочастиц возрастает, а энтропия уменьшается. При конденсации газа упорядоченность в расположении молекул скачком увеличивается, что соответствует ступенчатому уменьшению энтропии. При дальнейшем уменьшении температуры уменьшаются интенсивность теплового движения, беспорядок в системе и ее энтропия. Кристаллизация жидкости приводит к образованию правильной кристаллической решетки и дальнейшему увеличению порядка и уменьшению энтропии. Подобная зависимость в изменении температуры, энтропии и порядка позволяет предположить, что при нуле абсолютной температуры тепловое движение полностью прекратится Е к = 3k Т /2 = 0 и в системе установится максимальный порядок, то есть неупорядоченность и энтропия станут равными нулю. Это предположение, не поддающееся опытной проверке, ибо абсолютный нуль температуры недостижим из-за необратимости реальных процессов охлаждения, называют тепловой теоремой Нернста или третьим законом термодинамики — при абсолютном нуле: максимум порядка,
отсутствие беспорядка, энтропия равна нулю —  .
.
8. Энтропия — мера недостатка информации. Это так называемая информационная энтропия. Природные и техногенные процессы взаимосвязаны, и между ними происходит обмен не только энергией, веществом, но и информацией. Основным фактором в организации функционирования системы (машины, организма, общества) является движение в ней информации. Если макросистема находится при температуре, близкой к абсолютному нулю, то lnW = 0, а термодинамическая вероятность W = 1. В этом случае данное макросостояние системы может быть реализовано только одним микросостоянием, так как каждая молекула, имея скорость, равную нулю, занимает определенное положение. Это состояние системы является предельным и соответствует кристаллическому состоянию химически однородного тела, при котором количество информации о системе максимально. Это значит, что более организованные системы способны дать о себе большую информацию, чем менее организованные. Таким образом, информацию относят к исследуемой системе, считая ее функцией состояния системы, которая не имеет отношения к интеллекту, памяти человека. Изложенное наводит на мысль о связи информации с вероятностью состояния системы, а следовательно, и с энтропией. В данном случае энтропия равна нулю, а информация максимальна (рис. 6.12).
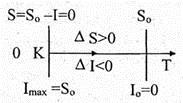
Рис. 6.12
Рассмотрим противоположную ситуацию: идеальный газ находится при высокой температуре. Положение хаотично движущихся молекул в этих условиях совершенно неопределенно, и о них нельзя получить никакой информации, кроме той, что они движутся, то есть в этом случае информация близка к нулю, а энтропия — к максимуму (рис. 6.12). Следовательно, информация о микросостоянии тем меньше, чем больше W , а значит, и энтропия S , Дж/К. Таким образом, энтропия оказывается величиной, изменяющейся противоположно информации I
I = K lnW = – S , бит,
где K — постоянная, по физическому содержанию отличная от постоянной Больцмана.
Итак, информация эквивалентна отрицательному изменению энтропии. А. Бриллюэн назвал отрицательную энтропию негэнтропией. И отсюда появляется еще одна характеристика энтропии, как меры неопределенности сообщения. Относительно изменения этих двух величин предыдущее можно сформулировать следующим образом. Изменение энтропии системы противоположно изменению информации о ней. Информация — мера трудности познания макросостояния системы. Это значит, что из-за незнания микросостояния системы надо затратить много энергии, или, точнее, негэнтропии для возвращения системы в более упорядоченное состояние.
Интересно следующее замечание по данному свойству энтропии. В процессах развития наблюдаются две тенденции: стремление к усложнению организации системы и одновременно — к упрощению. Первая тенденция равносильна накоплению информации, а тенденция к упрощению означает уменьшение информации и накопление энтропии. Ведущей все-таки является тенденция усложнения.
Кстати, энтропийная основа информации была ясна до создания в 1949 г. теории информации.
9. Энтропия — мера жизненного потенциала. Возможность применимости второго закона термодинамики к биологическим объектам интересует ученых с давних пор. Все живые, как, впрочем, и неживые объекты мира метастабильны. Мета-стабильность обусловлена, прежде всего, тем, что упомянутые объекты имеют определенную форму. Живым существам приходится активно бороться за ее сохранение и даже усложнение. Потеря формы означает смерть. Деятельность поддержания формы у неживых объектов устанавливается степенью активности их энергетического взаимодействия с окружающей средой. Форма, например, алмаза поддерживается неизменной на протяжении миллионов лет. У работающего алмаза продолжительность существования формы значительно меньше. Здесь уместно вспомнить, что термодинамика описывает любые явления, связанные с энергетическими процессами, которые невозможны в бесструктурных системах (системах без формы). Итак, второй закон, как смертный приговор, неукоснительно исполняется в неживой природе.
В 1935 г. Э. Бауэр сформулировал три основные особенности живых систем: самопроизвольное изменение состояния, противодействие внешним силам, постоянная работа против уравновешивания с окружающей средой. Третья особенность является отличительным признаком биологических систем. Она имеет очевидный термодинамический смысл.
Э. Шредингер также считал особенностью биологических объектов их неуравновешенность с окружающей средой, которая поддерживается непрерывным обменом открытой живой системы с окружающей средой, пищей, питьем, дыханием и т. д. Пища и остальные формы обмена представляют собой материал, необходимый для создания нового в системе. Конструирование же нового и выход на иной уровень упорядоченности системы создается, однако, не пищей, а развивающимся организмом.
Основное свойство всего живого состоит в том, что в момент перехода к состоянию равновесия оно поворачивает процесс в обратном направлении, и при этом живая система не просто восстанавливает свою структуру (энтропия системы понижается), но и делается более совершенной. Следовательно, неравновесное состояние биологических объектов поддерживается за счет извлечения ими из окружающей среды отрицательной энтропии
— негэнтропии. Это равнозначно сбросу «наработанной» положительной энтропии. Ведь чем выше энтропия, тем больше беспорядок в системе — дряблость кожи, нарушение координации движений, потеря памяти и многое другое. Таким образом, жизнь в энтропийном отображении напоминает возвратно-поступательное движение вдоль энтропийной оси по схеме, вначале до достижения физиологической зрелости: шаг вперед, два шага назад (негэнтропийная тенденция эволюции биологических систем), а затем: два шага вперед, шаг назад (энтропийная тенденция). Получается, что жизнь — это, прежде всего, постоянная и затухающая реакция организма, вызванная изменениями условий окружающей среды и направленная только на возврат к исходному состоянию, то есть на поддержание внутренней среды организма. Другими словами, живую природу от неживой отличает обязательная обратимость физиологических процессов одновременно с естественной и обязательной для неживых систем необратимостью, обусловленной эволюционной морфологией биологического объекта. Именно эволюция объекта, и в том числе живого, приводит к возрастающему образованию структурной энтропии. Кстати, затормозить, сдержать рост энтропии можно уменьшением количества потребляемой пищи и увеличением Двигательной активности биологического объекта. Поэтому старение начинается с момента, когда возникает смена негэнтропийных тенденций на энтропийные. С этого момента организм постепенно утрачивает способность к восстановлению и Усложнению своей структуры, вследствие снижения естественной физической активности, когда процессы синтеза перестают быть избыточными. Следует заметить, что окончательно не постигнута тайна, как организм без какого-либо вмешательства извне вначале в течение какого-то периода времени сам творит себя и лишь начиная с определенного времени сам же себя и разрушает. Но еще более загадочной является проблема: жизнь — это случайное или закономерное явление природы.
10. Энтропия — индикатор невозможности обратить течение времени. Природные процессы, как показывает человеческий опыт, являются необратимыми и идут в направлении накопления энтропии. Природой предусмотрен определенный порядок чередования событий, по которому она, по крайней мере, в пределах отдельных макрочастей стремится к равновесию. Однако порядок чередования событий в некоторых случаях нельзя смешивать с направлением событий (направлением времени). Например, точки на прямой линии могут быть расположены в определенном порядке, но направление здесь отсутствует, так как сама линия не обладает каким-либо направлением. В
необратимых же процессах приходится иметь в виду и порядок чередования событий, и направление времени в сторону его накопления. Постоянный во времени процесс роста энтропии психологически воспринимается как естественное направление времени. Порядок необратимых процессов во времени находится также во взаимосвязи с причинноследственным механизмом. В нашем понимании причина и следствие идут во времени так, что сперва действует причина, а уж за нею появляется следствие. Конечно же, отношения между событиями сложнее, но очевидно, что второй закон термодинамики затрагивает глубокие философские вопросы.
Итак, последовательность событий, обусловленная законом возрастания энтропии, и привычная направленность времени приводят к очевидным выводам: время движется от прошлого к будущему; момент «теперь» есть настоящее время, отделяющее прошлое от будущего. Настоящее — это миг в сравнении с бесконечным прошлым и будущим; прошлое никогда не возвращается; нельзя изменить прошлое, но можно изменить будущее; можно иметь летописи прошлого, но не будущего.
Теория «тепловой смерти Вселенной»
Р. Клаузнус в 1864 г. в качестве одной из формулировок второго закона термодинамики предложил: «Энтропия мира стремится к максимуму». Таким образом, Р. Клаузиус отождествил Вселенную с понятием изолированной системы. А как известно, в изолированной системе необратимые процессы приводят к росту энтропии, а при этом в результате трения, теплопроводности, теплового излучения, химических реакций потенциалы в системе выровняются — исчезнет неоднородность в структуре системы, наступит термодинамическое равновесие с максимальной энтропией.
Формулировка Р. Клаузиуса означает, что Вселенная, испытав непрерывный ряд превращений энергии, придет на основании закона возрастания энтропии и по истечении достаточно большого промежутка времени к состоянию равновесия, когда все имеющиеся во Вселенной разности физических величин и в том числе температур станут равными нулю, всякое макродвижение прекратится, и наступит тепловая смерть Вселенной. Правомерность признания такой теории касается вопроса о границах применимости закона возрастания энтропии. Уже известно, что второй закон неприменим к микромиру. Но если предположить, что теория «тепловой смерти Вселенной» является надуманной, тогда закон возрастания энтропии неприменим и к мегамиру. Остается, что этот закон термодинамики применим только к макропроцессам, протекающим в макромире, исключая процессы микро- и мегамира. Это следует из того, что второй закон термодинамики имеет статистическую природу. Движение же тел, составляющих микро- и мегамир, является не хаотическим, а происходит по своим динамическим законам.
Несмотря на свою ошибочность, теория сразу же нашла признание у определенной части научной общественности и служителей церкви. Например, известный советский (обратите внимание, при прежней-то идеологии) физик А. Иоффе в XX столетии сказал: «... в бога я не верю, я не приписываю ему сотворение мира. Я не знаю, кто создал мир, но я твердо знаю, что он идет к постепенному выравниванию всех и всяких потенциалов, к состоянию наибольшей вероятности... Энтропию нельзя перешагнуть».
Теория «тепловой смерти Вселенной» приводит к энтропийному концу света, а следовательно, неизбежно и к божественному происхождению или первоначалу Вселенной. Папа Пий XII по этому поводу заметил: «Закон энтропии, открытый Рудольфом Клаузиусом, дал нам уверенность в том, что в замкнутой материальной системе, в конце концов, процессы в макроскопическом масштабе когда-то прекратятся.
Эта печальная необходимость свидетельствует о существовании Необходимого Существа». Мысль, высказанная главой христианской церкви в середине XX века, приводит к противоречию с принципом вечности движения во Вселенной, выражающимся в законе сохранения и превращения энергии.
Основной вывод по проблеме состоит в том, что для земных процессов не существует предела, когда они приведут Землю к единому равновесному состоянию, «тепловой смерти», к возможному максимуму энтропии. Земная система, как и Вселенная, не является изолированной, и для нее возможно уменьшение энтропии и концентрации энергии, не нарушающее общего баланса энергии космического пространства.
Тепловая диаграмма Ts. Теплота — функция процесса
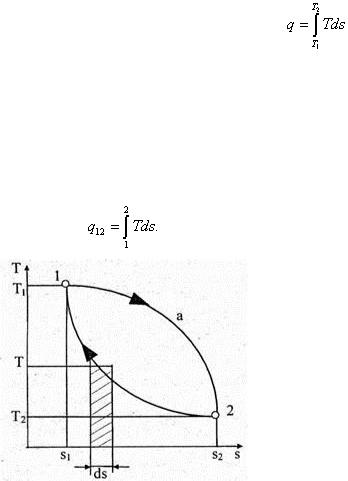
Известно, что энтропия является функцией состояния системы. В аналитических и графических расчетах удобно пользоваться удельной энтропией — s , Дж/(кг · К). Чтобы
рассчитать удельную теплоту процесса через энтропию по формуле ,необходимо знать уравнение процесса Т = f (s ). Если же процесс задан графически в системе координат Ts , то и теплоту процесса легко найти графически. Исходя из этой возможности диаграмму Ts называют тепловой или энтропийной. С помощью диаграммы удельная теплота может быть определена графически площадью под кривой процесса. Действительно, элементарная площадка с основанием ds и высотой Т равна Tds , то есть элементарной теплоте δq в бесконечно малом процессе (рис. 6.13). Вся площадь 12s 2 s 1 1 определяет удельную теплоту в конечном процессе 12:
Рис. 6.13
Подводимое (или отводимое) количество теплоты q 12 (q 21 ) зависит от характера процесса, так как между состояниями 1 и 2 можно провести ряд процессов, и теплота для каждого из них будет иметь конкретное значение. В случае перехода системы из состояния 1 в состояние 2 по траектории 1а 2 теплота q 1 a 2 > q 12 на величину площади 1а 21. Таким образом, теплота является функцией процесса.
Достоинство диаграммы Ts состоит еще и в том, что по направлению кривой процесса легко определить знак теплоты согласно уравнению (6.43). Таким образом, если, например, энтропия уменьшается, то удельная теплота отводится независимо от знака
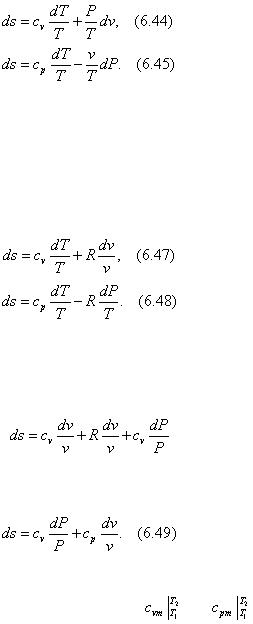
изменения температуры. Следует обратить внимание на последнее утверждение: увеличение или уменьшение температуры в общем случае не позволяет судить о том, подводится или отводится теплота. Признаком подвода теплоты может служить только рост энтропии, а отвода — ее уменьшение.
Вне процесса понятие теплоты не имеет смысла, так как означает не запас энергии, а ее количество, передаваемое в ходе процесса.
Изменение энтропии идеального газа
Рассмотрим уравнения первого закона термодинамики для закрытых и открытых систем с учетом того, что δq = Tds :
Tds = cv dT + Pdv ,
Tds = cp dT – vdP .
Разделив обе части уравнений на Т , получим
Из уравнения состояния идеального газа
Pv = RT |
(6.46) |
получим Р /Т = R /v и v /T = R /P . Подставим полученные выражения соответственно в
(6.44) и (6.45):
Продифференцируем уравнение состояния идеального газа: Pdv + vdP = RdT и почленно разделим на (6.46): dT /T = dv /v + dP /P . Полученное равенство подставим в формулу (6.47):
или
Рассмотрим конечный процесс 12, в котором температура изменяется от Т 1 до Т 2 , а
средние изохорная и изобарная теплоемкости |
и |
постоянны. Тогда |
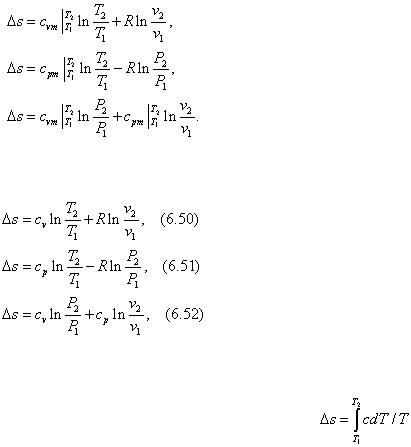
интегрирование уравнений (6.47), (6.48) и (6.49) позволяет получить разность энтропии в виде:
При постоянной теплоемкости уравнения записываются следующим образом:
В некоторых случаях бывает известна истинная теплоемкость процесса с . Тогда из соотношения теплоемкости и энтропии следует ds = cdT /T , или s = ∫ cdT /T + const .
Изменение энтропии в процессе 12, когда известно с = f (T ), будет равно: . При расчетах изменения энтропии в процессах с постоянной теплоемкостью предыдущая формула принимает вид: Δs = c ln (T 2 /T 1 ).
Схема исследования процессов
Все возможные термодинамические процессы изменения состояния идеального газа, в которых скорость движения газа пренебрежимо мала, могут быть проанализированы при том условии, что процессы обратимы, а теплоемкость при их протекании постоянна. Термодинамический процесс обязательно сопровождается изменением параметров и функций состояния, подводом или отводом теплоты, производством или затратой работы.
Втермодинамике имеют дело с пятью основными термодинамическими процессами:
●изохорным, протекающим при постоянном объеме, v = const , V = const (от греч. isos — равный, одинаковый, подобный и chord — пространство);
●изобарным, протекающим при постоянном давлении, Р = const ;
●изотермическим, протекающим при постоянной температуре, Т = const ;
●адиабатным, протекающим без теплообмена рабочего тела с окружающей средой, δq = 0 (от греч. adiabatus — непереходимый).
На каждый из названных процессов накладывается какое-либо ограничение. В реальных же условиях термодинамический процесс развивается с изменением всех параметров. Для анализа подобных процессов вводится понятие политропного процесса, у
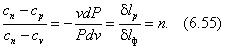
которого имеет место только одно ограничение: он должен от начала и до конца идти при неизменной теплоемкости. Таким образом, пятым термодинамическим процессом считается политропный (от греч. poly — много, tropos — поворот, направление). Отсюда политропный — значит многонаправленный. Политропный процесс является наиболее общим, а остальные четыре можно рассматривать как его частные случаи при условии, конечно, что они будут идти при неизменной теплоемкости. Поэтому изучение процессов следует начать с рассмотрения политропного.
Общая схема изучения процессов с идеальным газом состоит в следующем:
1. Выписывают с целью анализа аналитические выражения первого и второго законов термодинамики для обратимых процессов в виде:
δq = du + δl ф = cv dT + Pdv , δq = dh + δlp = cp dT – vdP , δq = Tds
иуравнения δq = cn dT и Pv = RT .
2.С помощью этих формул делают вывод уравнения процесса в координатах Pv и Ts
играфическое изображение его на диаграммах с указанными координатами.
3.Устанавливают зависимость между параметрами состояния в процессе.
4.Рассчитывают изменение функций состояния, теплоту и работу.
Политропный процесс
В координатах Pv уравнение политропы можно получить из совместного рассмотрения выражения δq = cn dT и первого закона термодинамики для закрытых и
открытых систем: |
|
δq = cn dT = cv dT + Pdv ; (cn – cv )dT = Pdv = δl ф , |
(6.53) |
δq = cn dT = cp dT – vdP ; (cn – cp )dT = – vdP = δlp . |
(6.54) |
Разделив (6.54) на (6.53) и обозначив отношение через п , получим
где п — –∞ … +∞ , показатель политропы. Для конкретного процесса показатель политропы является величиной постоянной.
Из (6.55) имеем nPdv + vdP = 0 или dP /P + ndv /v = 0, а после интегрирования ln Р + п lnv = ln (Pvn ) = const и последующего потенцирования окончательно следует уравнение политропного процесса в координатах Pv :
Pvn = const . (6.56)
В координатах Ts уравнение процесса получим так: δq = с n d Т = Tds , откуда ds = cn dT /T , а после интегрирования
s = с n lnT + const ,
то есть политропа на диаграмме с координатами Ts представляет собой логарифмическую кривую.
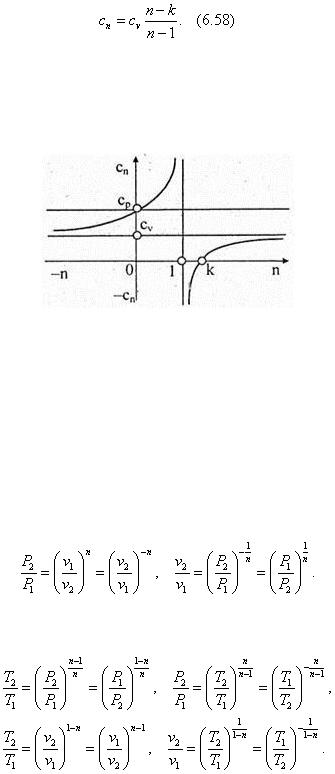
Аналитическое выражение теплоемкости политропного процесса следует из (6.55) после следующих преобразований:
п = (с n – с p )/(сn – сv ) = (сп – kcv )/(cn – cv ), ncn – ncv = cn – k с v , псп – сп = ncv – kcv
Функция (6.73) представлена на рис. 6.14. Из рисунка очевидно, что при значениях 1 < п < k , то есть у всех политропных процессов, расположенных между адиабатой и изотермой, теплоемкость газа отрицательна. Это значит, что δq и dT , входящие в общее выражение теплоемкости сn = δq /dT , имеют для этих процессов противоположные знаки.
Рис. 6.14
Следовательно, в процессах расширения на производство работы расходуется не только подведенная к рабочему телу теплота, но и часть внутренней энергии, за счет чего температура газа понижается. В процессах сжатия, наоборот, от газа отводится меньшее количество теплоты, чем затрачиваемая на его сжатие работа. Положительная разность δl
– δq , согласно первому закону термодинамики, расходуется на увеличение внутренней энергии рабочего тела du > 0, что обусловливает повышение его температуры.
Из (6.56) следуют соотношения Р , v параметров состояния в любых двух точках на политропе
Используя уравнение Клапейрона, установим соотношения Р , v , T параметров:
