
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf
Твердое вещество, растворяясь в жидкости, равномерно распределяется в ее объеме. Получаемую среду называют раствором, жидкость — растворителем, а бывшее твердое тело — растворенным веществом. Плотность растворенного вещества массой т в объеме V раствора принято называть концентрацией раствора С = т /V , кг/м3 . Предельную концентрацию раствора, соответствующую состоянию насыщенного раствора, называют растворимостью. Растворимость некоторых веществ в значительной степени зависит от типа растворителя и его температуры. Так, например, в стакане воды при температуре 80 ºС растворяется 720 г сахара. При этом получается насыщенный раствор, и представляет он собой густой и вязкий сироп. А концентрация сахара в воде при указанной температуре равна. 0,72/0,2 = 3,6 кг/л. При малых концентрациях раствора размеры молекул растворенного вещества значительно меньше расстояний между ними и растворенное вещество напоминает идеальный газ с той разницей, что их поведение все же регламентируется присутствием молекул растворителя. Такие растворы называют слабыми или разбавленными. И поэтому возникает мысль о допустимости применения к растворенному веществу в слабых растворах законов идеального газа.
Поскольку раствор представляет двухкомпонентную смесь молекул или атомов разных веществ, то можно говорить о парциальном давлении растворенного вещества, величину которого можно определить по основному уравнению кинетической теории газов или из уравнения состояния для m кг идеального газа
P = mRT /V , Па, (7.3)
где п — концентрация молекул растворенного вещества, м–3 ; <Е k > — средняя кинетическая энергия молекулы растворенного вещества, Дж; т — масса растворенного вещества, кг; R — индивидуальная газовая постоянная растворенного вещества, Дж/(кг·К); Т и V — температура и объем раствора, К и м3 . Правомерность использования любой из формул доказывается опытным путем.
Рассмотрим такой опыт. Трубка, изготовленная в форме перевернутой буквы «П» (рис. 7.10), разделена на две части полупроницаемой перегородкой, например, из бычьего пузыря, кишечной ткани или полимерной пленки. В левую трубку наливается слабый водный раствор сахара, а в правую такое же по объему количество чистой воды. Понятно, что первоначальные уровни жидкости в трубках одинаковы. Однако через незначительное время жидкости устанавливаются на разных уровнях. При этом, как изображено на рис. 7.10, повышается уровень в левой трубке, где находится раствор, за счет понижения уровня в правой. Вызвано это тем, что для водного раствора сахара перегородка, разделяющая трубки, является полупроницаемой. Поры в перегородке настолько малы, что через них могут пройти молекулы воды (H 2 О, молярная масса 18 кг/кмоль), но не пройдут более крупные молекулы сахара (химическая формула сахара C 12 H 22 O 11 , а молярная масса 342 кг/кмоль). Поэтому через перегородку в основном диффундируют молекулы воды из правой трубки в левую, что и вызывает подъем уровня жидкости. Вода стремится разбавить раствор. Это явление и называют осмосом, а столб жидкости высотой h — осмотическим давлением. Возможно движение жидкости и в противоположном направлении, но в значительно меньшей степени.
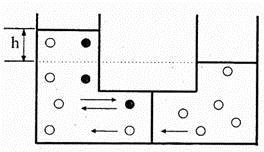
Рис. 7.10
Рассмотрим причину появления осмотического давления. В правой трубке давление создается одной лишь водой. В левой — полное давление складывается из давления воды и парциального давления растворенного вещества. Так как движение через перегородку возможно только для чистой воды, то равновесие в положении жидкостей устанавливается не тогда, когда давление справа равно полному давлению слева, а когда давление чистой воды равно парциальному давлению воды в растворе. Возникающая разность давлений равна давлению растворенного вещества. Таким образом, движущей силой направленного перехода воды является большая концентрация молекул воды в правой трубке по сравнению с левой. Повышение уровня раствора в трубке на высоту h будет иметь место до выравнивания концентраций молекул воды в трубках.
Явление диффузии растворителя через мембрану, отделяющую раствор от чистого растворителя, называют осмосом, а возникающее при этом в растворе избыточное давление, равное парциальному давлению растворенного вещества, — осмотическим давлением. На основании опытных данных осмотическое давление равно Р = ρgh , Па, где ρ — плотность раствора, кг/м3 . Осмотическое давление обнаруживается при погружении высушенной ягоды с неповрежденной оболочкой в воду. Оболочка ягод проницаема для молекул воды и непроницаема для молекул сахара, находящихся в ягоде. Вода диффундирует внутрь ягоды и образует там сахарный раствор. В нем создается избыточное осмотическое давление, распирающее оболочку ягоды — ягода набухает и принимает сферическую форму. Используя понятие концентрации раствора, уравнение (7.3) можно преобразовать к виду
P = CRT , Па,
из которого очевидно, что осмотическое давление пропорционально концентрации и температуре раствора — закон Вант Гоффа, установленный в 1887 г.
Явление осмоса является важным в жизни растительных и животных-организмов. Оболочки клеток обладают свойством полупроницаемости. Они проницаемы для молекул воды и непроницаемы для молекул сложных органических соединений, рождаемых внутри клетки. Таким образом, внутри клетки образуется водный раствор и возникает осмотическое давление. Клетка в процессе своей жизнедеятельности сохраняет свойства упругости. Осмотическое давление, например, у моркови достигает (2–4)·105 Па. Кстати, чувство жажды, возникающее после приема сладкой, соленой пищи, обусловлено осмотическим всасыванием воды из клетки. Подобными физиологическими процессами, как питание, дыхание, поддерживается постоянное осмотическое давление в клетках — осморегулирование. Кстати, причиной тому, что соленая вода не утоляет жажды, является также осмотическое давление. Почки не могут выделять мочу с осмотическим давлением, которое больше, чем давление в тканях организма. Поэтому организм, получивший соленую воду, не только не отдает ее тканевым жидкостям, но, напротив, выделяет с мочой воду, отнятую у тканей.
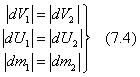
И еще один нелиричный пример из области, скорее всего, неприятных воспоминаний — слабительное действие растворов некоторых солей. Стенки кишечника полупроницаемы для ряда растворов. Например, глауберова соль в растворе не проходит через стенки кишечника. В кишечнике возникает осмотическое давление за счет отсасывания воды через ткани из организма в кишечник.
Быть может, здесь уместно заметить об удивительной способности поглощать воду композитом из винилакрилата и сахара. Этот композит поглощает воду в 300 раз больше своей массы и без изменения своей формы. Какие перспективы открываются, например, для транспорта воды!
Цит. по: Физика: учебник / Демидченко В.И. — Ростов н/Д: Феникс, 2006. — С. 183–194.
Тема 3. Фазовые равновесия и фазовые превращения
Условия фазового равновесия
Любое вещество может находиться в разных фазах. Говоря о фазах чистого вещества, обычно имеют в виду его агрегатные состояния и поэтому говорят о газообразном, жидком, твердом и плазменном состоянии вещества. Однако, если быть строгим в пользовании терминологией, то понятие фазы всего лишь связано с агрегатным состоянием вещества, но не совпадает с ним полностью, так как, например, в твердом кристаллическом веществе могут наблюдаться несколько различных фаз в виде отличных друг от друга кристаллических модификаций (фосфор красный и желтый, сера ромбическая и моноклинная и т.д.). Кстати, у солдат Наполеона от российских морозов расстегивалась форма и падали брюки из-за того, что оловянные пуговицы, не меняя своего агрегатного состояния, переходили в другую аллотропную порошкообразную фазовую модификацию. Каждая из фаз является однородной системой с одинаковыми химическими и термодинамическими свойствами во всех ее частях. Характерной особенностью фаз являются границы между ними.
Равновесное сосуществование нескольких соприкасающихся между собой различных фаз вещества называют фазовым равновесием. Чтобы найти условия фазового равновесия, рассмотрим изолированную, термодинамически равновесную систему, состоящую из двух фаз 1 и 2 одного и того же вещества. При этом количество вещества и термодинамические параметры фаз могут меняться за счет перехода вещества из одной фазы в другую. Таким образом, рассматривается система, для которой V = const , м3 , U = const , Дж, и т — const , где т — полное количество вещества в системе. Такую систему можно представить себе, например, в виде сосуда постоянного объема с идеально теплоизолированными стенками, одна часть которого заполнена водой, а другая — находящимся над ней водяным паром. Следовательно, V = V 1 + V 2 , м3 ; т = т 1 + т 2 , кг;
U = U 1 + U 2 , Дж и S = S 1 + S 2 , Дж/К.
В отличие от однородной изолированной системы здесь, помимо величин V и U , фиксируем еще и количество вещества в каждой из рассматриваемых фаз. Естественно, что изменение состояния одной из фаз возможно только за счет другой, то есть

|dS 1 | = | dS 2 |. (7.5)
Рассмотрим выражение для полного дифференциала энтропии подсистемы 1. Очевидно, что мы должны рассматривать энтропию фазы 1 S 1 как функцию не только объема V 1 и внутренней энергии U 1 , но и массы вещества в подсистеме m 1 , то есть S 1 = f (V 1 , U 1 , m 1 ). В соответствии с этим
Так как из dU = TdS – PdV при V = const , m = const и поскольку S = ms и U = mu , то
(д S /д U )V , m = 1/T . (7.7)
Аналогично для условий U = const , m = const
(д S /д V )U , m = P /T . (7.8)
В термодинамике, особенно химической, и при анализе процессов фазовых переходов, широко используется понятие химического потенциала, называемого еще удельным массовым изобарно-изотермическим потенциалом, и представляющего собой разность θ = h – Ts , Дж/кг. Произведение химического потенциала данного вещества на его массу называют энергией Гиббса Ф = θт = Н – TS , Дж. Химический потенциал обладает замечательным свойством — он позволяет рассчитать изменение так называемых характеристических функций любой системы, к которым из известных нам термодинамических функций относятся H и U , при изменении количества вещества в системе. Химический потенциал представляет собой производную от соответствующей характеристической функции по массе в системе, то есть
Энтропия не является характеристической функцией. Однако для энтропии системы производная по массе связана с химическим потенциалом следующим образом:
В соответствии с (7.7), (7.8) и (7.9) уравнение (7.6) приобретает следующий вид:
Аналогично для изменения энтропии подсистемы 2:
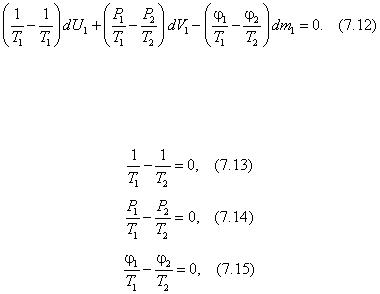
Подставляя полученные выражения для dS 1 и dS 2 в выражение (7.5), с учетом (7.4) получаем:
Поскольку дифференциалы dU , dV и dm взаимно зависимы согласно (7.4) для подсистем, то для того, чтобы левая часть уравнения (7.12) была равна нулю, нужно, чтобы были равны нулю множители при дифференциалах dU 1 , dV 1 и dm 1 , то есть
Из (7.13) и (7.14) следует T 1 = T 2 , и Р 1 = Р 2 , а из (7.15) — θ1 = θ2 .
Таким образом, если две фазы находятся в равновесии, то температура, давление и химические потенциалы этих фаз равны между собой. Аналогичным путем такой же результат может быть получен для системы, в которой количество фаз превышает две.
Кстати, из уравнения (7.10) или (7.11) в общем случае следует уравнение первого закона термодинамики для системы с переменной массой:
TdS = dU + PdV – θdm .
Фазовые равновесия и фазовые превращения. Фазовая диаграмма РТ
Вещество может переходить из одной фазы в другую, сосуществующую с первой. Этот переход называют фазовым или фазовым превращением. Переход вещества из жидкой фазы в газообразную называют испарением или парообразованием, а из твердой
— возгонкой или сублимацией. Обратный переход из твердой фазы в жидкую называют плавлением, а из жидкой в твердую — кристаллизацией или затвердеванием. Переход низкотемпературной фазы в высокотемпературную сопровождается поглощением теплоты от внешнего источника. И наоборот, при фазовом переходе от высокотемпературной фазы к низкотемпературной теплота выделяется. Соответствующее количество теплоты, которое поглощается или выделяется 1 кг вещества называют удельной теплотой фазового перехода.
Упрощенное объяснение физической стороны фазовых переходов с точки зрения молекулярной структуры вещества можно дать, исходя из теории ассоциаций, рассматривающей образование молекулярных комплексов и их разрушение.
Каждому значению температуры при данном давлении для данного вещества в жидкой или газовой фазе соответствует определенный состав молекулярных ассоциаций. Чем выше температура при данном давлении, тем меньше эти ассоциации. С повышением температуры в веществе происходит некоторое дробление молекулярных ассоциаций.
Этот процесс ускоряется вблизи точек перехода, в которых изменение молекулярной структуры вещества происходит скачкообразно.
При переходе вещества из жидкой фазы в газообразную теплота фазового перехода тратится как на работу расширения, так и на преодоление сил межмолекулярного взаимодействия, выражаемое в разрушении ассоциированных комплексов, при этом уменьшается и плотность вещества. При плавлении и сублимации теплота фазового перехода затрачивается на разрушение кристаллической решетки твердого тела.
С ростом давления образование ассоциированных комплексов в паровой фазе прогрессирует. Так как жидкая фаза находится под весьма большим внутренним давлением, то определяющим фактором в процессе образования и разрушения ассоциаций является не давление, а температура. С ростом последней ассоциация уменьшается. Именно поэтому с ростом температуры и давления теплота парообразования уменьшается.
Фазовый переход из твердой фазы в газообразную происходит при низких давлениях и называется сублимацией. Из сказанного выше следует, что теплота сублимации должна быть больше теплоты плавления и в большей степени — теплоты парообразования.
При анализе фазовых равновесий и процессов фазовых переходов важную роль играет так называемое правило фаз Гиббса. Оно формулируется так: для обеспечения равновесия многофазной системы необходимо, чтобы число фаз было равно или меньше числа компонент плюс два, то есть r ≤ п + 2.
Примером однокомпонентной трехфазной системы является система «лед — вода — водяной пар»; трехкомпонентной однофазной системы — смесь газов азота, кислорода и водорода при обычной температуре; двухкомпонентной однофазной системы — раствор хлористого,натрия в воде; двухкомпонентной трехфазной системы — система, состоящая из химически реагирующих веществ, типа
СаСО3 СаО + СО2 .
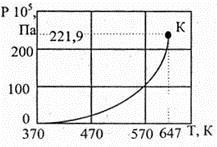
Если на диаграмме с координатами РТ построить функцию давления насыщения PS . от температуры T , то есть кривую Р = Р S (Т ), то точки этой кривой отражают состояния, в которых две фазы находятся в равновесии. Поэтому кривую Р S (Т ) называют кривой равновесия фаз или кривой упругости насыщенного пара жидкости, а саму диаграмму — фазовой диаграммой. На рис. 7.11 приведена кривая упругости насыщенного пара воды.
Рис. 7.11
Над кривой фазового равновесия расположена область жидких состояний воды, а под кривой — область водяного пара. Здесь «K » — критическая точка. Разграничить жидкое и газообразное состояние при температуре больше, чем критическая, не
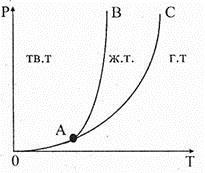
представляется возможным. Однако не вся область над кривой упругости насыщенного пара воды принадлежит жидкому состоянию. В этой области находится и кривая фазового равновесия между кристаллической и жидкой фазами воды, называемая кривой плавления. Эта кривая фазового равновесия не оканчивается сверху в некоторой точке, то есть не имеет критической точки. Кривая фазового равновесия-каждых двух из трех фаз пересекается в точке «/I », как показано для воды на рис. 7.12. В результате этого плоскость диаграммы оказывается разделенной на три области: кристаллическую (тв.т), жидкую (ж.т) и газообразную (г.т). В точке пересечения трех кривых фазового равновесия будут сосуществовать и находиться в равновесии три различные фазы вещества. Подобное состояние возможно при условии, когда давление насыщенного пара как над твердым, так и над жидким веществом будет одинаково, и называют его тройной точкой
— точка «А ». Параметры тройной точки для воды следующие: Р о = 610 Па, температура T o = 273,16 К (t о = 0,01 ºС) и соответственно для углекислоты — Р o = 5,17·105 Па, t o = – 56,7 ºС. Кривую A В фазового равновесия «лед — вода» называют кривой плавления, кривую АС фазового равновесия «вода — водяной пар» — кривой кипения и кривую АО фазового равновесия «лед — водяной пар» — кривой сублимации.
Рис. 7.12
Многие вещества имеют несколько кристаллических фаз, так как некоторые из них способны к переходу «диэлектрик-проводник», из ферромагнитного состояния в парамагнитное в точке Кюри , в сверхпроводящее состояние и т.д. У таких веществ фазовая /'/'-диаграмма имеет не одну, а несколько тройных точек. Кстати, для воды известны шесть кристаллических модификаций, и ; ее действительная фазовая диаграмма имеет более сложный вид в сравнении с представленной на рис. 7.12. Однако фазовая диаграмма, представленная на этом рисунке, достаточно реальна, так как пять из шести упомянутых фаз кристаллического состояния льда существуют при Р > 2000 бар. Обратим внимание на то, что при абсолютном нуле все вещества, кроме сверхтекучей фазы гелия
— гелия II , независимо от величины давления находятся в кристаллическом состоянии. Поэтому кривая сублимации на диаграмме Р T проходит через начало координат. Сделаем соответствующие пояснения в отношении гелия. При температуре 4,2 К (~ –269 ºС) и атмосферном давлении газообразный гелий становится жидкостью; а при T ≤ 2,19 К гелий приобретает свойство сверхтекучести. Он способен течь по узкому капилляру без трения. И, кроме того, гелий при указанной температуре становится еще и теплопроводным. Его теплопроводность в 200 раз превышает теплопроводность меди. Открытие этих свойств в тридцатые годы XX столетия принадлежит русскому физику П. Капице. Теорию же явления сверхтекучести разработал к 1941 г. физик-теоретик Л. Ландау.
Кристаллические тела
Твердые тела, в которых атомы или молекулы расположены упорядоченно и образуют периодически "повторяющуюся структуру, называют кристаллами. Они
подразделяются на моно- и поликристаллы. Для монокристалла характерна единая кристаллическая решетка и выраженная внешняя форма. Примером монокристаллов являются минералы. Монокристаллы анизотропны — их физические свойства различны по направлениям пространства. Анизотропия тепловых, электрических, механических, оптических, упругих, магнитных и других свойств обусловлена тем, что межузловые расстояния, а следовательно, и силы взаимодействия между атомами, ионами и молекулами в упорядоченной, периодической и симметричной структуре кристалла неодинаковы по разным направлениям. Структуру твердого тела с периодически повторяющейся симметрией частиц в пространстве называют кристаллической решеткой, а точки пространственной сетки, относительно которых атомы, ионы, молекулы совершают тепловые колебания — узлами кристаллической решетки.
Совокупность хаотически ориентированных мелких монокристаллов называют поликристаллом (горные породы, технические металлы и сплавы). Поликристалл изотропен, так как анизотропия имеет место только для отдельных кристаллов, а их различная ориентация приводит к изотропности поликристалла в целом.
Кристаллическая решетка обладает определенными видами симметрии, ей присущи 230 комбинаций элементов симметрии. Исходя из кристаллографического признака, кристаллы классифицируются на семь кристаллографических систем: три- и моноклинную, ромбическую, тетрагональную, ромбоэдрическую, гексагональную и кубическую. Конкретная пространственная решетка представляет собой ансамбль, составленный повторением по трем направлениям одного и того же структурного элемента, называемого элементарной ячейкой. Элементарная ячейка кристалла есть параллелепипед, построенный на ребрах а , b , с с углами α, β, γ между ребрами. Каждая из семи кристаллографических систем задается определенным соотношением параметров ячейки а , b , с , α, β и γ.
Вторым признаком классификации кристаллов является физический, когда по виду узловых частиц и характеру сил взаимодействия между ними кристаллы делятся на четыре группы: ионные, ковалентные (атомные), металлические и молекулярные.
Вспомним, что электроны около ядра в атоме удерживаются кулоновскими силами притяжения разноименных зарядов. Атом в целом электрически нейтрален. Молекулы состоят из атомов. Силы, удерживающие атомы в молекуле, по своей природе также являются электрическими. Однако возникновение их несколько сложнее. Существует в основном два типа связей атомов в молекуле: ионная и ковалентная.
Ионная связь возникает следующим образом. Сила связи электронов с ядром атома в целом различна и зависит от строения атома. Наиболее слабо связаны с атомом, валентные электроны. Они легко теряются атомом, и последний при этом преобразуется в положительный ион. Равновозможны и обратные случаи, когда устойчивый атом при благоприятных условиях захватывает один или два электрона и становится отрицательным ионом. К одновременному образованию положительно и отрицательно заряженных ионов наиболее предрасположены молекулы, составленные из двух атомов различных химических элементов. К числу таких молекул относится, например, молекула хлористого натрия, структура которой в виде ионов может быть записана как Na + Cl – , и другие галоидные соединения щелочных металлов, а также оксиды MgO , CaO и др. Здесь между ионами действуют кулоновские силы притяжения, которые и обеспечивают образование молекулы. Следует обратить внимание, что потенциальная энергия притяжения ионов Na + и Cl – переходит при их сближении в противоположную по знаку потенциальную энергию отталкивания ионов, так как они не могут проникнуть друг в
друга. Моделью ионного кристалла является совокупность непроницаемых заряженных сфер. Между ними действуют кулоновские силы. Определяющую роль, естественно, играют силы притяжения между равномерно заряженными сферами. Вклад в полную энергию взаимодействия ионов потенциальной энергии отталкивания не превосходит 10%
ееобщего значения. Непроницаемость сфер препятствует коллапсу. С теоретической точки зрения непроницаемость сфер обусловлена принципом Паули и существованием устойчивых электронных сообществ в атомах и молекулах. С физической точки зрения ионная связь может быть охарактеризована полным обменом электронами как зарядом между ионами. При частичном обмене возникает ковалентная связь. Итак, у ионных кристаллов в узлах кристаллической решетки располагаются электростатически взаимодействующие ионы противоположного знака. Но ионная связь не в состоянии объяснить существование молекул, состоящих из двух одинаковых атомов, таких,
например, как H 2 , О2 , N 2 , полупроводников: G е, Si , алмаз, графит и др. Два атома, входящие в молекулу, равноправны, и нет оснований для одного из них стать положительным, а для другого — отрицательным ионом. Связь между атомами в таких молекулах называют ковалентной.
Уковалентных кристаллов в узлах решетки находятся нейтральные атомы, взаимодействующие за счет обобществленных валентных электронов. Полное понимание ковалентной связи возможно только в рамках квантовой механики. Однако физическую суть дела можно почувствовать и в рамках классической физики на следующем примере. Два положительных заряда отталкиваются кулоновскими силами. Разместим на середине расстояния между ними отрицательный заряд, по абсолютному значению равный каждому из положительных. Тогда со стороны этого заряда на положительные заряды действуют силы притяжения в четыре раза больше, чем силы отталкивания положительных зарядов друг от друга. В результате на положительные заряды действует сила, стремящаяся их сблизить. А силы, действующие со стороны положительных зарядов на отрицательный, взаимно уравновешиваются. В реальных молекулах обобществляются обычно два электрона, и движение их происходит таким образом, что нельзя сказать, какому из атомов молекулы они принадлежат. В этом и состоит суть ковалентной связи и процесса
еевозникновения.
В узлах сетки металлических кристаллов расположены положительные ионы. Валентные электроны в кристаллах этого типа принадлежат не одному (ионный кристалл) или двум атомам (атомный кристалл), а всему кристаллу. При этом они утратили практическую связь с атомами, от которых произошли, и рассматриваются как свободные электроны всего кристалла. Плотность свободных электронов между ионами достигает заметных значений. Их поведение подобно идеальному газу, и поэтому обобществленные электроны называют электронным газом. Электронный газ обеспечивает металлам хорошую тепло- и электропроводимость.
Последний тип молекулярных кристаллов характеризуется тем, что в узлах решетки находятся нейтральные молекулы. Между молекулами действуют очень слабые вандервааль-совые силы, появление которых объясняется незначительным взаимным смещением электронов в электронных оболочках атомов. Слабость этих сил делает молекулярные кристаллы относительно предыдущих типов непрочными. Примером молекулярных кристаллов могут быть многие органические соединения: парафин, спирты, резина; твердые инертные газы; СО2 , О2 , N 2 и др.
Рассмотренные четыре типа связи не исчерпывают многообразия связей, существующих в кристаллах. Вещества с достаточно сложной кристаллической структурой не удается отнести к кристаллам с определенным типом связи, так как в них
одновременно действует несколько видов связи. Например, у графита в пределах одного слоя действуют ионная и металлическая связи, а между слоями — молекулярная связь. Кроме того, наряду с доминирующим значением одной из связей, другие типы связи могут также играть определенную роль. Например, у металлов проявляются некоторые особенности ковалентной и молекулярной связей.
Влажный воздух
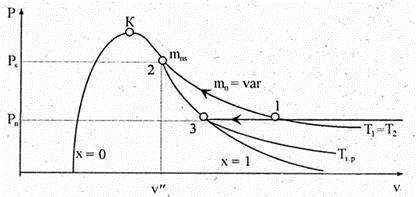
В технике кондиционирования, вентиляции, сушки влажных материалов используют смеси газов с парами, которые при определенных условиях легко конденсируются. Смеси газов, пригодные для дыхания и составляющие понятие искусственной атмосферы, применяются в высотной авиации. Примером парогазовых смесей является атмосферный воздух, в котором находится водяной пар. Смесь сухого воздуха с водяным паром называют влажным воздухом. В атмосферном воздухе водяной пар, как правило, находится под небольшим парциальным давлением и является перегретым — состояние 1 на рис. 7.13. Смесь сухого воздуха и перегретого пара называют ненасыщенным влажным воздухом. Воздух в этом случае не насыщен влагой, и его можно рассматривать как смесь идеальных газов.
Рис. 7.13
Согласно закону Дальтона давление влажного воздуха, равное барометрическому Р б , представляет собой сумму парциальных давлений сухого воздуха Р с.в и водяного пара Р п : P б = Р с.в + Р п . В состояние насыщения 2 (рис. 7.13) водяной пар во влажном воздухе может быть переведен по изотерме 12. При этом в воздухе возрастает содержание водяного пара, а следовательно, и его парциальное давление. В состоянии 2 количество водяного пара во влажном воздухе достигает максимума т п S , а его парциальное давление
— давления насыщения Ps , рис. 7.13. Смесь сухого воздуха с сухим насыщенным паром называют насыщенным влажным воздухом. Состоянию насыщенного влажного воздуха соответствует туман во время дождя при неизменной температуре воздуха. В изотермическом процессе испарения воды с поверхности почвы содержание водяного пара увеличивается и достигает максимума при насыщении воздуха влагой, то есть при появлении тумана — состояние 2 на рис. 7.13.
Если ненасыщенный влажный воздух охладить при постоянном давлении, то при температуре насыщения, соответствующей этому давлению, водяной пар, а следовательно, и влажный воздух окажутся в насыщенном состоянии. Для водяного пара на диаграмме Pv (рис. 7.13) этому переходу соответствует процесс 13, а состоянию сухого насыщенного пара точка 3. В этих условиях в процессе превращения ненасыщенного влажного воздуха в насыщенный парциальные давления сухого и водяного пара остаются постоянными. Температуру насыщения в этом случае называют температурой точки росы
