
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdfсилы отталкивания должны убывать с увеличением расстояния быстрее, чем растут силы взаимного притяжения. При этом условии молекулы могут находиться в устойчивом равновесии на определенном расстоянии друг от друга, при котором силы притяжения равны силам отталкивания. Это расстояние называют равновесным. Если под влиянием каких либо причин молекулы сблизятся на расстояние меньше равновесного, то отталкивающие силы начнут преобладать над силами притяжения и восстановят равновесное состояние между молекулами. И наоборот, если молекулы в силу какихто обстоятельств удалятся на расстояние, большее равновесного, то начнут преобладать силы взаимного притяжения и они сблизят молекулы на расстояние, соответствующее их устойчивому равновесию.
На (рис. 7.1 а) представлена качественная зависимость сил межмолекулярного действия от расстояния r между молекулами. Согласно теоретическим и экспериментальным исследованиям, межмолекулярные результирующие силы взаимодействия F обратно пропорциональны n -й степени этого расстояния — F = r – n , H
. Для сил притяжения п = 7, сил отталкивания — п = 9–15. Таким образом, для конкретного расстояния г между молекулами результирующая сила F взаимодействия этих молекул равна F o – | F п | и положительные значения ее соответствуют отталкиванию, а отрицательные — притяжению между молекулами. На расстоянии r = rp результирующая сила F = 0, то есть силы притяжения и отталкивания уравновешивают друг друга. Это значит, что расстояние r соответствует равновесному. При r < rp преобладают силы отталкивания — F > 0; при r > rp — силы притяжения, F < 0. Как показывает опыт, силы межмолекулярного взаимодействия проявляются на расстояниях между молекулами, соизмеримыми с размерами самих молекул. На расстояниях r ≥ 10–9 м силы межмолекулярного взаимодействия убывают настолько, что ими практически можно пренебречь, то есть F → 0 . Элементарная работа dA силы F при удалении молекул друг от друга на расстояние dr совершается за счет уменьшения потенциальной энергии взаимодействия этих молекул
dA = Fdr = – dUn , Дж. (7.1)
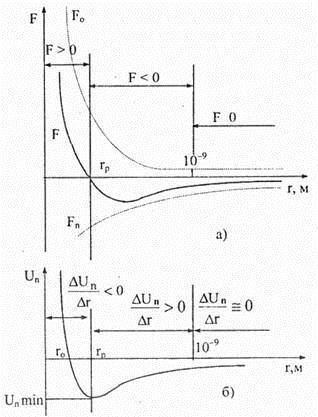
Рис. 7.1
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними, называемой потенциальной кривой, рис. 7.1 б, следует, что при r > 10–9 м, Un → 0. Подобный разреженный газ считается идеальным. При постепенном сближении молекул появляются силы притяжения F = – dUn / dr < 0, которые совершают положительную работу dA = Fdr > 0. Согласно формуле (7.1) и из рассмотренной потенциальной кривой очевидно, что потенциальная энергия взаимодействия двух молекул уменьшается и достигает минимума в состоянии устойчивого равновесия при r = rp . Таким образом, положение устойчивого равновесия молекул соответствует минимуму их потенциальной энергии. При r < rp с уменьшением г сила отталкивания F o и результирующая сила F резко возрастают, а совершаемая против сил отталкивания работа — отрицательна δА = Fdr < 0 . Потенциальная энергия также начинает резко возрастать, и изменение ее становится положительным после некоторого значения r o .
Участок потенциальной кривой, находящийся под осью абсцисс, называют потенциальной ямой, низшую точку участка — дном потенциальной ямы, а значение U п min — глубиной потенциальной ямы.
Таким образом, газ, для описания свойств которого необходимо учитывать объем молекул и силы взаимодействия между ними, называют реальным. Для реального газа непригодно уравнение Клапейрона, то есть Pv ≠ RT . Для оценки степени отклонения свойств реального газа от идеального используют коэффициент сжимаемости Z = Pv / RT . Для идеального газа Z = 1. Для реальных газов Z ≠ 1. Отличие свойств реальных газов от идеального наглядно можно проследить на ZP -диаграмме Амага (рис. 7.2).
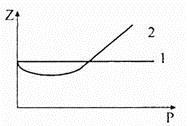
Рис. 7.2
На диаграмме зависимость коэффициента сжимаемости Z от давления Р при Т= const для идеального газа изображается горизонталью 1. Для реального газа с увеличением давления коэффициент сжимаемости Z сначала уменьшается, а затем растет — кривая 2. Это обусловлено наличием сил взаимного притяжения между молекулами, которые делают газ более сжимаемым, а наличие объема самих молекул, которые уменьшают свободный объем, делает газ менее сжимаемым. В зависимости от того, какой из этих факторов превалирует при том или ином давлении, реальный газ может быть более или менее сжимаемым относительно идеального.
Итак, газ с параметрами, близкими к параметрам конденсации, не может быть идеальным. Рабочие тела в ряде циклов преобразования энергии меняют свое агрегатное состояние, и по этой причине в газообразной фазе они, конечно же, являются реальными. Реальным газом является, например, водяной пар, используемый в качестве рабочего тела в паротурбинных двигателях тепловых электрических станций. Термодинамические свойства водяного пара в виде функции от, прежде всего, давления в настоящее время достаточно хорошо изучены и представлены таблицами и диаграммами. Знание свойств водяного пара необходимо по той причине, что 80% электрической энергии в мировом энергетическом балансе производится на тепловых электрических станциях. Водяной пар используется также в качестве рабочего тела во многих технологических процессах. Реальными газами являются и различного типа холодильные агенты, используемые в технике низких температур.
Опыт Т. Эндрюса. Критическое состояние вещества
Превратить газ в жидкость можно, либо уменьшая температуру, либо увеличивая давление. В XIX столетии повышение давления для перевода ряда газообразных веществ в жидкое состояние при T = const представлялось в техническом отношении задачей более легкой, чем понижение температуры. Майклу Фарадею удалось таким образом превратить в жидкость хлор, углекислый газ и др. Однако подобные попытки сжижения в тех же условиях водорода, азота, кислорода и других газов оказались безуспешными. В связи с этим возникло даже мнение о том, что именно эти газы являются истинными или постоянными. На самом же деле неудачи того времени были вызваны непониманием одного важного обстоятельства.
Чтобы разобраться в указанной неодинаковости свойств различных газов в случае их сжатия при одной и той же температуре английский физик Т. Эндрюс провел исследования по изотермическому сжатию углекислоты при разных температурах. В результате выполненных экспериментов он установил следующее. В процессе « ab »- сжатия при T 1 = const , рис. 7.3; по достижению определенных значений давления Ps и удельного объема v " наступает конденсация, процесс « bc » — изобарно-изотермическое превращение газа в жидкость. Давление при этом остается неизменным» поскольку уменьшение объема происходит за счет постепенной конденсации газа. При t 1 = 20 ºС давление в процессе « bc » достигает для углекислоты 6 МПа. Состояние « b »

соответствует началу процесса конденсации, состояние «с» — окончанию. Точка « b » характеризует состояние сухого насыщенного пара, точка «с » — кипящей жидкости. Сухой насыщенный пар имеет параметры насыщения (кипения или, что то же самое, конденсации), и в нем отсутствует жидкость даже в незначительных количествах. Кипящая жидкость имеет те же параметры, и в ней отсутствует пар. Их удельные объемы принято обозначать соответственна v " и v '. Дальнейшее повышение давления при T 1 = const незначительно уменьшает объем жидкой углекислоты — процесс « cd », так как жидкость мало сжимаема.
Рис. 7.3
При уменьшении давления, действующего на жидкость, углекислота «пройдет» те же самые состояния в обратном направлении; она из состояния « d » расширится до точки «с » кипения, затем последует испарение — процесс « cb », а за ним образовавшийся пар будет расширяться до атмосферного давления — состояние «а ».
Таким образом, для изотермического сжатия углекислоты характерен горизонтальный участок в виде процесса « bc » на Pv -диаграмме. Измеряя зависимость Р от v на изотермах T 1 , T 2 , T 3 ,..., T . Эндрюс установил, что чем выше температура, при которой изучается зависимость Р от v , тем меньше разность между удельными объемами газообразной v " и жидкой v ' фаз v " – v ', м3 /кг. Уменьшение горизонтального участка v "
– v ' с повышением температуры происходит за счет быстрого убывания удельного объема v " сухого насыщенного пара и увеличения удельного объема v ' насыщенной жидкости. Итак (рис.7.3), с повышением температуры разность v " – v ' уменьшается. Процесс уменьшения продолжается до тех пор, пока при некоторой температуре Tk , названной критической, эта разность не станет равна нулю v " – v ' = 0. Следовательно, в этом состоянии исчезает различие удельных объемов между жидкой и газовой фазами, так как v " = v ', то есть с повышением давления на изотерме Т k = const и на изотермах, соответствующих более высоким температурам, удельный объем вещества будет монотонно уменьшаться без скачка, характерного для фазового перехода в виде процесса
« bc ».
Точку на изотерме Т k , в которой исчезает различие между жидкой и газовой фазами, называют критической. Все параметры критической точки называют критическими. В критической точке, как очевидно из рис. 7.3, изотерма Т k имеет горизонтальную касательную и перегиб. Математически эти изменения в нелинейности критической изотермы записываются соответственно следующим образом ( dP / dv ) Tk = 0 и (д 2 P / dv 2 ) = 0. Эти соотношения, прежде всего, указывают на то, что в критической точке кривизна критической изотермы равна нулю, то есть в этой точке изотерма прямолинейна. Итак, газ, сжимаемый при Т k , по достижении критического давления Рк мгновенно переходит в жидкость, и все различия между газом и жидкостью, обусловленные разницей в
плотности, в критической точке исчезают. Наличие критической точки показывает, что между жидким и газообразным состояниями нет принципиального различия. Каждое вещество имеет свою критическую температуру и критическое давление. Для воды критическая точка соответствует температуре 374 °С и давлению 22,129 МПа; ртути соответственно 1490 ºС и 151 МПа; аммиака — 132,3 ºС и 11,28 МПа. Критическое состояние вещества характеризуется мощным развитием флуктуации плотности среды, то есть отсутствием различия между жидкостью и паром, так как исчезают силы поверхностного натяжения жидкости, а следовательно, и мениск, разделяющий паровую и жидкую фазы вещества. Выразительным признаком критического состояния является опалесценция — сильное рассеяние света на быстро возникающих неоднородностях плотности. Значительный вклад в изучение критического состояния внес Д.И. Менделеев.
При сверхкритических температурах газ не может быть превращен изотермическим увеличением давления в жидкость. И вот по этой-то причине газы, у которых критическая температура ниже комнатной, не могут быть сжижены изотермическим сжатием при комнатной температуре. То есть вышеуказанные попытки сжижения таких газов, как кислород, азот, водород, гелий потому и были неудачны, что не было известно о существовании понятия критической температуры. У этих газов критические температуры низкие: у гелия — 267,9 ºС ( Pk = 0,228 МПа), водорода — 239,9 ºС ( Pk = 1,29 МПа), азота
— 147 °С ( Pk = 3,39 МПа) и кислорода — 118,4 ºС ( Pk = 5,07 МПа). Превращать эти газы в жидкость можно лишь одним способом — надо снизить их температуру ниже указанной.
Цит. по: Физика: учебник / Демидченко В.И. — Ростов н/Д: Феникс, 2006. — С. 174–179.
Уравнение Ван-дер-Ваальса
1. Учтем теперь влияние молекулярных сил на вид уравнения состояния газов, пользуясь моделью твердых упругих шаров. Начнем сначала с влияния сил отталкивания или, что то же самое, с влияния конечных размеров молекул. Будем предполагать, что силы притяжения между молекулами не действуют. Влияние конечных размеров молекул качественно понять легко. При одних и тех же температурах и концентрациях число ударов о стенку больше в случае молекул конечного размера, чем в случае точечных молекул. Это объясняется тем, что передача импульса в газе по пространству, не занятому молекулами, происходит с тепловыми скоростями , а по пространству, заполненному абсолютно твердыми молекулами, — с бесконечной скоростью . В результате давление газа возрастает.
Исследуем теперь вопрос количественно. Будем предполагать, что плотность газа не очень велика. Тогда случаи, когда одновременно сталкиваются и приходят во взаимодействие три молекулы или больше, будут относительно очень редки. Много чаще будут встречаться такие случаи, когда сталкиваются между собой только две молекулы, а остальные молекулы в момент столкновения на них не действуют. Такие столкновения называются парными . Мы учтем только парные столкновения и полностью пренебрежем влиянием тройных, четверных и прочих столкновений. Ясно, что таким путем нельзя получить уравнение состояния газа, пригодное при больших плотностях. Можно рассчитывать лишь на получение поправок к уравнению Клапейрона.
Допустим сначала, что в сосуде объема V с гладкими стенками находятся две одинаковые молекулы 1 и 2, совершающие тепловое движение (рис. 95). Молекулы сталкиваются со стенками и между собой. Из-за этого возникает давление на стенки. Величина давления определяется суммарной кинетической энергией обеих молекул и не

зависит от того, как эта энергия распределена между молекулами . При вычислении давления можно считать, что одна молекула, например 2, все время остается неподвижной, а другая (молекула 1) движется с удвоенной кинетической энергией. Результат расчета от этого не изменится. Центры молекул не могут сблизиться на расстояние, меньшее d . Окружим молекулу 2 сферой ограждения радиуса d . Движущуюся молекулу 1 можно считать точечной. Очевидно, она не может проникнуть внутрь сферы ограждения неподвижной молекулы. Это значит, что объем, доступный молекуле 1, благодаря присутствию молекулы 2 уменьшается на объем сферы ограждения, т.е. на величину (4/3)πd 3 . Эта величина равна учетверенной сумме объемов обеих молекул.
Рис. 95
Пусть теперь в сосуде имеется N одинаковых молекул. При вычислении давления на стенку сосуда можно рассуждать так, как если бы половина из них (1/2)N покоилась и была заменена соответствующими сферами ограждения, а молекулы другой половины были точечными и двигались с удвоенной кинетической энергией. Тогда мы имели бы идеальный газ из N ' = N /2 точечных молекул с температурой Т ' = 2Т . Этим молекулам был бы доступен объем сосуда V за исключением объема, занимаемого N /2 сферами ограждения других молекул. Обозначим этот последний объем символом b . Тогда объем, доступный движущимся молекулам, будет равен V – b . Давление, оказываемое этими молекулами на стенки сосуда, равно
Если в сосуде находится моль газа, то
P (V – b ) = RT . (98.1)
Очевидно,
т. е. объем Ъ равен учетверенному объему всех N молекул газа.
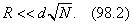
2. При выводе мы пренебрегли следующим обстоятельством. Центр движущейся молекулы не может подойти к стенке на расстояние, меньшее d /2. Для него недоступен объем пристеночного слоя толщины d /2. Граница такого слоя на рис. 95 изображена штриховой линией. Его объем равен S · d /2, где S — площадь внутренней поверхности сосуда. Такой объем учтен не был. Это можно делать, когда S · d /2 << b , т. е. S << (4/3)πNd 2 . Если сосуд имеет форму шара радиуса R , то это условие сводится к
Для одного моля при d ~ 10–8 см это дает R << 104 см = 100 м. Давление газа в шаре такого радиуса было бы порядка 10–9 атм.
3. Так как давление газа Р не может быть отрицательным, то из формулы (98.1) следует, что при всех давлениях V > b . Значение V = b достигается только при Р = ∞. Это заключение неправильно. Постоянная b равна учетверенному объему всех молекул газа. Между тем твердые шары, каковыми в нашей модели являются молекулы, можно разместить в меньшем объеме. Их, конечно, невозможно разместить в объеме b /4, в точности равном сумме объемов всех шаров. Даже при наиболее плотной упаковке останутся промежутки между шарами. При наиболее плотной упаковке общий объем всех
шаров b /4 составляет 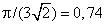 объема всего тела . Отсюда следует, что минимальный объем, до которого может быть сжат газ, по нашей модели равен
объема всего тела . Отсюда следует, что минимальный объем, до которого может быть сжат газ, по нашей модели равен
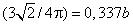 , и не b , как это было получено из уравнения (98.1). Почему же уравнение (98.1) привело нас к неправильному заключению? Потому, что мы вывели его в предположении парных столкновений, а использовали тогда, когда это условие не выполняется. При всякой более плотной упаковке каждый шар одновременно касается нескольких соседних шаров, а такие случаи при выводе были исключены из рассмотрения.
, и не b , как это было получено из уравнения (98.1). Почему же уравнение (98.1) привело нас к неправильному заключению? Потому, что мы вывели его в предположении парных столкновений, а использовали тогда, когда это условие не выполняется. При всякой более плотной упаковке каждый шар одновременно касается нескольких соседних шаров, а такие случаи при выводе были исключены из рассмотрения.
4. Рассмотрим теперь влияние сил молекулярного притяжения . Предполагая, что сил отталкивания нет, изменим модель газа. Молекулы будем считать точками, между которыми действуют силы притяжения. В отличие от сил отталкивания, действующих на близких расстояниях, силы молекулярного притяжения являются силами дальнодействующими . Во взаимодействии участвует сразу много молекул, и схема парных столкновений становится непригодной. Окружим каждую молекулу сферой молекулярного действия. Если эта сфера целиком находится внутри газа, то силы, действующие на рассматриваемую молекулу со стороны окружающих молекул, в среднем уравновешиваются (рис. 96). Но этого не будет, когда молекула находится вблизи границы газа со стенкой. Здесь сфера молекулярного действия лишь частично проходит в газе. Появляется избыток молекул, тянущих рассматриваемую молекулу внутрь газа, над молекулами, тянущими ее наружу. Таким образом, вблизи стенки возникает пристеночный слой газа , толщина которого равна радиусу сферы молекулярного действия. Каждая молекула этого слоя в среднем подвергается действию силы f , направленной в сторону газа. Величина силы f максимальна, когда молекула находится у самой стенки, и убывает при удалении от нее.

Рис. 96
Когда молекула газа летит к стенке, а затем отражается от нее, то меняется ее импульс. Изменение импульса подсчитывается совершенно так же, как это делалось при вычислении давления идеального газа. Ежесекундное изменение импульса всех молекул, падающих на единицу площади стенки и отражающих от нее, равно (1/3) nm <v 2 >. Однако, в отличие от идеальных газов, импульс налетающих молекул изменяется не только под действием сил давления со стороны стенки, но и под действием сил, с которыми их тянут внутрь газа молекулы пристеночного слоя. В частности, под действием этих последних сил молекула может отразиться внутри пристеночного слоя, не долетев до стенки. Вместо сил, действующих на налетающие молекулы, можно по третьему закону Ньютона ввести равные им и противоположно направленные силы, действующие на стенку и на молекулы пристеночного слоя. Пусть Р — средняя сила давления газа на стенку, a P i — средняя сила (отнесенная к единице площади), с которой молекулы пристеночного слоя втягиваются внутрь газа. Тогда
или
Р + Р i = nkT . (98.3)
Из изложенного видно, что давление на стенку Р не зависит от материала стенки. Роль стенки может выполнять сам газ. Проведем мысленно произвольное сечение, разделяющее газ на две части. Давление одной части на другую будет таким же, как если бы эта другая часть была твердой стенкой. Оно равно Р , а не Р + Pi или какой-либо другой комбинации этих величин. Именно это давление Р входит в уравнение гидродинамики и газодинамики.
Сила Pi называется внутренним , или молекулярным , давлением . Ее можно представить в виде Pi = <N сл f >, где f — сила, действующая на молекулу пристеночного слоя, a N сл — число молекул в нем, отнесенное к единице площади. Можно также написать Р i ~ <N сл ><f >. Обе величины <N сл > и <f > пропорциональны плотности или обратно пропорциональны объему газа. Предполагая опять, что газ взят в количестве одного моля, можно положить
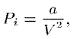 (98.4)
(98.4)
где а — постоянная, характерная для рассматриваемого газа. Тогда (98.3) переходит в

(98.5)
5. Теперь надо учесть совместное действие сил притяжения и сил отталкивания. Для неплотных газов, к которым относятся наши рассуждения, поправки на силы притяжения
иотталкивания можно вводить независимо . Тогда в результате комбинации формул (98.1)
и(98.5) получится
(98.6)
Это уравнение называется уравнением Ван-дер-Ваальса . Ван-дер-Ваальс получил его теоретически в 1873 г. Теоретический вывод уравнения (98.6) применим при выполнении условий
b << V , a /V 2 << Р . (98.7)
Кроме того, вывод предполагает, что молекулы газа сферически симметричны, поскольку он относится к модели твердых упругих шаров. С этим связано то обстоятельство, что в действительности даже для неплотных газов величины а и b зависят от температуры.
Для плотных газов уравнение Ван-дер-Ваальса, как количественное соотношение, не годится. Однако качественно оно правильно передает поведение и таких газов. Поэтому для изучения качественного поведения вещества мы будем в дальнейшем применять уравнение Ван-дер-Ваальса во всей области изменения давлений и температур. Но тогда на него надо смотреть, как на приближенное полуэмпирическое уравнение . Газы, точно подчиняющиеся уравнению Ван-дер-Ваальса, называются газами Ван-дер-Ваальса . Ясно, что они являются идеализациями.
Нетрудно записать уравнение Ван-дер-Ваальса для произвольного числа ν молей газа. Если газ занимает объем V , то молярный объем будет V /ν. Этой величиной надо заменить V в уравнении (98.6). В результате получится
(98.8)
или
(98.9)
6. Согласно закону Бойля-Мариотта произведение PV для идеальных газов остается постоянным, если только температура поддерживается постоянной. Посмотрим, как ведет себя это произведение для газа Ван-дер-Ваальса. Экспериментально удобно исследовать зависимость PV от Р , оставляя температуру постоянной. Теоретически, однако, проще получить зависимость PV от плотности ρ = μ/V . Перепишем уравнение (98.6) в виде
(98.10)
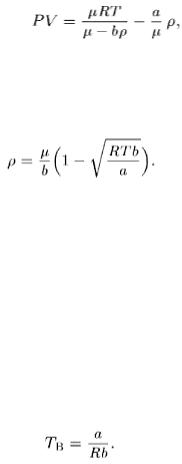
После умножения на V и замены в правой части V на μ/ρ получим
где μ — молярная масса газа. Для отыскания экстремума этого выражения находим его производную по ρ. Приравнивая ее нулю и учитывая, что μ > b ρ , найдем, что экстремум имеет место при
(98.11)
Исследование второй производной показывает, что это есть минимум. Таким образом, если изотермически сжимать газ из состояния бесконечного разрежения, то сначала он будет сжиматься сильнее идеального газа, а после прохождения через минимум PV — слабее. Это и понятно. Для разреженного газа большую роль играют силы притяжения, способствующие сжатию, чем силы отталкивания, препятствующие сжатию. Напротив, для плотных газов более существенное влияние на их поведение оказывают силы отталкивания. С повышением температуры минимум PV смещается в сторону меньших ρ. Это связано с тем, что с повышением температуры увеличивается число столкновений, а потому возрастает роль сил отталкивания. Если RTb /a = 1, то минимум смещается в начало координат ρ = 0. Температура, при которой это происходит, называется температурой Бойля . Она равна
(98.12)
Ниже температуры Бойля при сжатии газа произведение PV проходит через минимум. Так ведет себя при комнатных температурах большинство газов. Выше температуры Бойля силы отталкивания всегда перевешивают силы притяжения: с возрастанием ρ произведение PV растет монотонно. При комнатных температурах так ведут себя водород и гелий.
Изотермы газа Ван-дер-Ваальса
1. Наиболее содержательные результаты получаются из уравнения Ван-дер-Ваальса путем анализа изотерм. Уравнение изотермы можно представить в виде (98.6) или (98.10), если считать температуру Т постоянной. При высоких температурах последний член в формуле (98.10) можно отбросить. Тогда изотерма будет гиперболой, асимптотами которой являются изобара Р = 0 и изохора V = b . Всякая другая изобара Р = const будет пересекать такую изотерму в одной точке.
Для исследования изотерм при любых значениях Т умножим уравнение (98.6) на V 2 .
После раскрытия скобок уравнение изотермы примет вид
PV 3 – (RT + Pb )V 2 + aV – ab = 0. (100.1)
Это уравнение третьей степени по V , в которое давление Р входит в качестве параметра. Поскольку его коэффициенты вещественны, уравнение имеет либо один вещественный корень, либо три корня. Каждому корню на плоскости VР соответствует точка, в которой
