
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf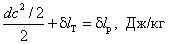
Q = U + (PV ) + т с 2 /2 + mg h + L T , Дж.
Как уже отмечалось, в термодинамике и в том числе в авиации гравитационная составляющая потенциальной энергии системы не рассматривается в одном случае из-за того, что ее изменение в процессах мало, а в другом (как в авиации) — теплота при наборе высоты тратится пропорционально режиму работы двигателя, а при спуске расход топлива, а следовательно, и теплоты уменьшается (происходит компенсация первоначальных затрат энергии). Для 1 кг рабочего тела при сделанном допущении предыдущее уравнение имеет вид:
q = и + (Р v ) + с 2 /2 + l T , Дж/кг,
ав дифференциальной форме —
дq = du + d (Pv ) + dc 2 /2 + δl T , Дж/кг. (6.13)
Итак, в открытых системах в преобразовании энергии принимает участие, помимо внутренней энергии du , кинетическая энергия потока вещества d c 2 /2, потенциальная энергия давления d (Pv ) и техническая работа δl T , затрачиваемая на вращение ротора турбины или коленчатого вала.
Сумму элементарных значений d c 2 /2 и l T , называют располагаемой работой
а сумму элементарных величин потенциальной энергии давления и располагаемой работы
— физической работой, то есть работой изменения объема:
d (Pv ) + δl p = δl ф , Дж/кг
Из курса физики средней школы известно, что бесконечно малое количество физической работы δl ф = Pdv . Тогда элементарная располагаемая работа будет равна
l р = δl ф – d (Pv ) = –vdP , Дж/кг.
С учетом изложенного уравнения первого закона термодинамики в дифференциальной форме соответственно для закрытых и открытых термодинамических систем будут иметь вид:
δq = du + δl ф = du + Pdv , Дж/кг (6.14)
δq = dh + δl р = dh – vdP , Дж/кг. (6.15)
Аналитические выражения (6.14) и (6.15) первого закона термодинамики адекватны, поскольку деление термодинамических систем на открытые и закрытые условно и отражает отдельные ограничения при рассмотрении систем.
Следует напомнить еще одну из формулировок первого закона — вечный двигатель первого рода невозможен. Вечный двигатель первого рода — это такой воображаемый механизм, который при наличии первоначального энергетического импульса способен безостановочно двигать сам себя и, кроме того, производить полезную работу.
Рабочая диаграмма Pv. Работа — функция процесса
Состояние рабочего тела однозначно определяется заданием каких-нибудь двух параметров состояния, например Р и v . Поэтому в координатной системе Pv каждой точке соответствует некоторое равновесное состояние, и каждому равновесному состоянию рабочего тела отвечает одна определенная точка на плоскости Pv . Всякая кривая, проведенная на плоскости Pv , изображает термодинамический процесс. Температуру рабочего тела на этой диаграмме непосредственно определить нельзя. Она может быть вычислена по значению Риге помощью уравнения состояния. Поскольку каждая точка кривой процесса однозначно характеризует равновесное состояние рабочего тела, то на диаграмме состояний, каковой является диаграмма Pv , может быть изображен только равновесный процесс.
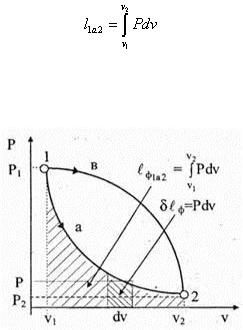
На рис. 6.3 показан процесс расширения 1а 2 (dv > 0). Начальное состояние Р 1 v 1 характеризуется точкой 1, а конечное состояние Р 2 v 2 — точкой 2. Заштрихованная на чертеже элементарная площадка l ф = Pdv графи чески изображает элементарную удельную работу изменения объема. Тогда удельная физическая работа процесса 1а 2
может быть представлена как площадь, ограниченная линией процесса, двумя крайними ординатами и осью абсцисс, то есть площадью 1a 2v 2 v 1 1.
Рис. 6.3
Из рис. 6.3 видно, что при изменении состояния рабочего тела в заданных пределах, но по другому закону, кривая 1в 2, удельная работа l ф1в 2 , изображается уже иной площадью и имеет, следовательно, иное значение, в данном случае большее, то есть площадью 1в 2v 2 v 1 1. Таким образом, физическая работа зависит от характера процесса и является, следовательно, функцией процесса. Это свойство работы имеет принципиально важное значение. Процесс, обратный, например, 2а 1 (рис.6.3), будет представлять собой процесс сжатия, и удельная работа процесса, изображаемая тон же штрихованной площадью 2а 1v 2 v 1 2, будет иметь отрицательный знак. При этом происходит подвод энергии к рабочему телу извне.
На рис. 6.4 изображен процесс изменения состояния рабочего тела 1а 2 для открытой системы (потока) на диаграмме Pv . Пусть при удельном объеме v происходит бесконечно малое изменение состояния рабочего тела, при котором давление изменяется на dP . Элементарная площадка, заштрихованная на диаграмме, графически изображает

элементарную удельную работу открытой системы в соответствии с выражением l р = –
vdP . Удельная работа всего процесса — изображается площадью 1а 2Р 2 Р 1 1.
В случае перехода системы из состояния 1 в 2 по кривой 1в 2 располагаемая работа будет больше на величину площади 1в 2а 1, чем в процессе 1а 2. Следовательно, располагаемая работа является также функцией термодинамического процесса.
Рис. 6.4
Как видно из рис. 6.4, удельная располагаемая работа открытой системы складывается из удельной физической работы l ф в процессе расширения рабочего тела в закрытой системе, определяемой площадью 1a 2v 2 v 1 1, и разности удельных потенциальных энергий рабочего тела при вталкивании P 1 v 1 = пл.0P 1 1v 1 0 и при выталкивании P 2 v 2 = пл.0P 2 2v 2 0.
Массовая, объемная и мольная, средняя и истинная теплоемкости
Теплоемкостью называется количество теплоты, необходимое для повышения температуры тела на один кельвин. В зависимости от того, к какой количественной единице вещества подводится теплота, рассматривается массовая, мольная и объемная теплоемкость. Массовая теплоемкость — это количество теплоты, необходимое для повышения температуры 1 кг тела на 1 кельвин, иначе говоря, это теплоемкость, отнесенная к 1 кг вещества — с , Дж/(кг-К). Соответственно мольная теплоемкость — теплоемкость, отнесенная к одному молю — μс (с μ). Дж/(моль·К), а объемная — к 1 м3 тела — с ', Дж/(м3 ·К). Ввиду того, что в 1 м3 при различных значениях давления и температуры содержится различное количество вещества, объемную теплоемкость относят к такому количеству вещества, которое содержится в 1 м3 при нормальных условиях.
Соотношение между массовой, объемной и мольной теплоемкостями следующее:

Количество теплоты, подводимое к веществу с целью изменения его температуры на 1 К, зависит от характера термодинамического процесса. Поэтому значения теплоемкости в различных процессах различны, то есть теплоемкость является функцией термодинамического процесса, как и теплота.
Пусть в некотором процессе 12, общей характеристикой которого является постоянство некоторого параметра п , к 1 кг вещества, имеющего параметры Р , v , T , подводится теплота в количестве q 12 , в результате чего температура тела повышается на
T = Т 2 – Т 1 , следовательно, теплоемкость этого тела равна
и называется средней (m — индекс усреднения), в данном случае, массовой теплоемкостью. Средняя теплоемкость относится к определенному интервалу температур
(Т 1 …Т 2 ) и обозначается так: 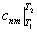 . Таким образом, средняя теплоемкость в интервале температур T подменяет собой функцию с = f (T ) (рис. 6.5) при условии, что площадь 12Т 2 Т 1 1 равна площади 34Т 2 Т 1 3. С помощью с nm можно рассчитать изменение функций состояния идеального газа и количество теплоты, участвующей в термодинамическом процессе.
. Таким образом, средняя теплоемкость в интервале температур T подменяет собой функцию с = f (T ) (рис. 6.5) при условии, что площадь 12Т 2 Т 1 1 равна площади 34Т 2 Т 1 3. С помощью с nm можно рассчитать изменение функций состояния идеального газа и количество теплоты, участвующей в термодинамическом процессе.
Рис. 6.5
Представим теперь, что подводимая теплота и соответственно изменение температуры непрерывно уменьшается, стремясь к нулю. Тогда
и представляет собой теплоемкость тела при данной температуре и называется истинной, реже — мгновенной массовой теплоемкостью. Из (6.17) следует: q = cn dT или для конечного процесса 12
Из (6.16) то же количество теплоты можно рассчитать через среднюю теплоемкость
q 12 = сп m (T 2 – T 1 ). (6.19)

Из сопоставления (6.18) и (6.19) следует равенство |
и формула |
для вычисления средней массовой теплоемкости по истинной |
|
Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
Итак, теплоемкость зависит от характера термодинамического процесса, при котором подводится или отводится теплота. При экспериментальном определении теплоемкости обычно используют два термодинамических процесса, протекающих при постоянном объеме — изохорная теплоемкость с v , и давлении — изобарная теплоемкость с p . Для выяснения математической формы теплоемкостей с v и с p необходимо, используя выражения (6.4) и (6.6) полных дифференциалов для внутренней энергии и энтальпии соответственно в переменных (v , Т ) и (Р , Т ), записать уравнения первого закона термодинамики в следующем виде:
Изохорная теплоемкость
Из (6.27) при dv = 0 (v = const ) следует δqv = (д u /д T )v dT и теплоемкость реального газа при постоянном объеме
Это соотношение может рассматриваться как определение изохорной теплоемкости с v , Оно показывает, что теплоемкость с v характеризует темп изменения внутренней энергии в изохорном процессе с изменением температуры. Таким образом, теплоемкость с V реального газа есть функция Т и v .
Кроме того, из равенства (6.23) следует, что подведенная при постоянном объеме теплота, когда δl a = 0, расходуется только на изменение внутренней энергии
δqv = duv = cv dT .
А изменение внутренней энергии идеального газа равно произведению теплоемкости при постоянном объеме на разность температур в любом процессе. Действительно, для идеального газа, внутренняя энергия которого является функцией только температуры, частная производная (ди /д v )T равна нулю — закон Джоуля. Тогда du = (д u /д T )V dT или
du = cdT , Дж/кг (6.24)
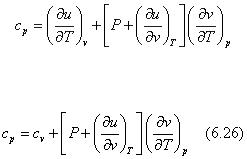
независимо от характера процесса. А теплоемкость идеального газа в изохорном процессе равна
сv = du /dT , Дж/(кг·К) (6.25)
иявляется функцией только температуры.
Изобарная теплоемкость
Теплоемкость реального газа при постоянном давлении получается аналитически из уравнения (6.21) в более сложном виде по сравнению с теплоемкостью cv , а именно:
или
Так как для идеального газа согласно закону Джоуля (ди /д v )т = 0, то изобарная
теплоемкость идеального газа из (6.26) равна |
|
ср = cv + P (dv /uT )p . |
(6.27) |
Из уравнения (6.22) при Р = const (dP = 0) |
следует qp = (д h /д T )p dT и, |
следовательно, теплоемкость при постоянном давлении для реального газа с p = (д h /dT )p , то есть теплоемкость с равна частной производной от энтальпии по температуре и является функцией Р и Т . Другими словами, изобарная теплоемкость характеризует темп изменения энтальпии при повышении температуры. Поскольку энтальпия идеального газа не зависит от давления и объема и является функцией только температуры (закон Джоуля), нетрудно показать, что теплоемкость с p идеального газа для любого термодинамического процесса будет равна
с v = dh /dT , Дж/(кг·К). (6.28)
Отсюда изменение энтальпии идеального газа в бесконечно малом процессе
dh = с p dT . (6.29)
Уравнение Майера для идеального газа
Соотношение (6.26) устанавливает в общем виде связь между теплоемкостями ср и cv реального газа. Для идеального газа эта связь описывается выражением (6.27). С учетом того, что из уравнения состояния Pv = RT при R = const и Р = const (dv /дТ )р = R /P , получим
ср = с v + R . (6.30)
Это уравнение носит название уравнения Р. Майера. Оно может быть записано и для 1 моля
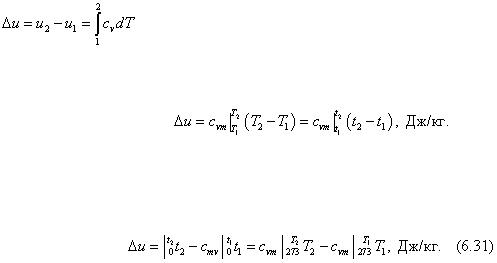
μср = μ с v + μR , Дж/(моль · К)
или
μср – μ с v = 8,314, Дж/(моль · К)
Следовательно, для идеальных газов разность между μср и μ с v есть величина постоянная и равная универсальной газовой постоянной. Таким образом, при постоянном давлении некоторое количество теплоты идет также на совершение работы. Поэтому для изменения температуры рабочего тела на 1 К при Р = const требуется большее количество теплоты, чем при v = const , и, следовательно, с p > с v .
Подведем итоги изложенному. 1. Теплоемкость идеального газа является функцией только температуры; 2. Теплоемкость реального газа зависит еще и от давления. Это значит, что количество теплоты, необходимое для нагревания газа на 1 К с одного и того же уровня температурной шкалы, зависит от давления, при котором находится газ, то есть
с n = f (T , P ).
Расчет изменения внутренней энергии и энтальпии идеального газа
Ранее было установлено, что внутренняя энергия и энтальпия являются функциями состояния рабочего тела и их изменение не зависит от характера термодинамического процесса, а полностью определяется начальными и конечными значениями параметров состояния. В термодинамике используется не абсолютное значение внутренней энергии, а ее изменение в процессе 12, которое следует из (6.24) для идеального газа
,Дж/кг. Можно избежать интегрирования при переменной
теплоемкости, в данном случае cv , если ввести некоторое постоянное значение теплоемкости, то есть теплоемкость среднюю в интервале температур Т 1 …Т 2 . Тогда
Множество различных интервалов температур не позволяет иметь соответствующие аналитические и табличные значения с vm . Поэтому, вводя изохорные теплоемкости средние в интервале температур 0 … t в предыдущее уравнение, получим
В тех случаях, когда изохорная теплоемкость не зависит от температуры, изменение внутренней энергии равно
и = с V (T 2 – T 1 ), Дж/кг. (6.32)
Таким образом, изменение внутренней энергии идеального газа в любом термодинамическом процессе равно произведению изохорной теплоемкости на разность температур.
Формула для расчета изменения энтальпии идеального газа в конечном процессе 12 следует из (6.29)

При с p = var
При с p = const
h = cp (T 2 – T 1 ) (6.33)
Изменение энтальпии идеального газа в любом термодинамическом процессе равно произведению изобарной теплоемкости на разность температур. Очевидно, что изменение внутренней энергии и энтальпии идеального газа зависит только от температуры и однозначно связано с ней.
Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
На основании опытных данных установлено, что зависимость истинной теплоемкости реальных газов от температуры является криволинейной, как показано на рис. 6.6, и может быть выражена степенным рядом
ca = a + bt + dt 2 + et 3 + ..., (6.34)
где a , b , d ,... постоянные коэффициенты, численные значения которых зависят от рода газа и характера протекания процесса. В тепловых расчетах часто заменяют нелинейную зависимость теплоемкости от температуры линейной.
Рис. 6.6
В этом случае истинная теплоемкость определяется из уравнения
cn = a + bt , (6.35)
где t — температура, ºС; b = dc /dt — угловой коэффициент наклона прямой с = а + bt .
Исходя из (6.20), найдем формулу средней теплоемкости при ее линейном изменении от температуры согласно (6.35)

В случае, если процесс изменения температуры протекает в интервале 0- t , то (6.36) принимает вид
Теплоемкость 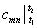 называют теплоемкостью средней в интервале температур t 1 – t
называют теплоемкостью средней в интервале температур t 1 – t
2 (T 1 – T 2 ), а теплоемкость 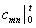 — теплоемкостью средней в интервале 0–t . Результаты расчетов истинной и средней в интервале температур 0–t массовой или мольной теплоемкостей при постоянном объеме и давлении соответственно по уравнениям (6.34) и (6.37) приведены в справочной литературе.
— теплоемкостью средней в интервале 0–t . Результаты расчетов истинной и средней в интервале температур 0–t массовой или мольной теплоемкостей при постоянном объеме и давлении соответственно по уравнениям (6.34) и (6.37) приведены в справочной литературе.
Основной тепло- и хладотехнической задачей является определение теплоты, участвующей в процессе. В соответствии с соотношением q = cn dT и при нелинейной зависимости истинной теплоемкости от температуры количество теплоты определяется заштрихованной элементарной площадкой на диаграмме с координатами сп Т (рис. 6.6). При изменении температуры от Т1 до Т„ в произвольном конечном процессе количество подводимой или отводимой теплоты определяется, согласно (6.38), следующим образом:
и определяется на той же диаграмме (рис. 6.6) площадью 12T 2 T 1 1. Подставив в (6.38) значение с n = f (T ) для данного газа по соотношению (6.34) и произведя интегрирование, получим расчетную формулу для определения теплоты в заданном интервале изменения температуры газа, которая, впрочем, следует из (6.16):
Однако, поскольку в справочной литературе есть только средняя теплоемкость в интервале температур 0–t , то количество теплоты в процессе 12 можно определить не
только по предыдущей формуле, но и так: 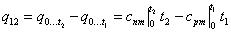 . Очевидно соотношение между теплоемкостями средними в интервалах температур Т 1 –Т 2 и 0– t :
. Очевидно соотношение между теплоемкостями средними в интервалах температур Т 1 –Т 2 и 0– t :
Количество теплоты, подводимое (отводимое) к m кг рабочего тела,

Количество теплоты, подводимое к V м3 газа, определяется формулой
Количество теплоты, подводимое (отводимое) к n молям рабочего тела, равно
Молекулярно-кинетическая теория теплоемкости
Молекулярно-кинетическая теория теплоемкости является весьма приближенной, так как не рассматривает колебательной и потенциальной составляющих внутренней энергии. Поэтому, согласно этой теории, задача состоит в определении распределения подводимой к веществу тепловой энергии между поступательной и вращательной формами внутренней кинетической энергии. Согласно распределению МаксвеллаБольцмана, если системе очень большого числа микрочастиц сообщить некоторое количество энергии, то она распределяется между поступательным и вращательным движением микрочастиц пропорционально их числу степеней свободы. Число степеней свободы молекулы газа соответствует числу координат, определяющих ее положение в пространстве.
Молекула одноатомного газа имеет три степени свободы, так как ее положение в пространстве определяется тремя координатами, причем для одноатомного газа эти три степени свободы являются степенями свободы поступательного движения.
Для двухатомного газа значения трех координат одного атома еще не определяют положение молекулы в пространстве, так как после определения положения одного атома необходимо учитывать, что второй атом имеет возможность вращательного движения. Для определения положения в пространстве второго атома необходимо знать две его координаты (рис. 6.7), а третья же определится из известного в аналитической геометрии уравнения
где l — расстояние между атомами. Таким образом, при известном l из шести координат необходимо знать только пять. Следовательно, молекула двухатомного газа имеет пять степеней свободы, из которых три — поступательного и две — вращательного движения.
Рис. 6.7
