
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf
Молекула трехатомного газа имеет шесть степеней свободы — три поступательного и три вращательного движения. Это следует из того, что для определения положения в пространстве необходимо знать шесть координат атомов, а именно: три координаты первого атома, две координаты второго атома и одну координату третьего. Тогда положение атомов в пространстве будет полностью определено, так как расстояния между ними l 1 , l 2 и l 3 — заданы.
Если взять газ большей атомности, то есть 4-атомный и более, то число степеней свободы такого газа будет равно также шести, так как положение четвертого и каждого следующего атома будет определяться фиксированным расстоянием его от других атомов.
Согласно молекулярно-кинетнческой теории вещества, средняя кинетическая энергия поступательного и вращательного движений каждой из молекул пропорциональна
температуре и равна соответственно  и
и  (Δвр — число степеней свободы вращательного движения). Поэтому кинетическая энергия поступательного и вращательного движений всех молекул будет линейной функцией температуры
(Δвр — число степеней свободы вращательного движения). Поэтому кинетическая энергия поступательного и вращательного движений всех молекул будет линейной функцией температуры
Уравнения (6.39) и (6.40) выражают упомянутый закон равнораспределения энергии по степеням свободы, согласно которому на каждую степень свободы поступательного и вращательного движений молекул приходится одна и та же средняя кинетическая энергия, равная 1/2 (kT ).
Энергия колебательного движения молекул представляет собой сложную возрастающую функцию температуры и только в отдельных случаях при высоких температурах может быть приближенно выражена формулой, аналогичной (6.40). Молекулярно-кинетическая теория теплоемкости не учитывает колебательного движения молекул.
Между двумя молекулами реального газа притяжения. Для идеального газа потенциальная отсутствует. С учетом изложенного внутренняя
действуют силы отталкивания и энергия взаимодействия молекул энергия идеального газа равна
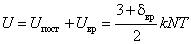 , Дж. Так как N = νnNA , то
, Дж. Так как N = νnNA , то 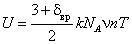 , Дж. Внутренняя энергия одного моля идеального газа при условии, что универсальная газовая
, Дж. Внутренняя энергия одного моля идеального газа при условии, что универсальная газовая
постоянная определяется произведением двух констант: μR = kNA , определяется
следующим образом: 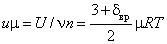 , Дж/моль. Продифференцировав по Т и зная, что du μ/dT = μcv , получим мольную теплоемкость идеального газа при постоянном объеме
, Дж/моль. Продифференцировав по Т и зная, что du μ/dT = μcv , получим мольную теплоемкость идеального газа при постоянном объеме
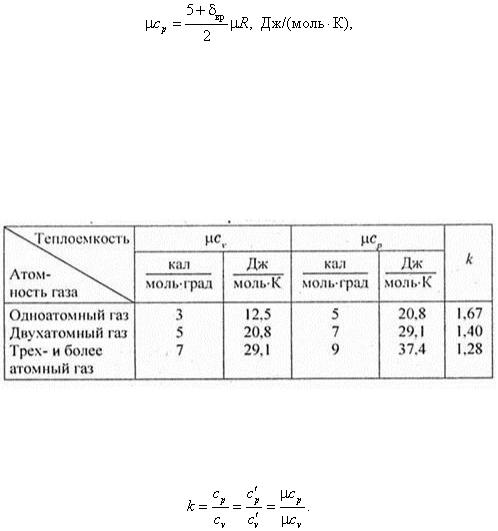
Из уравнения Майера μс p = μс v + μR получим выражение для мольной теплоемкости идеального газа при постоянном давлении
Для приближенных расчетов при не очень высоких температурах, когда энергию колебательного движения атомов в молекулах вследствие ее малости можно не учитывать, допускаются к использованию полученные мольные теплоемкости μс v и μс p как функции атомности газов. Значения теплоемкостей представлены в табл. 6.1.
Таблица 6 .1
Значения теплоемкостей по молекулярно-кинетической теории газов
В термодинамических уравнениях часто встречается отношение изобарной теплоемкости к изохорной, называемое коэффициентом Пуассона или показателем адиабаты
Для идеального газа показатель адиабаты является величиной, зависящей только от атомного строения молекул газа, что и отражено в табл. 6.1. Символическое значение показателя адиабаты можно получить из уравнения Майера ср – cv = R путем следующих преобразований: kcv – cv = R , cv (k – 1) = R , откуда k = 1 + R /cv . Из предыдущего равенства следует выражение изохорной теплоемкости через показатель адиабаты cv = R /(k – 1) и затем изобарной теплоемкости: ср = kR /(k – 1).
Обратимые и необратимые термодинамические процессы
Можно рассмотреть ряд процессов, протекание которых естественным (самопроизвольным) путем возможно только в одном направлении, хотя возможность протекания их в обратном направлении не противоречит первому закону термодинамики. Например:
1. Теплообмен между двумя телами при Т 1 > Т 2 , (рис. 6.8). Теплота переходит самопроизвольно от горячего тела к холодному. Энергия при этом не исчезает, но самопроизвольный обратный процесс невозможен. Это значит, что горячая печка может греть холодный чайник, но холодный чайник греть горячую печку не может.
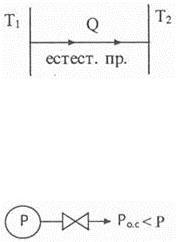
Рис. 6.8
2. Расширение газа в окружающую среду с меньшим давлением Р > Р о.с. (рис 6.9). Обратный процесс самопроизвольно осуществлен быть не может. При наличии компрессора — да. Но это будет уже процесс с дополнительной затратой энергии.
Рис. 6.9
3.Диффузия газов при одинаковом давлении. Газы смешиваются самопроизвольно, суммарная внутренняя энергия при этом не меняется. Разделение газов самопроизвольно невозможно.
4.Сопротивление трения. При трении работа самопроизвольно превращается в теплоту. Обратный процесс невозможен.
Во всех случаях процессы «идут» в сторону меньшего потенциала воздействия. Обратный путь возможен только при дополнительной затрате энергии. Такой процесс, который может самопроизвольно протекать только в одном направлении, называют необратимым процессом. Обратимым процессом называют такой процесс, который способен происходить как в прямом, так и в обратном направлении, причем при возвращении в первоначальное состояние (при изменении внешних условий в противоположной последовательности) система проходит все равновесные состояния прямого процесса, но в обратном порядке и за счет только энергетического эффекта, полученного в прямом процессе. В изолированной термодинамической системе обратимые процессы можно осуществить при выполнении следующих условий:
1.Термодинамическая система должна находиться в состоянии механического и теплового равновесия, то есть давление и температура рабочего тела в каждом состоянии прямого и обратного процессов должны быть неизменными. Это возможно только при бесконечно медленном протекании процесса, то есть процессы, протекающие в системе, должны быть равновесными.
2.Прямой и обратный процессы должны осуществляться без трения. При наличии трения часть энергии рабочего тела расходуется на работу трения, которая преобразуется
втеплоту и рассеивается в трущихся элементах. Таким образом, теплота, полученная газом от внешней системы (теплоотдатчика) в прямом процессе расширения, не может быть полностью возвращена ему в обратном процессе сжатия, что не позволит рабочему телу вернуться в исходное состояние.
3.В процессе теплообмена должно соблюдаться равенство температур теплоотдатчика и рабочего тела в продолжение всего процесса.
4.При осуществлении прямого и обратного процессов рабочее тело не должно подвергаться химическим изменениям.
При несоблюдении этих условий процессы будут необратимы. Все действительные процессы, протекающие в тепловых двигателях и вообще в природе, являются необратимыми, так как они неравновесны, сопровождаются трением, химическими превращениями и тепловыми потерями. Всякий необратимый процесс сопровождается потерей работоспособности рабочего тела, обесцениванием энергии для потребителя, ее деградацией. При трении, например, механическая работа превращается в малоценную теплоту трения, низкопотенциальную внутреннюю энергию. Однако, с целью упрощения исследования термодинамических процессов реальные процессы считаются обратимыми. Другими словами, в термодинамике в дальнейшем будут рассматриваться только такие процессы, в которых разность потенциалов равна нулю. Такую термодинамику называют равновесной.
Рассмотрим реальную макросистему, состоящую из механических, электромагнитных, химических и других элементов, обладающих, что вполне естественно для реальных систем, трением, электрическим сопротивлением, теплопроводностью. В каждом звене такой системы различные формы движения материи превращаются в тепловую. А это превращение принципиально отличается от остальных тем, что оно никогда не может быть полностью обратимым. По этой причине движение в каждом из элементов системы будет затухать и тем быстрее, чем больше трение. Таким образом, трение, генерирующее в системе тепловое движение, делает процесс необратимым. Именно в этой необратимости и состоит фундаментальное различие между воображаемым и идеальным миром, к которому так стремятся в технике, стараясь повысить КПД любого технического устройства, и в котором все процессы полностью обратимы и вечны, и реальным, в котором все процессы в большей или меньшей степени необратимы и поэтому рано или поздно затухают.
Так что же представляет собой обратимый мир, в котором отсутствуют потери энергии в любом из процессов? И хорошо это или плохо, что нет энергетических потерь? Плохо. Значит, терять — это хорошо? Получается так, но при этом нужно стремиться к минимуму потерь. А плохо потому, что в обратимом мире требование обратимости налагает запрет на любое потребление энергии. А значит это то, что за прямым процессом последует обратный, который нейтрализует результат, достигнутый в прямом процессе. Первичный порядок вещей станет невозможным в обратимом мире: ткани, канаты, бумага расползутся на отдельные волокна; гвозди и шурупы повыскакивают из стен, раскрутятся все винты и гайки и все остальное, что держится силой трения.
Иэто не все. В необратимом мире кажется естественным то, что для движения автомобилей, кораблей, самолетов необходима непрерывная работа их двигателей, непрерывное действие на них движущей силы колес, винтов, реактивных струй. В обратимом мире нет трения, а воздух, как и все другие газы и жидкости, утратил бы свою вязкость и стал бы сверхтекучим. Поэтому самолеты не испытывали бы в полете лобового сопротивления (зато возникла бы проблема создания подъемной силы крыла). И, следовательно, в обратимом мире двигатели не нужны. Все перевозки и поездки будут производиться катапультами. Остановить транспорт с помощью тормозов будет невозможно. Нужны ловушки.
Иеще кое о чем. Сверхтекучая вода рек, ускоряясь, мчалась бы в океан, порождая течения, волны и шторм. Обратимый мир оказался бы настоящей копилкой всех звуков. Только это сделало бы жизнь невозможной. А проводники превратились бы в сверхпроводники, электрические и тепловые. И в связи с этим одежда и жилище утратят свое основное назначение — защищать человека от холода и жары. И возможно, такая
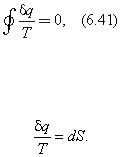
необходимость будет отсутствовать, так как температура, с которой младенец появляется на свет, в обратимом мире сохранилась бы на всю жизнь.
От катастрофического обратимого мира нас избавляет необратимость, порожденная трением, как процессом непосредственного превращения различных форм движения материи в тепловое движение. Всякий необратимый процесс должен быть тепловым. И действительно, энергия, вырабатываемая электростанциями земного шара, превращается в теплоту на фабриках, заводах, шахтах. Цена такого превращения — получение металла, деталей из него, бумаги, тканей и т. д.
Второй закон термодинамики
Первый закон термодинамики, являясь общим законом сохранения и превращения энергии, представленный в форме, удобной для термодинамического анализа, утверждает, что теплота может превращаться в работу, а работа — в теплоту, не устанавливая условий, при которых возможны эти превращения. Кроме того, первый закон не рассматривает вопроса о возможном направлении протекания процесса, а не зная этого, нельзя предсказать его особенности и результаты.
Условия, необходимые для осуществления какого-либо преобразования, устанавливает второй закон термодинамики. Он имеет частный характер, связанный со свойствами тепловой энергии. И второе, закон справедлив только для макропроцессов. Второй закон термодинамики не может быть выведен из каких-либо теоретических положений, а, как и первый, представляет собой результат обобщения установленных из опыта фактов. Существует несколько эквивалентных формулировок второго закона термодинамики. Первая и наиболее общая принадлежит Р. Клаузиусу и утверждает следующее: «Теплота не может сама собой переходить от тела с более низкой температурой к телу с более высокой температурой, или — процесс теплообмена необратим». Эта формулировка позволила доказать Р. Клаузиусу теорему, носящую его имя: «Для любого обратимого процесса интеграл от приведенной теплоты δq /T , взятый по замкнутому контуру, равен нулю»
Равенство интеграла Р. Клаузиуса нулю указывает на существование некоторой функции состояния, которая была названа Р. Клаузиусом — энтропией, то есть
Уравнение (6.41) называют первым интегралом Клаузиуса. Уравнение (6.42) считают математическим выражением второго закона термодинамики для обратимых процессов.
Чтобы разобраться с теоремой Р. Клаузиуса, рассмотрим схему процесса обратимого преобразования теплоты в работу (рис. 6.10). Для этого необходимо установить связь количеств теплоты q 1 и q 2 и температур T 1 и Т 2 .

Рис. 6.10
По первому закону термодинамики q 2 = q 1 – l . Используя понятие термического коэффициента полезного действия ηt = (q 1 – q 2 )/q 1 = (Т 1 – Т 2 )/Т 1 для цикла Карно и заменив работу l на ее значение l = q 1 – q 2 = ηt q 1 , предыдущее уравнение можно переписать в виде: q 2 = q 1 – q 1 (T 1 – Т 2 )/Т 1 . После упрощений получим q 1 /T 1 = q 2 /T 2
. Получается, что отношения количеств теплоты к соответствующим температурам на входе теплового потока в двигатель и на выходе из него равны. Это следует понимать как факт наличия тепловой характеристики, названной энтропией
(q /T ) = s , Дж/(кг·К),
сохраняющей для двигателя постоянное значение в процессах ее подвода и отвода. На рис. 6.10 показано, что отношения q /T остаются одинаковыми и на входе теплоты, и на выходе. Это свойство величины q /T и обратило на себя внимание Р. Клаузиуса. Он первым придал величине q /T самостоятельное значение и назвал ее энтропией.
Возвратимся к теореме и интегралу Клаузиуса. Преобразуем q 1 /T 1 = q 2 /T 2 к виду q 1 /T 1 – q 2 /T 2 = 0, так как q 2 , согласно принятому правилу знаков для теплоты, является отрицательной величиной, го получим q 1 /T 1 + q 2 /T 2 = 0 или s 1 + s 2 = 0. Для любого обратимого процесса по замкнутому контуру интеграл от приведенной теплоты и
составляет понятие интеграла Клаузиуса  δq /T =
δq /T =  ds = 0. Соотношением s = q /T можно пользоваться тогда, когда все количество теплоты q отдается при одной и той же температуре Т . Реально температура при подводе теплоты (кроме процессов, сопровождающихся фазовым переходом) повышается, а при отводе понижается. Для каждой малой «порции» теплоты δs температура будет уже другой. Поэтому энтропию следует подсчитывать для каждой «порции» теплоты отдельно в виде ds = δq /T , а затем суммировать «порции» энтропии ds . В целом изменение энтропии s в конечном процессе 12 будет равно сумме
ds = 0. Соотношением s = q /T можно пользоваться тогда, когда все количество теплоты q отдается при одной и той же температуре Т . Реально температура при подводе теплоты (кроме процессов, сопровождающихся фазовым переходом) повышается, а при отводе понижается. Для каждой малой «порции» теплоты δs температура будет уже другой. Поэтому энтропию следует подсчитывать для каждой «порции» теплоты отдельно в виде ds = δq /T , а затем суммировать «порции» энтропии ds . В целом изменение энтропии s в конечном процессе 12 будет равно сумме
s = ∑ds = edq /T или
Из соотношения ds = δq /T следует, что поток теплоты можно представить как произведение температуры Т , при которой она передается, на поток энтропии
δq = Tds , (6.43)
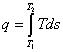
а в конечном процессе |
. |
Второй закон термодинамики устанавливает направление тепловых процессов и утверждает, что самопроизвольный переход теплоты от холодных тел к нагретым невозможен (холодный чайник греть горячую печку не может). Для этого необходимы дополнительные компенсирующие процессы, например подвод механической энергии, осуществляемый в холодильных установках. Если бы самопроизвольный переход теплоты от холодных тел к горячим был возможен, то в равновесной изолированной системе можно было бы без внешнего воздействия получить два источника теплоты с различной температурой. Итак, естественные процессы протекают от большего потенциала к меньшему, поэтому процесс теплообмена необратим.
Одновременно с Р. Клаузиусом в 1851 г. В. Томсон предложил другую формулировку второго закона термодинамики: «Не вся теплота, полученная в тепловом двигателе от теплоотдатчика, может перейти в работу, а только некоторая ее часть. Часть теплоты должна перейти в теплоприемник». Следовательно, для получения работы необходимо иметь источник теплоты с высокой температурой и приемник теплоты с низкой температурой.
Следующая формулировка второго закона, являющаяся следствием формулировки В. Томсона, высказана В. Оствальдом: «Осуществление вечного двигателя второго рода невозможно». Под вечным двигателем второго рода подразумевается такой двигатель, который способен полностью превращать в работу всю теплоту, полученную от одного источника. Если бы можно было осуществить тепловую машину, работающую на одном источнике теплоты, то в качестве таких источников могли бы служить окружающая среда, мировой океан, запасы внутренней энергии которых безграничны. Такой двигатель был бы вечным и не противоречащим первому закону. Противоположный механизм, антипод вечного двигателя второго рода, возможен. Это, например, тормозной механизм, наждак, в которых работа полностью превращается в малоценную теплоту трения, что является для них полезным.
Существуют и другие формулировки второго закона термодинамики, например формулировка Л. Больцмана: «Природа стремится от состояний менее вероятных к состояниям более вероятным, или — естественные процессы развиваются необратимо в направлении увеличения беспорядка». Сказанное следует понимать как то, что беспорядок всегда вероятнее, чем относительный порядок. Здесь Л. Больцман отождествляет беспорядок с понятием энтропии и обосновывает тот факт, что любая форма упорядоченного движения, каким является механическое движение газа в целом, стремится перейти в неупорядоченное хаотическое внутримолекулярное движение самостоятельно, то есть работа в теплоту переходит без затруднения. В то же время, перевод теплоты в работу требует дополнительных затрат, добавочного компенсирующего процесса или просто компенсации, как говорил Р. Клаузиус. Формулировка Л. Больцмана, с учетом изложенного может быть интерпретирована и так: «Какие бы изменения ни происходили в реальных изолированных системах, они всегда ведут к увеличению энтропии». Формулировка Л. Больцмана самая широкая и содержательная.
Энтропия
Итак, понятие энтропии введено Р. Клаузиусом в 1865 г. С помощью энтропии решаются многие важные теоретические, практические проблемы и не только термодинамические. И вместе с тем, трудно найти другое научное понятие, вокруг которого кипело бы столько страстей и которое вызвало бы столько кривотолков, ошибок и нападок. Последнее обусловлено чрезвычайной широтой участия энтропии в различных технических, биологических, астрофизических и других процессах. Попытаемся здесь и в следующем параграфе разобраться в многоликости этого понятия.
Ранее отмечалось, что термическое состояние рабочего тела характеризуется рядом параметров и функций состояния: Р , v , Т , и , h , s и др. В равновесном состоянии эти величины имеют одинаковые значения по всей массе тела и представляют собой, в сущности, некоторые средние значения результатов поведения громадного числа молекул, составляющих выбранную массу вещества.
В термодинамике применяются такие методы исследования и расчетов, при которых рабочие тела рассматриваются как нечто целое, отвлеченно от их атомно-молекулярной структуры. С такой точки зрения, полученная Р. Клаузиусом функция состояния — энтропия, имеет физический смысл в том, что это специфическая величина, характеризующая только тепловое взаимодействие системы со средой и что она меняется только в этом случае. Любая другая величина может изменяться при этом, но только изменение энтропии указывает на наличие теплового воздействия {подвод или отвод теплоты). Этот вывод следует из формулы (6.58). Действительно, поскольку абсолютная температура всегда больше нуля, то подвод или отвод теплоты зависит от знака ds , то есть при подводе теплоты энтропия всегда увеличивается: δq > 0, ds > 0, при отводе — уменьшается: δq < 0, ds < 0. Если энтропия не меняется (s = const , ds = 0), то теплообмена системы с окружающей средой нет, δq = 0. Изменение энтропии, равное нулю, указывает на отсутствие передачи энергии рабочему телу в форме теплоты. Каким же образом тогда работает тепловой двигатель, представленный на рис. 6.10. Ведь в нем теплота подводится и отводится, а энтропия постоянна — q 1 /Т 1 – q 2 /T 2 , s 1 = s 2 . Это противоречие легко объяснить следующим образом. Да, внешние потоки энтропии одинаковы, но внутри двигателя циркулирующее рабочее тело периодически нагревается и охлаждается. При подводе теплоты в идеальном двигателе рабочее тело нагревается и энтропия его растет, при отводе теплоты рабочее тело охлаждается и энтропия его уменьшается до первоначального значения. Заметим, что идеальные тепловые двигатели обратимы. Это допускает двойную возможность движения теплоты от теплоотдатчика к теплоприемнику
втепловом двигателе с производством работы и от теплоприемника к теплоотдатчику в тепловом насосе (или холодильнике) с затратой работы. Следовательно, энтропия является индикатором направленности протекания термодинамических процессов.
Ивсе было бы просто, если бы свойства энтропии ограничились постоянством в обратимых процессах. И споров вокруг энтропии было бы меньше. Начало же спорам положил Р. Клаузиус более 100 лет назад. И все из-за того, что идеи С. Карно он развил на новом уровне и приложил к необратимым процессам переноса теплоты, в которых возможен только односторонний переход системы в направлении меньшего потенциала. Р. Клаузиус распространил этот вывод на любые необратимые процессы и ввел тем самым принцип возрастания энтропии: во всех реальных процессах преобразования энергии в изолированных системах суммарная энтропия всех участвующих в них тел возрастает. Другими словами, принцип, который рассматривается как второй закон термодинамики, может быть сформулирован и так: какие бы изменения ни происходили в реальных изолированных системах, они всегда ведут к увеличению энтропии системы. Следовательно, энтропия является индикатором направленности необратимых процессов
визолированной системе. При этом, чем больше рост энтропии, тем «реальнее» процесс.
Эта же мысль, высказанная в обратном направлении, будет звучать так: увеличить энтропию системы невозможно никаким иным путем, кроме подвода теплоты — либо от другой системы или окружающей среды, либо за счет внутренних необратимых процессов. Кстати, механическое сжатие и расширение, электризация, намагничивание, упругая деформация, то есть любое нетермическое воздействие не влияет на изменение энтропии.
Из изложенного следует, что второй закон термодинамики состоит из констатации двух положений: существования и постоянства энтропии в обратимых процессах и возрастания энтропии в необратимых процессах. Что же касается возможности уменьшения энтропии в изолированной системе, то второй закон ее исключает. Уменьшение энтропии невозможно в принципе, так как предполагает возможность самопроизвольного процесса в направлении большего потенциала.
Более полно раскрывается смысл энтропии, если исходить из ее статистической трактовки, то есть если рассматривать вещество как совокупность молекул, обладающих определенной массой и скоростью, и определять его термическое состояние, исходя из микроструктуры и определенных закономерностей, которым подчиняются совокупности. Термическое состояние рабочего тела в этом случае будет зависеть от координат каждой молекулы и ее скорости в соответствующий момент времени. Решение такой задачи обычными методами затруднено из-за большого числа молекул и непрерывных взаимодействий между ними. Поэтому здесь применяются способы исследования массовых явлений, так называемая статистика. Применительно к изучению термических явлений она называется статистической термодинамикой и основывается на положениях математической теории вероятности.
Л. Больцман исследовал законы поведения всего множества молекул газа, как системы, и установил, что существует непосредственная связь энтропии с тем состоянием, в котором находится система. Состояние системы в фиксированный момент времени, при котором для каждой молекулы определены положение в пространстве и скорость, называют микросостоянием. Таким образом, микросостояние системы определяется совокупностью параметров, характеризующих состояние каждой микрочастицы системы. Однако молекулы находятся в хаотическом движении и во взаимодействии друг с другом, это приводит к постоянному перераспределению энергии между молекулами, то есть к изменению микросостояний системы. Естественно, что одно и то же макросостояние может быть получено при различном расположении молекул внутри рабочего тела и их скоростях, так как средние значения этих величин по всей массе тела будут одни и те же. Иными словами, одному и тому же макросостоянию будет соответствовать большое число микросостояний или при одном и том же макросостоянии может происходить непрерывная смена микросостояний при неизменном давлении, температуре и других параметрах состояния.
Число эквивалентных микросостояний, позволяющих реализовать данное макросостояние, по предложению М. Планка, называют термодинамической вероятностью. Она равна отношению общего числа перестановок всех N частиц между собой в пределах системы, то есть N !, к числу перестановок молекул внутри каждой из энергетических групп, отличающихся распределением молекул в пространстве, по скоростям и энергиям (n 1 ! n 2 ! n 3 ! ...пп !):
W = N !/(n 1 ! n 2 ! n 3 ! ...пп !).
Так как число эквивалентных микросостояний велико, то термодинамическая вероятность значительно больше математической. Последняя, как известно, определяется отношением числа интересующих нас событий к числу всех равновозможных и не может быть больше единицы.
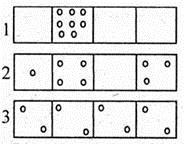
Термодинамическая вероятность наступления того или иного микросостояния зависит от величин, характеризующих молекулярное состояние. Рассмотрим систему, состоящую из восьми молекул, хаотично движущихся в изолированном объеме, мысленно разделенной на четыре части. Предположим три возможных состояния системы (рис. 6.11). Термодинамические вероятности пребывания системы в каждом из трех состояний соответственно равны:
W 1 = N !/n 1 ! = 8!/8! = 1;
W 2 = N !/(n 1 ! n 2 ! n 3 !) = 8!/(1! 4! 3!) = 280;
W 3 = N !/(n 1 ! n 2 ! n 3 ! п 4 !) = 8!/(2! 2! 2! 2!) = 2520.
Рис. 6.11
В соответствии со вторым законом термодинамики и элементарной логикой система из маловероятного состояния с W 1 самопроизвольно переходит в состояние с W 2 = 280 и далее в состояние с максимальным значением термодинамической вероятности W 3 = 2520. То есть термодинамическая вероятность изолированной системы является функцией ее состояния и стремится к максимуму, который достигается при равновесии системы.
Из рассмотренного примера следует, что в изолированной системе самопроизвольно происходят только такие процессы, которые идут от менее равновесных состояний к более равновесным. Система стремится к более равновесному состоянию, то есть равновесное состояние более вероятно. Неравновесное состояние возможно, но вероятность его мала .
Необратимые процессы, как было рассмотрено ранее, идут с возрастанием энтропии системы. Причина увеличения энтропии в необратимых процессах состоит в переходе системы от менее к более вероятным состояниям, то есть в увеличении термодинамической вероятности состояния изолированной системы. Это значит, что энтропия есть некоторая функция термодинамической вероятности состояния системы. Вид функции установлен Л. Больцманом и выражается формулой
S = k lnW + const , Дж/К,
где k — постоянная Больцмана. Энтропия изолированной системы пропорциональна натуральному логарифму термодинамической вероятности данного состояния системы, то есть энтропия — мера вероятности данного состояния. Формула Л. Больцмана объединила макровеличину — энтропию, с микровеличиной — термодинамической вероятностью данного состояния.
