
Физика_лек_pdf / Модуль 3. Молекулярная физика. Кинематика и динамика жидкостей и газов
.pdfМОЛЕКУЛЯРНАЯ ФИЗИКА. КИНЕМАТИКА И ДИНАМИКА ЖИДКОСТЕЙ И ГАЗОВ
Тема 1. Основы молекулярной физики
Предмет и метод молекулярной физики. Кинетическая теория
Молекулярная физика изучает физические свойства вещества исходя из его атомномолекулярной структуры, характера теплового движения микрочастиц и действующих между ними сил. Следовательно, предметом статистической физики являются строение, физические свойства твердых, жидких и, в основном, газообразных макротел, а также физические процессы, происходящие в них. Основой этого раздела физики является экспериментально проверенная кинетическая теория строения вещества, в которой количественные закономерности устанавливают статистическим методом, когда рассматриваются только средние значения характеристик совокупности молекул. Последнее обусловлено тем, что свойства огромного числа молекул отличаются от свойств каждой отдельной молекулы. Движение одной какой-нибудь молекулы не характеризует свойств системы. Таким образом, статистический метод исследования основан на том, что свойства системы определяются свойствами микрочастиц системы и усредненными значениями их динамических и энергетических характеристик. Например, температура тела обусловлена скоростью беспорядочного движения молекул. Однако в фиксированный момент времени молекулы имеют различные скорости, что и создает беспорядочность теплового движения. Поэтому температура тела может быть выражена только через средние значения скорости движения молекул. Из изложенного следует вывод о том, что макроскопические характеристики, а в рассмотренном случае — температура, имеют физический смысл для большого числа молекул. Действительно, говорить о температуре одной молекулы просто нельзя.
Итак, суть статистического метода состоит в том, что для изучения системы огромного числа частиц информация должна иметь обобщенный характер и относиться не к отдельным частицам, а к их совокупности. Законы же поведения совокупностей частиц, исследуемые статистическим методом, называют статистическими. Кинетическая теория основана на следующих положениях:
1.Вещество дискретно — оно состоит из атомов, которые образуют комплексы, называемые молекулами.
2.Молекулы взаимодействуют друг с другом с силой, величина которой зависит от расстояния между молекулами.
3.Молекулы находятся в состоянии непрерывного беспорядочного движения.
Существует и другой, противоположный статистическому, метод исследования системы многих частиц, называемый термодинамическим. При таком подходе достаточно использовать понятия и физические величины, относящиеся к системе в целом. Базируется этот метод на сведениях, данных опытом, и «не принимает» во внимание, как только что было отмечено, микроструктурных факторов системы. Обратим внимание на то, что под системой понимают конечную область пространства с находящимися в ней
физическими объектами исследования. Теория термодинамического метода исследования системы строится на общих законах фундаментального или частного характера, например, закон сохранения энергии и соответственно второй закон термодинамики. Такая теория по своему содержанию является феноменологической. Она рассматривает внутренний механизм процессов, определяющих поведение системы в целом, не опирается на определенную модель внутреннего строения ее и не" использует математический аппарат теории вероятностей.
Статистический и термодинамический методы познания дополняют друг друга. Термодинамический метод характеризуется своей общностью. Статистический — позволяет понять суть явлений через связь поведения системы в целом с поведением ее компонентов. Комбинированное применение этих методов способствует эффективному решению научных проблем.
В науке широко используются модельные представления реальных явлений, процессов, систем и материальных тел. Модель представляет упрощенный вариант реальной структуры. Моделью, например, материального тела является совокупность атомов и молекул, взаимодействующих между собой по некоторым законам и движущихся соответствующим образом. Сами атомы и молекулы могут быть представлены также различными моделями в зависимости от обстоятельств и характера рассматриваемых явлений, то есть в одних случаях их можно считать материальными точками, в других — абсолютно твердыми телами, в третьих — необходимо знание их структуры. Заметим, что квантовая механика дает это знание. Поэтому моделью материального тела является совокупность атомов и молекул с известными свойствами и законами движения и взаимодействия. Примером модели материального газообразного тела, называемого реальным газом, является идеальный газ. Газ, молекулы которого не взаимодействуют друг с другом и имеют размеры много меньше, чем расстояния между ними, называют идеальным. Простота модели идеального газа дает возможность найти простые аналитические зависимости между его физическими параметрами. В состоянии равновесия модель идеального газа характеризуется объемом, давлением и температурой. Конечно, достоверность получаемых при этом соотношений снижается. А степень расхождения в свойствах идеального и реального газов определяется всякий раз конкретными условиями, в которых находится реальный газ. Водород, азот, гелий, воздух и другие газы с малой молярной массой даже при комнатной температуре и давлении до 30 бар ведут себя, как идеальный газ. Поэтому законы идеального газа во многих случаях могут применяться для расчетов с реальным газом.
Классическая статистика. Статистика Максвелла
Статистический метод предполагает исследование каждой молекулы из совокупности большого числа микрочастиц. Это значит, что допускается принципиальная возможность расчета поведения отдельно всех молекул по законам механики и электродинамики. Для этого достаточно знать начальные координаты, массу, скорость микрочастицы и действующие на нее силы. Заметим, что в 1 мм3 газа, например, при нормальных условиях содержится 2,7 · 1016 молекул. Поэтому поведение каждой из громадного числа взаимодействующих друг с другом молекул все же практически не поддается такому расчету с использованием современной вычислительной техники из-за чрезвычайно большого объема вычислений и требуемого для этого, времени (несколько тысяч лет). Однако выход из этого затруднения был найден. Оказывается, что для изучения свойств систем и наблюдаемых в них явлений не требуется конкретного знания о движении отдельных частиц. Дело в том, что движение большого числа частиц приобретает не свойственные механическому движению отдельной частицы качества,
указывающие на наличие особого движения материи — молекулярно-теплового. Специфичность теплового движения микрочастиц состоит в том, что оно характеризуется рядом статистических величин, не присущих отдельным частицам: температурой, энтропией и др. Эти статистические характеристики и сопутствующие тепловому движению закономерности теоретически определяются с использованием теории вероятностей через скорость, энергию, импульс и др. параметры микрочастиц. Последние при этом рассматриваются как случайные величины.
Статистический метод позволяет оценить вероятность возможных численных значений этих величин и их средние значения.
Вероятность возможных численных значений случайной величины выражается формулой, называемой законом распределения дайной физической величины. Одной из задач статистической физики и является установление законов распределения физических величин по всем возможным их численным значениям. Иллюстрацией изложенного, то есть существования определенных закономерностей в распределении случайных величин, является следующий опыт.
Пусть большое число N дроби опускается через отверстие, расположенное в середине верхней части вертикальной плоскости, на поверхности которой расположены несколько тысяч перпендикулярных к ней стержней. В нижней части плоскости опытной установки имеются одинаковые вертикальные желобки (рис. 5.1). Дробинки в процессе своего движения вниз испытывают множество столкновений со стержнями. Движение дробинок носит стохастический характер. Как показывает опыт, распределение дробинок по желобкам имеет неравномерный характер. Большая часть попадает в центральные желобки, расположенные под отверстием. В крайние желобки их попадает меньше (рис. 5.1). Распределение дробинок по желобкам имеет практически симметричный характер, и его называют распределением Максвелла. Результаты опытов стабильны в отношении повторяемости по числу дробинок, попадающих в определенный желобок. При другом числе дробинок характер распределения остается прежним. Если в i -й желобок попадает
Ni дробинок, то отношение Ni / N , показывает, какая часть дроби от общего числа попадает в i -й желобок. Это отношение можно рассматривать как вероятность попадания
одной дробинки в данный желобок. Поскольку отношение |
Ni / N зависит от ширины х i |
|||||
желобка, |
то |
принято |
вероятность |
попадания |
оценивать |
относительной |
плотностью |
вероятности попадания дробинок в желобок |
Ni /( N |
xi ). Диаграмма |
|||
значений Ni /( N |
xi ) приведена на рис. 5.2. При х → 0 гистограмма перейдет в плавную |
|||||
кривую, показанную на рис. 5.2 штриховой линией, называемую законом распределения или плотностью вероятности, или плотностью распределения случайной величины. Случайной величиной в рассмотренном опыте является отклонение дробинок х от средней точки х = 0. Закон распределения имеет следующую форму записи F ( x ) = dN /( Ndx ). Формула закона распределения может быть различной для разных случайных величин. В статистической физике определенный интерес представляет закон распределения молекул по скоростям.
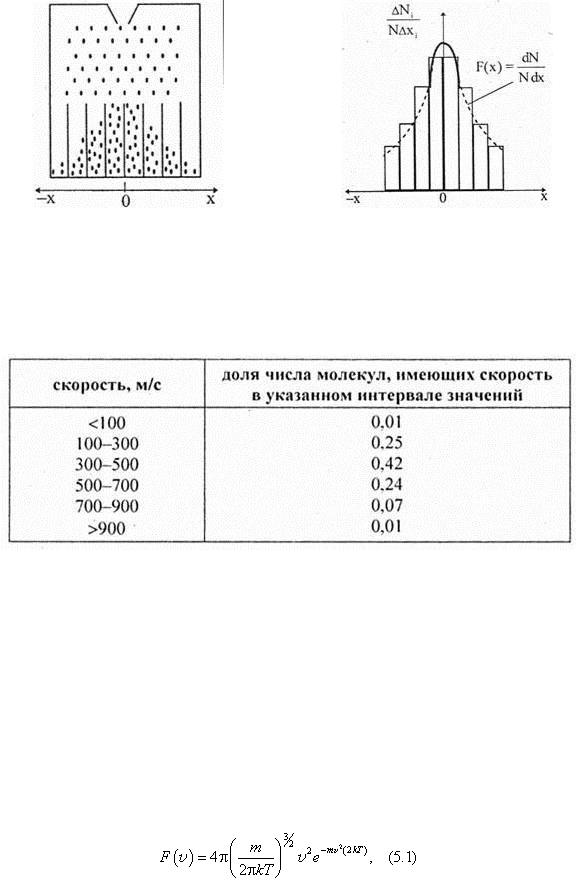
Рис . 5 .1 |
Рис . 5 .2 |
Средние скорости молекул некоторых газов и водяного пара в м/с при t = 0 °С и Р = 1,013 · 105 Па равны: водород — 1692, азот — 454, кислород — 425 и водяной пар — 566 м/с. В действительности, однако, существует определенное распределение молекул по скоростям, которое при только что сформулированных условиях выглядит, например, для азота следующим образом:
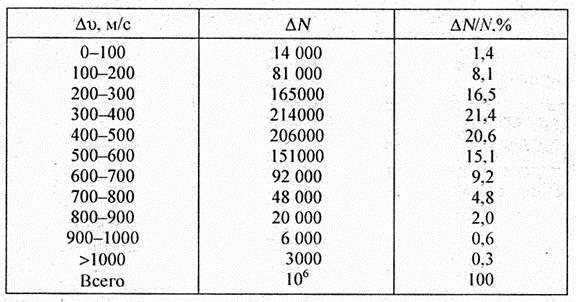
Приведенные данные являются результатом опытов и теоретических рассуждений Дж. Максвелла. Дж. Максвелл считал, что если газ состоит из очень большого числа N молекул, находящихся в равновесном состоянии беспорядочного теплового движения, то в нем устанавливается стационарное (не меняющееся со временем) распределение молекул по скоростям, называемое функцией распределения молекул по скоростям F ( v ) или статистикой Максвелла. Если диапазон скоростей молекул разбить на бесконечно малые интервалы d v , то на каждый из них будет приходиться некоторое число молекул dN ( v ). Функция F ( v ) определяет относительное число молекул dN ( v )/ N , скорости которых находятся в интервале от v до v + d v , то есть F ( v ) = dN ( v )/( Nd v ).
Вид функции F ( v ) для идеального газа был установлен Дж. Максвеллом, которая характеризует распределение относительного числа молекул газа по скоростям в состоянии равновесия,
где m — масса молекулы, кг; k = 1,3806 · 10–23 Дж/К — постоянная Больцмана; Т — абсолютная температура, К; v — скорость молекулы, м/с. Графическое изображение функции представлено на рис. 5.3.

Рис . 5 .3
При возрастании v множитель  уменьшается быстрее, чем растет множитель v 2 . Следовательно, функция F ( v ), начинаясь от нуля, достигает максимума, а затем асимптотически стремится к нулю. Кривая распределения несимметрична относительно v в . Но при достаточно малых значениях скорости она станет параболой. Относительное число молекул dN ( v )/ N , скорости которых находятся в интервале от v до v + d v , равно площади F ( v ) d v (рис. 5.3). Число молекул в этом интервале значений скорости остается неизменным. Иными словами, представленное на рис. 5.3 распределение оказывается постоянным во времени. Изменение его для данного газа возможно при изменении температуры. С повышением температуры рассматриваемого
уменьшается быстрее, чем растет множитель v 2 . Следовательно, функция F ( v ), начинаясь от нуля, достигает максимума, а затем асимптотически стремится к нулю. Кривая распределения несимметрична относительно v в . Но при достаточно малых значениях скорости она станет параболой. Относительное число молекул dN ( v )/ N , скорости которых находятся в интервале от v до v + d v , равно площади F ( v ) d v (рис. 5.3). Число молекул в этом интервале значений скорости остается неизменным. Иными словами, представленное на рис. 5.3 распределение оказывается постоянным во времени. Изменение его для данного газа возможно при изменении температуры. С повышением температуры рассматриваемого
газа скорости молекул растут как  , и естественно, что возрастает при этом и средняя скорость молекул, поэтому максимум распределения смещается в сторону высоких скоростей (рис. 5.4), а высота кривой в максимуме понижается. Таким образом, конкретный вид функции распределения зависит от рода газа и его температуры, Кроме того, общая площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это значит, что функция F ( v ) удовлетворяет так называемому условию нормировки
, и естественно, что возрастает при этом и средняя скорость молекул, поэтому максимум распределения смещается в сторону высоких скоростей (рис. 5.4), а высота кривой в максимуме понижается. Таким образом, конкретный вид функции распределения зависит от рода газа и его температуры, Кроме того, общая площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это значит, что функция F ( v ) удовлетворяет так называемому условию нормировки
Рис . 5 .3
Из этого условия следует, что площадь, ограниченная кривой распределения и осью абсцисс, для конкретного газа независимо от его температуры остается постоянной. Именно поэтому кривая распределения с ростом температуры растягивается и понижается.
Исследуя функцию распределения Максвелла, можно получить формулы для расчета наиболее вероятной скорости молекул v в , соответствующей максимуму функции распределения, и среднюю скорость молекулы. А исходя из закона распределения молекул по скоростям, можно найти распределение молекул газа по значениям кинетической энергии.
И последнее, из графического изображения функции распределения очевидно, что число молекул с малыми и большими скоростями незначительно и что большинству молекул характерны скорости, близкие к наиболее вероятной скорости.
Чтобы наглядно представить себе смысл наиболее вероятной скорости и распределения молекул по скоростям, рассмотрим еще один пример. В некотором объеме содержится 106 молекул при 0 °С, движущихся с различными скоростями. Распределение числа N молекул по скоростям представлено ниже. Весь диапазон скоростей разбит на интервалы v = 100 м/с.
Таблица 5 .1
Распределение молекул по скоростям
Как видно из табл. 5.1, подавляющее большинство молекул имеют скорость в пределах от 200 до 600 м/с. Больше всего молекул приходится на интервал скоростей от 300 до 400 м/с. Наиболее вероятная скорость заключена в этом интервале и равна при 0 °С
≈377 м/с.
Иеще об одном, в порядке подведения итогов. Статистические законы распределения, основой которых являются массовость и случайность, применяются в науке, в различных отраслях хозяйства, экономике, вопросах массового обслуживания и т.д.
Давление. Основное уравнение кинетической теории газов
Хаотическое движение молекул связано с тепловым состоянием тела. В процессе движения молекулы газа ударяются о стенки сосуда. Из-за множества молекул ограждающие газ поверхности воспринимают их удары как действие непрерывной, постоянной и нормально направленной силы. Отнесенная к единице площади сила

представляет собой давление газа. На величину давления не влияет ориентация поверхности, на которую давит газ. Обусловлено это беспорядочностью теплового движения молекул, при котором ни одно из направлений не имеет преимущества. Таким образом, давление есть результат силового действия молекул на стенки сосуда. Следует ожидать, что сила удара, а значит, и давление зависят от скорости или кинетической энергии поступательного движения молекул.
Основное уравнение кинетической теории выражает зависимость давления концентрации молекул и идеального газа от среднего значения кинетической энергии теплового движения молекул. Рассмотрим одноатомный идеальный газ, например, в цилиндре двигателя внутреннего сгорания (рис. 5.5) длиной l = v t , м, где v — скорость молекул газа, м/с; t — время, с. Допустим, что число упругих соударений хаотически движущихся молекул газа массой m между собой значительно меньше числа упругих ударов о стенку неподвижного поршня площадью s , м2 . Допущение об упругих соударениях молекул между собой и с поверхностью поршня предполагает возможность изменения только направления их движения, но не значений скорости. В цилиндре с концентрацией молекул п = N / V , м–3 находится N = nsvt молекул, каждая из которых обладает импульсом то. Вследствие упругого соударения с поршнем молекула изменяет направление скорости на противоположное. Изменение импульса одной молекулы равно
р 1 м = m v – (–т v ) = 2т v , Н · с.
Рис . 5 .5
А сила, с которой молекула действует на поршень,
С целью упрощения расчетов хаотическое движение молекул рассмотрим как движение по трем направлениям пространства. Следовательно, в любой момент времени вдоль каждой оси движется 1/3 молекул, причем, половина молекул — 1/6, движется вдоль конкретного направления в одну сторону, половина — в диаметрально противоположную. С учетом этого число ударов молекул, движущихся в заданном направлении, о неподвижный поршень равно 1/6( ns v t ). При соударениях эти молекулы передадут поршню импульс
Результатом силового ударного воздействия молекул на поршень является давление
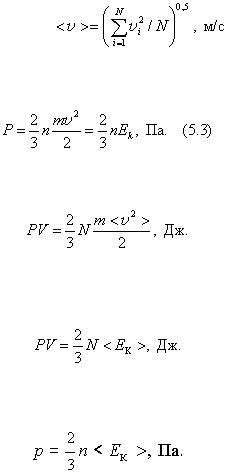
Так как в цилиндре объемом V = s v t , м3 содержится N молекул газа со скоростями v 1 , v 2 , v 3 , …, v N , то следует в расчетах использовать среднестатистическую скорость,
называемую средней квадратичной |
. С учетом этого формула |
(5.2) примет вид |
|
или, принимая во внимание, что n = N / V , м–3 ,
Преобразуя последнее равенство, получим основное уравнение кинетической теории газов:
или в виде
где <Е К > — средняя кинетическая энергия поступательного движения молекул газа, Дж.
Давление позволяет оценить запас потенциальной энергии сжатой упругой среды, определяет ее возможность производить механическое воздействие. Для измерения давления используют разные единицы. Применяемая в России международная система СИ требует измерения давления в Па. 1 Па — давление, вызываемое силой в 1 Н (1 кгс = 9,81 Н), равномерно распределенной по поверхности площадью 1 м2 . Распространение имеет единица давления в технической системе — кГ/ м2 . Как первая, так и вторая единица неудобны тем, что очень малы. На практике применяют более крупные единицы:
105 Па = 1 бар = 750 мм рт. ст.; 106 Па = 1 МПа;
104 кГ/м2 = 1 кГ/см2 .
Наряду с этими единицами имеют применение и другие. Соотношения между наиболее используемыми единицами измерения давления:
1 техн. атм. = 1 ата = 1 кГ/см2 =1 · 104 кГ/м2 = 0,98 · 105 Па = 980 гПа = 0,98 бар = 735 мм рт.ст. = 10 м вод.ст.; 1 физ. атм. = 1 ат = 1,033 кГ/см2 = 1,033 · 104 кГ/м2 = 1,013 · 105 Па
=1013 гПа = 1,013 бар = 760 мм рт.ст. = 10,33 м вод.ст.
Внекоторых случаях приборы, измеряющие давление, дают показания избыточного (манометрического) давления Ри (Рм ) относительно атмосферного — барометрического Рб
. Такие приборы называют манометрами. Абсолютное давление Ра в этом случае Ра = Р и +
Рб .
Для измерения давления ниже атмосферного используются вакуумметры, которые показывают разность между барометрическим давлением Р6 и абсолютным Ра , — так называемый вакуум или разряжение Рв = Рб – Ра . Заметим, что абсолютное и барометрическое давления отсчитываются от нуля.
В практике физических исследований и эксплуатации технических устройств приходится измерять давления в диапазоне от 10–10 до 1011 Па. В различных интервалах давлений пользуются различными методами его измерения. Манометры разделяют на две категории. К первой категории относятся приборы, называемые первичными, которые непосредственно измеряют давление как величину, равную отношению силы к площади. Манометры другой категории измеряют не непосредственное давление, а некоторую связанную с давлением величину. Общие особенности измерения давлений в различных интервалах следующие. В области низкого давления, примерно < 100 Па, используются в основном ионизационные и термоэлектрические вторичные манометры. Для измерения давлений, близких к атмосферному, используются жидкостные манометры в виде U - образных трубок. Манометры для измерения атмосферного давления называют барометрами. Для измерения больших давлений применяются поршневые и вторичные манометры Бурдона. В манометре Бурдона используется эффект относительного движения концов изогнутой трубки при повышении давления в ее полости.
Температура — мера средней кинетической энергии микрочастиц
Есть основания полагать, что не только давление, но и другая макроскопическая характеристика состояния газа — температура, тоже зависит от кинетической энергии теплового движения микрочастиц.
Не вызывает сомнения, что при смешении газов с разной температурой в результате теплообмена среды придут в состояние теплового равновесия. Что же касается их средних кинетических энергий, то наступление теплового равновесия соответствует также установлению и энергетического равновесия. Это значит, что средняя кинетическая энергия молекул идеального газа связана с его температурой, определяет эту температуру и, следовательно, может служить мерой температуры. Очевидна справедливость и обратной причинно-следственной связи. С целью выяснения количественного соотношения между температурой газа и его кинетической энергией проведем следующие рассуждения.
В идеальном газе отсутствует потенциальная составляющая внутренней энергии. Энергия молекул такого газа состоит только из кинетической энергии поступательного и вращательного движений. Определение каждой из компонент кинетической энергии микрочастицы связано с понятием числа ее степеней свободы. Числом степеней свободы тела называют число независимых координат, устанавливающих положение его в пространстве.
Перемещение, например, микрочастицы можно характеризовать тремя поступательными движениями вдоль трех осей прямоугольной системы координат и тремя вращательными движениями вокруг трех взаимно перпендикулярных осей, проходящих через центр массы молекулы (рис. 5.6), то есть положение молекулы в пространстве определяется тремя линейными x , y , z и тремя угловыми α, β, γ

координатами. Таким образом число степеней свободы ее равно шести и состоит из трех поступательных и трех вращательных степеней свободы.
Рис . 5 .6
Любые ограничения движения тела приводят к уменьшению числа степеней свободы. Рассмотрим изложенное на примерах. Движению вращающегося шара на плоскости соответствует пять степеней свободы: две поступательных и три вращательных. Железнодорожному вагону — одна, а его колесу — две: одна поступательная и одна вращательная.
Для молекулы одноатомного газа число степеней свободы равно трем, так как для определения ее положения в пространстве достаточно знать только линейные координаты. Это утверждение основано на представлении о том, что вращение молекулы вокруг собственных осей не изменяет ее положения в пространстве. Молекула двухатомного газа представляет собой совокупность жестко связанных между собой химически двух атомов (рис. 5.7). У каждого из них есть возможность вращения относительно друг друга. Поэтому двухатомная молекула имеет пять степенней свободы: три поступательные и две вращательные. Трех- и более атомные молекулы имеют шесть степеней свободы.
Рис . 5 .7
Согласно теореме Л. Больцмана о равнораспределении энергии по степеням свободы, на каждую степень свободы поступательного и вращательного движений молекул идеального газа приходится одна и та же средняя кинетическая энергия, равная 0,5 kT , где k = 1,3806 · 10–23 Дж/К — постоянная Больцмана. Полная кинетическая энергия молекулы, имеющей i степеней свободы, равна Ек = 0,5 ikT , Дж.
Для идеального газа любой атомности число степеней свободы поступательного движения молекул всегда равно трем. Поэтому средняя кинетическая энергия поступательного движения каждой из молекул пропорциональна температуре и равна
