
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf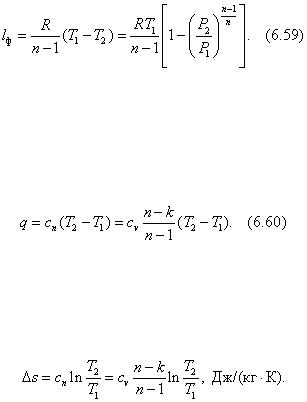
Работа в бесконечно малом термодинамическом процессе из уравнения первого закона термодинамики cn dT = cv dT +δl ф равна:
δl ф = cn dT – cv dT = [cv (n – k )/(п – 1) – cv ]dT = с v [(п – k )/(n – l ) – l ]dT = = с v [(1 – k )/(п – l )]dT = [(с v – k с v )/(n – 1)]dT = – [R /(n – 1)]dT .
Отсюда физическая работа в политропном процессе
Согласно (6.55) располагаемая работа равна lp = nl ф .
Теплота, участвующая в политропном процессе, определяется из уравнения первого закона термодинамики, или через теплоемкость газа в процессе. Во втором случае теплота выражается формулой:
Изменение внутренней энергии и энтальпии рабочего тела в политропном процессе определяется по общим уравнениям соответственно (6.32) и (6.33). Изменение энтропии рабочего тела в политропном процессе определяется по общим уравнениям (6.50)...(6.52), или по формуле, следующей из уравнения (6.57):
Коэффициент распределения энергии в политропном процессе
α = du /δq = cv dT /c т dT = cv /[cv (n – k )/(n – 1)] = (n – 1)/(n – k ).
Адиабатный процесс
Процесс, происходящий без теплообмена с окружающей средой, называют адиабатным. Согласно определению δq = 0. Для получения такого процесса следует либо теплоизолировать газ, либо провести процесс настолько быстро, чтобы изменение температуры рабочего тела из-за его теплообмена с окружающей средой было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно при высокой скорости газовых потоков, так как теплообмен в этом случае происходит значительно медленнее, чем сжатие или расширение газа. Такие процессы наблюдаются в диффузоре, сопловом канале, газовой турбине силовой установки летательного аппарата. И все же адиабатный процесс является теоретическим. Однако, несмотря на это, изучение закономерностей адиабатного процесса имеет не только познавательное, но и большое практическое значение.
Теплоемкость в адиабатном процессе с q =о = (δq /dT )q = 0 = 0/dT = 0. Согласно (6.55) показатель политропы в адиабатном процессе равен: п = (с q – с p )/(с q – cv ) = с p /cv = k , где k — показатель адиабаты. Уравнение адиабатного процесса в координатах Pv согласно
(6.56) при n = k имеет вид: Р vk = const . Уравнение же обратимого процесса в Т s — координатах при с q =о = 0: s = с q =о ln T + const = const . Следует обратить еще раз внимание на то, что уравнение процесса s = const носит частный характер, то есть справедливо при условии протекания в теплоизолированной системе обратимых процессов. При протекании в системе необратимых процессов уравнением адиабатного процесса в Т s координатах будет неравенство s > 0.
В системе координат Pv кривая, подчиняющаяся уравнению Pvk = const , представляет собой неравнобокую гиперболу (рис. 6.15). Ее называют адиабатой. Адиабата на диаграмме с координатами Ts имеет вид вертикали (рис. 6.16).
Рис. 6.15
Рис. 6.16
Уравнения соотношения параметров состояния Р, v , T в адиабатном процессе имеют такой же вид, что и в политропном, но с той лишь разницей, что вместо «п » в них следует писать «k ».
Физическая и располагаемая работа определяются соответственно по уравнениям (6.59) в (6.60), в которых показатель политропы «п » следует заменить на показатель адиабаты «k ».

Изменение внутренней энергии и энтальпии рабочего тела в адиабатном процессе определяется по общим уравнениям соответственно (6.32) и (6.33). Поскольку в процессе q = 0, то согласно уравнениям первого закона q = и+ l ф и q = h + lp изменение внутренней энергии равно
так как
cv = R /(k – 1), или
а изменение энтальпии
так как
cp = kR /(k –1) или
Изотермический процесс
Изотермический процесс является обратимым, так как осуществление его возможно при наличии достаточно большой емкости источника теплоты данной температуры. При этом обеспечивается непрерывный подвод (или отвод) теплоты к рабочему телу в течение всего процесса при постоянной температуре.
Теплоемкость в изотермическом процессе сn = с т = δq /dT = δq /0 = ± ∞. Согласно (6.55) показатель политропы в изотермическом процессе равен: п = (± ∞ – с p )/(± ∞ – cv ) = ±∞/±∞. Чтобы раскрыть неопределенность данного типа, следует выполнить преобразования:
Отсюда n = 1 и, следовательно, уравнение изотермического процесса в координатах Pv примет вид Pv = const . Как известно, это равенство является аналитическим выражением закона Бойля-Мариотта. График процесса Pv = const выражается в координатной системе Pv равнобокой гиперболой (рис. 6.17), которая называется изотермой.
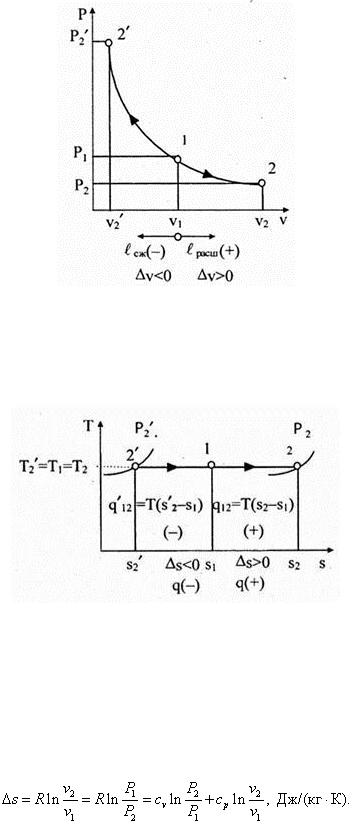
Рис. 6.17
Итак, в изотермическом процессе Р = var , v = var , a T = const . В координатах Ts уравнением изотермического процесса считают Т = const . Графически в этих координатах изотерма изображается горизонталью (рис. 6.18).
Рис. 6.18
Уравнение соотношения параметров состояния вытекает из уравнения процесса Р v = const : P 1 /P 2 = v 2 /v 1 .
Изменение внутренней энергии и энтальпии в изотермическом процессе отсутствует, то есть и = с v T = с v 0 = 0 и h = с p T = с p 0 = 0. Изменение энтропии идеального газа, согласно формулам (6.50)-(6.52), при условии ln (T 2 /T 1 ) = ln 1 = 0, равно
Физическая работа в соответствии с (6.59) равна
l ф = R (T 1 – T 2 )/(п – 1) = 0/0,
то есть работу изменения объема по уравнению (6.59) определить нельзя. Ее можно найти из общего математического выражения физической работы

так как Р = RT /v и P 1 v 1 = P 2 v 2 .
Располагаемая работа, исходя из (6.55), в п раз больше физической. Так как в данном процессе п = 1, то lp = l ф . Последнее равенство также является условием равнобокости гиперболы в Pv -координатной системе. Это значит пл. 2'12v 2 v '2 2' = пл. 2'12P 2 P '2 2.
Теплота, участвующая в изотермическом процессе, не может быть определена через теплоемкость, так как q = с T T = ∞ · 0. Теплоту обратимого изотермического процесса можно рассчитать исходя из математического выражения второго закона термодинамики
, Дж/кг. Кроме того, из |
уравнений первого закона для |
закрытых и открытых термодинамических систем при |
и = 0 и h = 0 следует q = l ф = l p . |
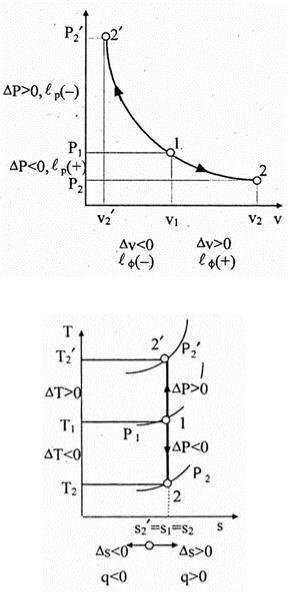
Адиабата Pvk = const на Pv -диаграмме (рис. 6.19) изображается более крутой кривой 312 по сравнению с изотермой Pv = const (кривая 514), так как показатель адиабаты k > 1. Из рисунка 6.19 очевидно, что более эффективным по преобразованию теплоты в работу и наоборот является изотермический процесс. Действительно, производимая в тепловом двигателе работа в изотермическом процессе расширения 14, численно равна площади 14v 4 v 1 l , больше работы в адиабатном процессе расширения 12, численно равной площади 12v 2 v 1 l . В процессе сжатия работа в тепловом двигателе должна быть минимальной. При изотермическом сжатии в процессе 16 работа (пл. 16v 6 v 1 l ) будет меньшей, чем при адиабатном сжатии в процессе 13 (пл. 13v 3 v 1 1).
Рис. 6.19
Изобарный процесс
При изобарном процессе давление остается постоянным: Р = const , другие параметры состояния меняются, то есть v = var и Т = var . Теплоемкость в изобарном процессе: с n = cp = (δq /dT )P . Согласно (6.55) показатель политропы в изобарном процессе п = (cp – cp )/(cp – cv ) = 0/R = 0 и, следовательно, уравнение изобарного процесса в координатах Pv примет вид Pv °= const , P = const . График процесса Р = const изображается в координатной системе Pv горизонталью (рис. 6.20), которая называется изобарой.
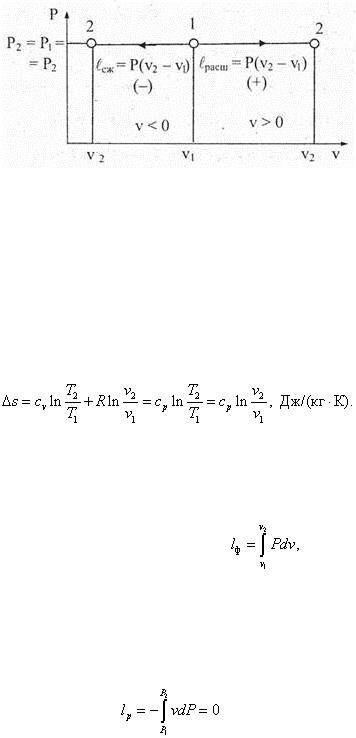
Рис. 6.20
В координатах Ts уравнение изобарного процесса следует из (6.57) при cn = cp : s = cp lnT + const . Изобара на диаграмме с координатами Ts имеет вид логарифмической кривой (рис. 6.21). Соотношение параметров состояния следует из уравнения Клапейрона, рассмотренного для состояний 1 и 2, то есть Pv 1 = RT 1 и Pv 2 = RT 2 ,. Разделив одно на другое, получим Т 2 /Т 1 = v 2 /v 1 или T /v = const . Изменение внутренней энергии и энтальпии идеального газа в изобарном процессе определяется по общим уравнениям соответственно (6.32) и (6.33). Изменение энтропии идеального газа на основании формул
(6.50)–(6.52) при условии ln (P 2 /P 1 ) = ln 1 = 0 равно:
Физическая работа согласно формуле (6.59) равна:
l ф = – R (T 2 – T 1 )/(0 – 1) = R (T 2 – T 1 ).
Исходя из общего понятия физической работы при Р = const следует l ф = P (v 2 – v 1 ). Справедливость равенства P (v 2 – v 1 ) = R (T 2 – T 1 ) можно доказать, рассматривая уравнение Клапейрона применительно к процессу 12 при условии, что Р = const , v = var , T = var .
Располагаемая работа, исходя из (6.55), в п раз больше или меньше физической. Но так как в изобарном процессе n = 0, то lp = 0. Этот же вывод следует и из математического
определения располагаемой работы: , так как dP = 0.
Теплота, участвующая в изобарном процессе, равна: q = с p (T 2 – T 1 ). Эта формула следует также из уравнения первого закона для открытых термодинамических систем q = h + lp = h . Таким образом, теплота, подводимая или отводимая в изобарном процессе, численно равна разности энтальпий рабочего тела (идеального или реального) в процессе. Здесь уместно заметить, что многие процессы теплообмена между холодным и горячим теплоносителями через разделяющую поверхность, являются изобарными. Если воспользоваться уравнением первою закона термодинамики для закрытых систем, то при определении количества теплоты придем к тому же результату: q = и + l ф = с v (T 2 – T 1 ) + P (v 2 – v 1 ) = с v (T 2 – T 1 ) + R (T 2 – T 1 ) = (с v + R )(T 2 – T 1 ) = ср (T 2 – T 1 ) = h , Дж/кг.
Изохорный процесс
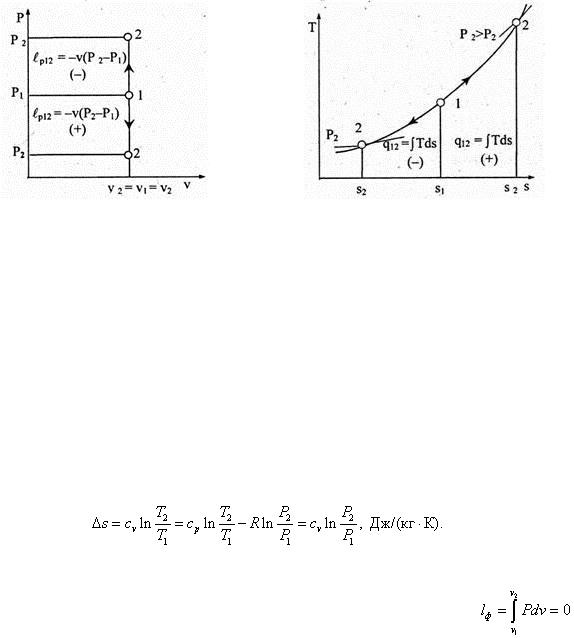
В рассматриваемом процессе объем газа остается постоянным — v = const , два других параметра состояния меняются: Р = var , Т = var . Теплоемкость в изохорном процессе: сп = с = (bq /dT )v . Согласно (6.55), показатель политропы п = (с v – ср )/(с v – с v ) = –R /0 = – ∞ (путем дополнительных рассуждений можно прийти к выводу о том, что показатель политропы в изохорном процессе может быть равен +∞ и, следовательно,
уравнение изохорного процесса в координатах Pv примет вид Pv ±∞ = const , 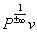 = const , P 0 v = const и, наконец, v = const . График процесса v = const изображается в координатной системе Pv вертикалью (рис. 6.22), которая называется изохорой.
= const , P 0 v = const и, наконец, v = const . График процесса v = const изображается в координатной системе Pv вертикалью (рис. 6.22), которая называется изохорой.
Рис. 6.22 |
Рис. 6.23 |
В координатах Ts уравнение изохорного процесса следует из (6.57) при сп = cv : s = cv lnT + const . Изохора на диаграмме Ts имеет вид логарифмической кривой (рис. 6.23).
Из уравнения Клапейрона Pv = RT при v = const следует, что Р /Т = const , а соотношение параметров состояния имеет вид P 2 /P 1 = T 2 /T 1 . Таким образом, при изохорном процессе давление газа изменяется прямо пропорционально термодинамической температуре.
Изменение внутренней энергии и энтальпии идеального газа в изохорном процессе определяется по общим уравнениям соответственно (6.32) и (6.33). Изменение энтропии идеального газа на основании формул (6.50) и (6.52) и при условии ln (v 2 /v 1 ) = ln 1 = 0 равно:
Физическая работа согласно (6.59) равна: l ф = R (T 1 – T 2 )/(±∞ – 1) = 0. Этот же
результат следует и из математического определения физической работы: |
, |
так как dv = 0. |
|
Располагаемая работа на основании (6.55) в п раз больше или меньше физической: lp = п l ф = ±∞ · 0, то есть располагаемую работу по формуле (6.59) определить нельзя. Ее можно найти из общего математического выражения располагаемой работы
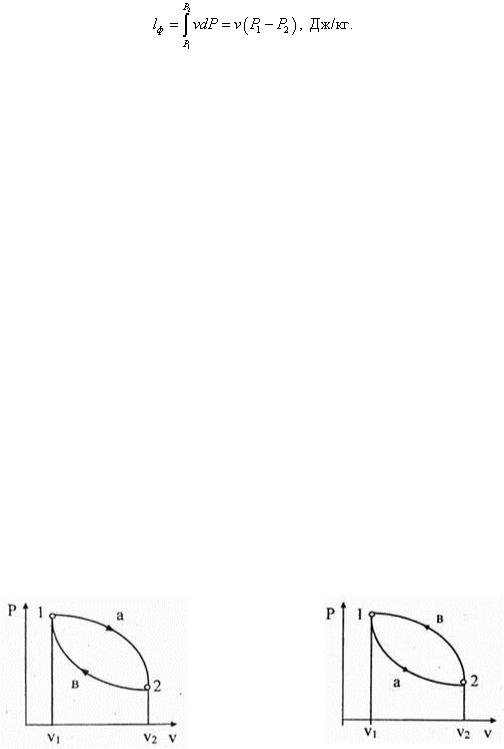
Теплота, участвующая в изохорном процессе, равна: q = с v (Т 2 – Т 1 ), Дж/кг. Эта формула следует также из уравнения первого закона для закрытых термодинамических систем: q = и + l ф = и = с v (Т 2 – Т 1 ), l ф = 0. Таким образом, теплота, подведенная к газу в изохорном процессе, полностью расходуется на изменение внутренней энергии. И наоборот, полученный результат не противоречит первому закону термодинамики для открытых систем. Чтобы убедиться в этом, проделаем следующее: q = h + lp = с p (Т 2 – Т
1 ) – v (P 2 – P 1 ) = с p (Т 2 – Т 1 ) – R (Т 2 – Т 1 ) = (с p – R ) (Т 2 – Т 1 ) = с v (Т 2 – Т 1 ).
Круговые процессы — циклы
Преобразование теплоты в работу в термодинамическом процессе возможно однократно и до того момента, при котором рабочее тело из неравновесного состояния 1 (рис. 6.24), расширяясь, перейдет в состояние 2 равновесия с окружающей средой. Чтобы непрерывно производить работу в тепловом двигателе, необходимо возвратить путем сжатия рабочее тело из состояния 2 в состояние 1, то есть процесс 1а 2 замкнуть, например, по линии 2в 1. Замкнутый термодинамический процесс называют круговым или циклом. В соответствии со вторым законом термодинамики, для преобразования теплоты в работу необходимо иметь два источника теплоты: горячий (теплоотдатчик) с температурой T 1 и холодный (теплоприемник) с температурой Т 2 . При этом, как известно, из подводимой к рабочему телу от горячего источника теплоты q 1 часть ее в количестве q 2 должна быть отдана холодному источнику (теплоприемнику). Следовательно, за один цикл в работу превратится часть теплоты в количестве q ц = q 1 – q 2 = l ц . Так как в круговом процессе и = 0 и h = 0, то согласно первому закону применительно к круговому процессу q ц l ф = l расш – l сж = l р = l ц . Таким образом,
разность работы расширения l расш = пл.1а 2v 2 v 1 1 (рис. 6.24) и работы сжатия l сж = пл.2в 1v 1 v 2 2 представляет собой произведенную в двигателе работу цикла l ц = l расш – l сж =
пл.1а 2в 1.
Рис. 6.2 4 |
Рис. 6.2 5 |
Круговые процессы, протекающие по часовой стрелке, называют прямыми (рис.6.24), а круговые процессы, направленные против часовой стрелки — обратными (рис. 6.25). По прямым циклам работают тепловые двигатели, назначение которых — производство работы. По обратным — холодильные машины и тепловые насосы, называемые также термотрансформаторами. Назначение холодильных машин — отвод теплоты q 2 , от низкотемпературного источника в целях охлаждения последнего и последующей передачей q 2 высокотемпературному источнику с температурой окружающей среды Т о.с при затрате работы извне. В тепловых насосах отвод теплоты q 2
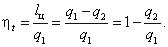
от низкотемпературного источника с температурой T о.с производится в целях использования этой теплоты для нагрева высокотемпературного источника при затрате работы извне.
Для оценки эффективности циклов тепловых двигателей используется термический коэффициент полезного действия (КПД):
Термический КПД численно представляет собой отношение количества полученной в цикле работы к количеству затраченной теплоты. По физическому содержанию термический КПД характеризует способность теплового двигателя к преобразованию получаемой от горячего источника теплоты в работу.
Прямой цикл Карно
Для оценки совершенства реальных тепловых машин необходимо иметь идеал, к которому следует стремиться. Таким идеалом для всех преобразователей энергии является цикл Карно, разработанный С. Карно в 1824 г. Цикл Карно состоит из двух адиабат и двух изотерм. На рис. 6.26 и 6.27 соответственно на диаграммах Pv и Ts представлен прямой цикл Карно. Это единственно возможная комбинация процессов, когда работоспособность системы будет максимальной. Обусловлено это тем, что в изотермическом процессе расширения вся подводимая теплота, а в адиабатном процессе расширения все изменения внутренней энергии газа превращаются в работу. Поэтому из всех обратимых циклов: Отто, Дизеля, Тринклера, Брайтона, Стирлинга, Эриксона и др., цикл Карно — самый эффективный. В прямом цикле Карно при наличии двух источников теплоты и при соблюдении условия обратимости отвод и подвод теплоты может осуществляться только по изотермам. Действительно, идеальный, то есть обратимый, подвод теплоты от источника с неизменной температурой Т 1 к рабочему телу может быть реализован только по изотерме Т 1 и при равенстве температур теплоисточника и рабочего тела на протяжении всего процесса подвода теплоты q 1 Обратимый отвод теплоты q 2 от рабочего тела к теплоприемнику с неизменной температурой Т 2 можно произвести также только изотермически при Т 2 и при равенстве температур рабочего тела и теплоприемника на протяжении всего процесса. Однако две изотермы не могут образовать круговой процесс, и поэтому обратимый переход с температурного уровня Т 1 на уровень Т 2 и обратно возможен только по адиабатам 12 и 34 (рис. 6.26 и 6.27). Условие обратимости всех процессов предполагает также их равновесность (равенство давлений и температур по всей массе рабочего тела), отсутствие тепловых потерь, трения и химического реагирования. Так получается идеальный цикл 12341 — цикл Карно. Его называют также предельным циклом Карно. Это обусловлено тем, что на любой цикл можно наложить цикл Карно, проведя изотермы через экстремальные температуры конкретного цикла.

Рис. 6.2 6 Рис. 6.2 7
Коэффициент полезного действия цикла Карно равен
Анализируя формулу, придем к выводам:
1.Термический КПД прямого цикла Карно тем больше, чем меньше отношение абсолютных температур теплоприемника и теплоотдатчика. Следовательно, для повышения экономичности прямого цикла Карно следует стремиться к увеличению температуры Т 1 и к снижению температуры теплоприемника Т 2 .
2.Термический КПД теплового двигателя, работающего по циклу Карно, всегда меньше единицы. Равенство КПД единице могло бы иметь место при температуре
теплоотдатчика Т 1 = ∞ или при Т 2 = 0. Однако ни одно из этих условий не осуществимо. Поэтому всегда ηt k < 1.
3.При равенстве T 1 = T 2 : ηt k = 0.
Если допустить, что современные материалы способны длительно работать при T 1 = 3000 К, то при Т 2 = 300 К ηt k = 90%. Кстати, эффективный КПД на валу автомобильных колес составляет 10%. Это значит, что один литр топлива из десяти переходит в энергию вращения колес, то есть используется по назначению, а девять литров «обеспечивают» необратимость многочисленных процессов автомобиля.
Цикл Карно не применяется в реальных тепловых машинах для организации их работы и не только потому, что реальные процессы необратимы. Если изобразить газовый цикл Карно на Pv -диаграмме (рис. 6.26) строго в соответствии с реальными значениями параметров в состояниях 1, ..., 4, то из-за относительно небольшой разницы в наклоне изотерм и адиабат окажется, что площадь этого цикла незначительна, а протяженность его
внаправлении обеих координат велика. Например, расчет для поршневого газового
двигателя показывает, что при температурах t 1 = 1800 °С и t 2 = 15 °С, при наружном давлении Р 2 = 105 Па, максимальное давление конца сжатия Р 4 равно 3 · 108 Па, а объем при адиабатном расширении в процессе 12 увеличится в 400 раз. В существующих поршневых двигателях давление не превышает 7 · 106 Па, а увеличение объема — 18 раз. Таким образом, если построить газовый двигатель, работающий по циклу Карно, то его эффективность по термическому КПД была бы сведена на нет потерями на трение поршня
вочень длинном цилиндре, огромной массой двигателя и большими расходами, металла.
