
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf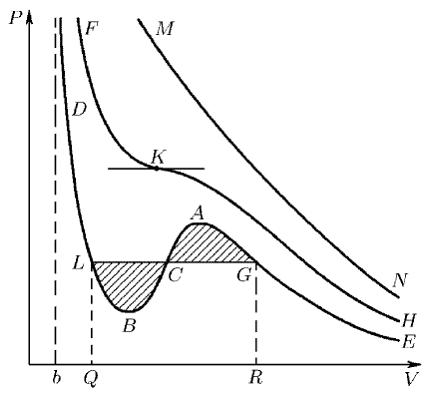
изобара Р = const пересекает изотерму. В первом случае, когда корень один, и точка пересечения будет одна. Так будет, как мы видели, при любых давлениях, если температура достаточно высока. Изотерма имеет вид монотонно опускающейся кривой МN (рис. 98). При более низких температурах и надлежащих значениях давления Р уравнение (100.1) имеет три корня V 1 ,V 2 ,V 3 . В таких случаях изобара Р = const пересекает изотерму в трех точках L , C , G (рис. 98). Изотерма содержит волнообразный участок LBCAG . Она сначала монотонно опускается вниз (участок DB ), затем на участке ВА монотонно поднимается вверх, а за точкой А снова монотонно опускается. При некоторой промежуточной температуре три корня V 1 ,V 2 ,V 3 становятся равными. Такая температура и соответствующая ей изотерма называются критическими .
Рис. 98
Критическая изотерма FKH всюду монотонно опускается вниз, за исключением одной точки K , являющейся точкой перегиба изотермы. В ней касательная к изотерме горизонтальна. Точка K называется критической точкой . Соответствующие ей давление Р k , объем V k и температура Т k называются также критическими . Говорят, что вещество находится в критическом состоянии, если его объем и давление (а следовательно, и температура) равны критическим.
Критическая температура и критическое состояние никоим образом не являются понятиями, связанными исключительно с уравнением Ван-дер-Ваальса. Такие понятия можно было бы ввести для любого уравнения состояния, изотермы которого имеют волнообразный характер, а при повышении температуры переходят в монотонные. Для всего последующего изложения существен только такой ход изотерм, а не конкретная форма уравнения состояния. Более того, возможность существования вещества в критическом состоянии не может быть обоснована с помощью уравнения Ван-дер- Ваальса. Это видно уже из того, что уравнением Ван-дер-Ваальса приходится пользоваться вне области его применимости. К понятию критического состояния можно прийти путем анализа экспериментальных изотерм вещества без использования какого бы

то ни было «теоретического» уравнения состояния, как это и было на самом деле. Однако мы не встанем на такой путь чистого эмпиризма, а постараемся показать, какая существует связь между критическими явлениями, уравнением состояния и общими условиями термодинамического равновесия. Ради простоты проведем все рассуждения почти исключительно на основе уравнения Ван-дер-Ваальса. Но его следует рассматривать не как истинное, а как «модельное» уравнение состояния вещества. После этого разъяснения можно не опасаться, что у читателя возникнет неправильное представление, что критические явления нельзя понять без уравнения Ван-дер-Ваальса.
2. Для нахождения критических параметров Р k , Vk , Tk , учтем, что в критической точке уравнение (100.1) переходит в
Pk V 3 – (RTk + Pk b )V 2 + aV – ab = 0.
Поскольку в этом случае все три корня совпадают и равны Vk , уравнение должно приводиться к виду
Pk (V – Vk )3 = 0.
Возводя в куб и сравнивая коэффициенты, получим три уравнения:
Pk Vk 3 = ab , 3Pk Vk 2 = a , 3Pk Vk = RTk + Pk b .
Решая их, найдем
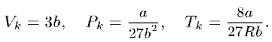 (100.2)
(100.2)
К тем же результатам можно прийти, заметив, что критическая точка K является точкой перегиба изотермы, касательная в которой горизонтальна, а потому в точке K должны соблюдаться соотношения
(100.3)
Решая эти уравнения совместно с уравнением изотермы (98.6), снова приведем к формулам (100.2).
Отношение Kk = RTk /Pk Vk называется критическим коэффициентом . Согласно уравнению Ван-дер-Ваальса критический коэффициент равен
(100.4)
В действительности критические коэффициенты для реальных газов имеют различные значения, и все они больше 8/3, как показывает табл. 10.
Таблица 10

Критическая температура, по Ван-дер-Ваальсу, связана с температурой Бойля (98.12) соотношением
(100.5)
Качественно это соотношение согласуется с опытом. Числовой коэффициент в соотношении между Т B и Т k , измеренный на опыте, оказался равным для гелия 3,5, водорода 3,3, азота 2,4.
3. Примем в качестве единиц объема, давления и температуры критические значения этих величин. Объем, давление и температура, измеренные в таких единицах, называются приведенными. Они определяются выражениями:
(100.6)
Уравнение состояния, записанное в этих безразмерных переменных, называется
приведенным уравнением состояния . Для газов Ван-дер-Ваальса из (1 00.2) находим
После подстановки этих выражений в уравнение Ван-дер-Ваальса оно принимает вид
(100.7)
В этом виде уравнение состояния не содержит никаких индивидуальных констант вещества. Приведенные уравнения состояния одинаковы для всех веществ . Этот вывод обладает большей общностью, чем уравнение Ван-дер-Ваальса, из которого он был получен. Для справедливости вывода конкретный вид уравнения состояния не играет роли. Существенно только, что оно содержит три параметра: а , b и R . Всякое уравнение состояния, обладающее этим свойством, записанное в безразмерных величинах θ, π, η, должно быть также одинаковым для всех веществ. Это положение называется законом соответственных состояний . Соответственными называются такие состояния разных веществ, которые имеют одинаковые значения приведенных параметров θ, π и η. Из закона соответственных состояний следует, что если для различных веществ из трех параметров θ, π, η совпадают значения каких-либо двух, то будут совпадать и значения третьего параметра , т. е. эти вещества находятся в соответственных состояниях.
Изотермы реального газа. Правило Максвелла. Непрерывность газообразного и жидкого состояний вещества
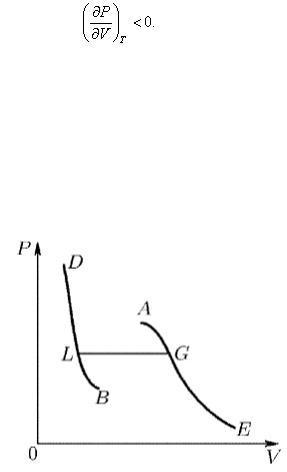
1. Не все состояния вещества, совместимые с уравнением Ван-дер-Ваальса, могут быть реализованы в действительности. Для этого необходимо еще, чтобы они были термодинамически устойчивы . Одно из необходимых условий термодинамической устойчивости физически однородного вещества состоит в выполнении неравенства
(101.1)
Физически оно означает, что при изотермическом уравнении давления объем тела должен уменьшаться. Иными словами, при возрастании V все изотермы должны монотонно опускаться. Между тем, ниже критической температуры на изотермах Ван-дер- Ваальса имеются поднимающиеся участки типа ВСА (см. рис. 98). Точки, лежащие на таких участках, соответствуют неустойчивым состояниям вещества, которые практически реализованы быть не могут. При переходе к практическим изотермам эти участки должны быть выброшены, как это и сделано на рис. 99.
Рис. 99
Таким образом, реальная изотерма распадается на две ветви EGA и BLD , отделенные друг от друга. Естественно предположить, что этим двум ветвям соответствуют различные агрегатные состояния вещества. Ветвь ЕА характеризуется относительно большими значениями объема или малыми значениями плотности; она соответствует газообразному состоянию вещества . Напротив, ветвь BD характеризуется относительно малыми объемами, а следовательно, большими плотностями; она соответствует жидкому состоянию вещества .
Мы распространяем, следовательно, уравнение Ван-дер-Ваальса и на область жидкого состояния. Таким путем удается получить удовлетворительное качественное описание явления перехода газа в жидкость и обратно.
2. Возьмем достаточно разреженный газ при температуре ниже критической. Исходное состояние его на диаграмме VР изображается точкой Е (рис. 99). Будем сжимать газ квазистатически, поддерживая температуру Т по изотерме вверх. Можно было бы думать, что она достигает крайнего положения А , где изотерма обрывается. В действительности, однако, начиная с некоторой точки G , давление в системе перестает повышаться, и она распадается на две физически однородные части , или фазы : газообразную и жидкую.
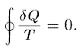
Процесс изотермического сжатия такой двухфазной системы изображается участком GL горизонтальной прямой. При этом во время сжатия плотности жидкости и газа остаются неизменными и равными их значениям в точках L и G соответственно. По мере сжатия количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе — увеличивается, пока не будет достигнута точка L , в которой все вещество перейдет в жидкое состояние.
Такой ход изотерм впервые был обнаружен на опыте в конце XVIII века голландским ученым ван Марумом (1750–1837). Ван Марум провел серию опытов с целью проверки закона Бойля-Мариотта. Одним из исследуемых газов был аммиак. С увеличением давления объем газа сначала уменьшался обратно пропорционально давлению, как того требовал закон Бойля-Мариотта. Однако когда давление достигло 7 атм, оно неожиданно переставало расти при дальнейшем сжатии, хотя объем и продолжал уменьшаться. При давлении 7 атм происходило сжижение газообразного аммиака. Начиная с этого момента, сжатие вещества приводило лишь к увеличению количества жидкого и уменьшению газообразного аммиака.
После ван Марума последовали многочисленные попытки путем сжатия газов перевести их в жидкое состояние. Особенно больших успехов в этом направлении достиг Фарадей (1791–1867). Он применял комбинированный метод, сочетая сжатие газа с его охлаждением. Однако все эти исследования производились вслепую. Оставалось неясно, почему при сжатии одних газов происходит сжижение, а других — нет. Влияние охлаждения и сама возможность сжижения газов не были ясны. Положение разъяснилось после классических работ английского физика Томаса Эндрюса (1813–1885), выполненных в течение 1861–1869 гг. Эндрюс систематически исследовал ход изотерм углекислоты (СО2 ) при различных температурах и на основе этих исследований ввел понятие критической температуры. Углекислота им была выбрана сознательно, так как она обладает критической температурой (31 °С), лишь незначительно превышающей комнатную, и сравнительно невысоким критическим давлением (72,9 атм). Оказалось, что при температуре выше 31 ° С изотермы углекислоты монотонно опускаются вниз, т. е. имеют гиперболический вид. Ниже этой температуры на изотермах углекислоты появляются горизонтальные участки, на которых изотермическое сжатие газа приводит к его конденсации, но не к увеличению давления. Таким путем было установлено, что
сжатием газ можно превратить в жидкость только тогда, когда его температура ниже критической. Но это невозможно сделать никаким повышением давления, если температура газа выше критической.
3. Положение горизонтального участка изотермы GL легко определить, пользуясь термодинамическим равенством Клаузиуса
(101.2)
Для этого заметим, что из состояния G (см. рис. 98) вещество можно перевести в состояние L двумя изотермическими процессами: по изотерме GCL двухфазного состояния вещества и по теоретической изотерме физически однородного вещества GACВL , содержащей неустойчивый участок АСВ . Применим равенство Клаузиуса к квазистатическому круговому процессу GCLBCAG . Это — изотермический процесс, а
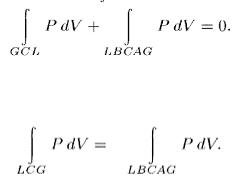
потому равенство Клаузиуса принимает вид  Кроме того, δQ = dU + РV ,
Кроме того, δQ = dU + РV ,
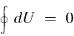 , так что
, так что 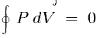 , или
, или
Это соотношение можно переписать так:
Отсюда следует, что площадь прямоугольника QLGR должна быть равна площади криволинейной фигуры QLBGAGR . Значит, прямую GCL надо провести так, чтобы равнялись площади GACG и СBLС , заштрихованные на рис. 98. Это правило называется
правилом Максвелла .
4. Если за исходное состояние вещества взять жидкое (точка D на изотерме), то при изотермическом расширении точка, изображающая его состояние, будет перемещаться вниз по изотерме, пока она не достигнет положения L , начиная с которого появится новая
— газообразная — фаза. Дальнейший изотермический процесс расширения двухфазной системы пойдет вдоль горизонтального участка изотермы L C G . В точке G все вещество перейдет в газообразное состояние. Затем изотермическое расширение идет по участку изотермы GE, причем вещество все время остается в газообразном состоянии.
При специальных условиях могут быть реализованы состояния, изображаемые участками изотермы GА и BL . Эти состояния называются метастабильными. Участок GA изображает так называемый пересыщенный пар, участок BL — перегретую жидкость . Обе фазы обладают ограниченной устойчивостью. Каждая из них может существовать до тех пор, пока она не граничит с другой, более устойчивой фазой. Например, пересыщенный пар переходит в насыщенный, если в него ввести каплю жидкости. Перегретая жидкость закипает, если в нее попадают пузырьки воздуха или пара ).
5. На рис. 100 схематически изображено семейство реальных изотерм. Жирная кривая ALKG соединяющая концы горизонтальных участков изотерм, делит плоскость VP на две области. Область между кривой ALKG и изобарой Р = 0 соответствует двухфазным состояниям вещества . Это значит, что каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного пара. Ниже изобары Р = 0 двухфазное состояние невозможно, так как давление пара не может быть меньше нуля. Область над кривой ALKG и ниже изобары Р = 0, напротив, соответствует однофазным состояниям . Каждая точка этой области изображает состояние физически однородного вещества. Впрочем, точки под граничной кривой ALKG , наряду с двухфазными состояниями вещества, могут изображать и однофазные состояния, которым соответствуют теоретические изотермы, имеющие волнообразный характер. Это, во-первых, метастабильные состояния —
перегретая жидкость и пересыщенный пар . Во-вторых, это абсолютно неустойчивые состояния, которым соответствуют поднимающиеся участки теоретических изотерм.
Такие состояния могут играть роль только в теоретических рассуждениях, подобных тем, которые применялись при доказательстве правила Максвелла.
Рис. 100
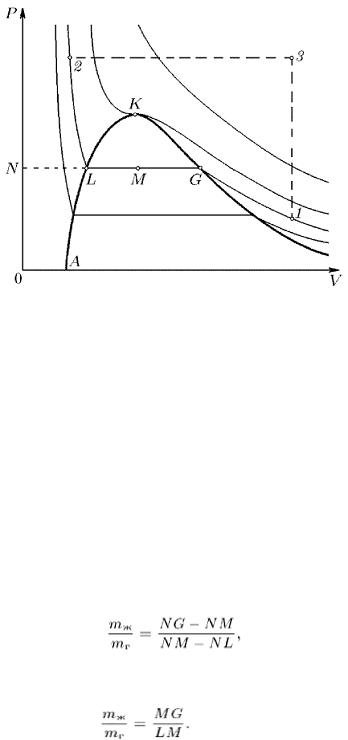
6. Возьмем в двухфазной области какую-либо точку М (рис. 100). Вещество, состояние которого изображается этой точкой, состоит из жидкости и газа. Определим относительное содержание этих фаз. Для простоты будем предполагать, что масса взятого вещества равна единице. Тогда удельные объемы жидкости и газа изобразятся длинами отрезков NL и NG соответственно, а объем всего вещества V M — длиной отрезка NM . Если масса газа равна т г , а жидкости — m ж , то
VM = NM = т ж МЬ + m r NG .
Так как т ж + т г = 1, то это соотношение можно переписать в виде
(m ж + m г )NM = m ж NL + m г NG .
Отсюда
или
(101.3)
Таким образом, точка М делит отрезок LG на части LM и MG , обратно пропорциональные массам жидкости и газа. Этот результат называется правилом рычага .
7. Рассматривая рис. 100, можно прийти к важному принципиальному заключению. Пусть начальное состояние газа изображается точкой 1 при температуре ниже критической. Будем изотермически сжимать газ. В точке G начнется превращение его в жидкость. Этот процесс закончится в точке L . При дальнейшем сжатии по изотерме L2 вещество будет оставаться все время жидким. Мы перевели вещество из газообразного
состояния 1 в жидкое 2 и имели возможность наблюдать, где начинается и как происходит это превращение . Но можно тот же переход произвести иначе. Нагреем газ при постоянном объеме, чтобы его температура и давление стали выше критических (прямая 13 ). Затем, оставляя давление постоянным, охладим газ ниже критической температуры (прямая 32 ). Мы придем в то же состояние 2 , т. е. сконденсируем газ в жидкость. Однако при этом вещество все время будет оставаться физически однородным, свойства его будут меняться непрерывно, и не имеет смысла говорить, что в какой-то момент произошла конденсация .
Начальное и конечное состояния 1 и 2 физически однородного вещества в однофазной области можно выбрать каким угодно. Переход из одного состояния в другое может быть произведен вдоль произвольной кривой, соединяющей точки 1 и 2 . Если эта кривая пересекает двухфазную область, то будет нарушаться физическая однородность вещества — вещество разделится на жидкость и газ. При выходе из двухфазной области вещество снова станет физически однородным и останется таковым в конечном состоянии 2 . Если же кривая перехода обходит двухфазную область, то никаких скачкообразных превращений вещества из газа в жидкость или обратно наблюдаться не будет — вещество все время будет оставаться физически однородным. Такое поведение вещества было установлено Эндрюсом путем анализа экспериментальных изотерм углекислоты. Когда состояние вещества изображается точкой над граничной кривой ALKG , то, согласно Эндрюсу, различие между жидкостью и газом будет только количественным, нo не качественным . Вещество из одного состояния можно перевести в другое непрерывно. Именно это имеют в виду, когда, следуя Ван-дер-Ваальсу, говорят о непрерывности жидкого и газообразного состояний вещества . Только в области под граничной кривой
ALKG , где вещество распадается на две фазы, отделенные одна от другой границей раздела и обладающие различными физическими свойствами, физически оправдано различать жидкое и газообразное состояния вещества.
8. Теория Ван-дер-Ваальса, которую мы излагали выше, при всей ее простоте дает стройную, качественно верную картину поведения вещества при его превращениях из жидкого состояния в газообразное и обратно. Она впервые привела в систему запутанные явления, связанные с такими превращениями. Невольно испытываешь чувство восхищения перед простотой и красотой теории, охватывающей столь громадный круг явлений. И тем не менее мы еще очень далеки от полного физического понимания этих явлений. В наиболее интересной области сильно сжатых газов и жидкостей, включая область двухфазных состояний вещества, уравнение Ван-дер-Ваальса не только не обосновано теоретически, но даже приводит к значительным количественным расхождениям с опытом. Теория Ван-дер-Ваальса может быть охарактеризована как термодинамическая теория, основанная на уравнении состояния, которое является результатом экстраполяции теоретических и экспериментальных данных. Между тем, всякая последовательная молекулярная теория должна без привлечения каких бы то ни было добавочных соображений дать полную количественную и качественную картину поведения вещества и, в частности, его фазовых превращений. Такой физической теории пока еще нет.
Свойства вещества в критическом состоянии. Определение критических параметров
1. Понятие критической температуры и критического состояния, как уже указывалось выше, было введено Эндрюсом на основе исследования экспериментальных изотерм углекислоты (СО2 ). Предшественниками Эндрюса были Каньяр де ля Тур (1776– 1859) и Д. И. Менделеев (1834–1907). Каньяр де ля Тур в 1822 г. заметил, что кварцевый шарик, помещенный в запаянную с обоих концов толстую металлическую трубу,

заполненную спиртом, перекатывался в ней, почти не встречая сопротивления, когда труба была нагрета выше определенной температуры. С целью сделать явление видимым Каньяр де ля Тур повторил опыт, заменив металлическую трубу запаянными толстостенными стеклянными трубками, заполненными различными жидкостями. Оказалось, что указанное явление наступает при температуре исчезновения видимой границы раздела между паром и жидкостью. На основе таких опытов Каньяр де ля Тур пришел к заключению, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. К аналогичному заключению пришел и Д. И. Менделеев в 1861 г. Он заметил, что при определенной температуре прекращалось поднятие жидкости в капиллярах, т. е. поверхностное натяжение обращалось в нуль. При той же температуре обращалась в нуль скрытая теплота парообразования. Такую температуру Менделеев назвал температурой абсолютного кипения . Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления.
2.Критическую точку К мы определим как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна . Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической (см. рис. 100). На этом основан способ определения
критических параметров Pk , Vk , Тk , принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG переходит в точку, будет критической изотермой, а указанная точка — критической точкой. Недостаток способа Эндрюса заключается в его громоздкости.
3.Значительно более простым является метод исчезновения мениска, по существу принадлежащий Каньяру де ля Туру. Берется стеклянная или кварцевая ампула, частично заполненная жидкостью. Воздух из ампулы удаляется кипячением, а затем ампула запаивается. После этого ампула будет заполнена физически неоднородным веществом, состоящим из жидкости и ее насыщенного пара, отделенными друг от друга резкой видимой границей, называемой мениском (рис. 101).
Рис. 101
Для демонстрации подходящими веществами могут служить жидкая углекислота (tk = 31 °С, Pk = 72,9 атм) или эфир (tk = 194 °С, Pk = 35 атм). Заполненная ампула помещается в печь и нагревается. Для равномерности нагрева воздух в печи интенсивно перемешивается. Тепловым расширением стенок ампулы можно пренебречь, так что процесс нагревания происходит практически при постоянном объеме. Допустим, что количество вещества подобрано так, что точка 1 , изображающая начальное состояние его, лежит на вертикальной прямой 1 K , проходящей через критическую точку K (рис. 102).
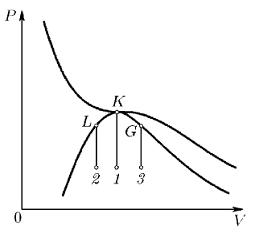
Рис. 102
По мере нагревания изображающая точка перемещается вверх, оставаясь на прямой 1 K . Пока температура ниже критической, мениск виден отчетливо. При нагревании мениск остается практически на одной и той же высоте. При приближении к критической температуре кривизна мениска непрерывно уменьшается из-за уменьшения поверхностного натяжения на границе между жидкостью и ее насыщенным паром. Мениск становится плоским и, наконец, совсем исчезает, когда температура достигнет критического значения Т k . Начиная с этого момента, вещество становится физически однородным и продолжает оставаться таковым при дальнейшем нагревании. При обратном охлаждении вещество продолжает оставаться физически однородным, пока его температура выше критической. При прохождении через критическую точку K снова происходит разделение вещества на две фазы. Образуются мелкие капельки тумана, вещество становится мутным. Капельки быстро оседают, и снова появляется мениск, разделяющий жидкость и пар.
4. Допустим теперь, что жидкости в ампулу налито больше, «чем нужно». Тогда точка, изображающая состояние вещества, будет при нагревании перемещаться из начального положения 2 вдоль вертикальной прямой 2L (рис. 102). В положении L , когда температура еще ниже критической, все вещество превратится в жидкость. Поэтому казалось бы, что никакого исчезновения мениска при нагревании происходить не должно. Мениск будет просто монотонно перемещаться вверх ампулы. Когда он достигнет верхнего конца ампулы, последняя окажется целиком заполненной однородной жидкостью. Аналогичное явление должно было бы происходить и в том случае, когда жидкости налито меньше, «чем нужно». Из исходного положения 3 изображающая точка при нагревании должна перемещаться вверх вдоль вертикальной прямой 3G . В точке G , т.е. еще до достижения критической температуры, все вещество перейдет в газообразное состояние. Опять, казалось бы, никакого исчезновения мениска на границе между жидкостью и паром наблюдаться не должно. Мениск просто должен был бы перемещаться вниз и исчезать на дне ампулы, когда температура еще не достигла критической.
Таким образом, казалось бы, что для наблюдения исчезновения мениска в ампулу должно быть налито строго определенное количество жидкости. Если бы это было так, то метод исчезновения мениска практически нельзя было бы осуществить. В действительности дело обстоит совсем не так. Для исчезновения мениска вовсе не обязательно наполнять ампулу строго определенным количеством жидкости. Исчезновение мениска наблюдается при любом количестве жидкости в ампуле, если только оно не очень сильно отклоняется от того количества, «которое требуется». Дело в
