
Физика_лек_pdf / Модуль 4. Основы термодинамики. Реальные газы, жидкости и твердые тела
.pdf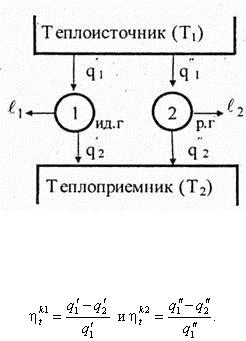
Поэтому ни один тепловой двигатель, и в том числе паровой, не работает по циклу Карно. Однако теоретические циклы по совершенству использования теплоты оцениваются степенью приближения их термического КПД к значению термического КПД предельного цикла Карно.
Теорема Карно
При получении формулы для термического КПД обратимого цикла Карно были использованы соотношения, справедливые только для идеального газа. Поэтому для того, чтобы можно было распространить все сказанное о цикле Карно на любые реальные газы и пары, необходимо доказать, что термический КПД цикла Карно не зависит от свойств рабочего тела, при помощи которого он осуществляется. Это и является содержанием теоремы Карно. Для доказательства этой теоремы предполагается, что два двигателя работают по обратимому циклу Карно с различными рабочими телами. У двигателя 1 рабочее тело — идеальный газ, у двигателя 2 — пар. Оба двигателя имеют общий теплоисточник с температурой T 1 и теплоприемник с температурой Т 2 (рис. 6.28). Пусть газовый и паровой двигатели получают соответственно теплоту q '1 и q "1 а отдают теплоприемнику: газовый — q '2 , паровой — q "2 .
Рис. 6.28
Коэффициенты полезного действия этих двигателей соответственно равны
Они будут равны при q ' 2 Доказывается это методом от противного, в результате чего получается неожиданный вывод: экономичность теплового двигателя не зависит от свойств рабочего тела. Иными словами: термический КПД обратимого цикла Карно не зависит от вида рабочего тела и является только функцией температур теплоисточника и теплоприемника.
Закон возрастания энтропии
В физике большинство понятий следуют из жизненного опыта. Поэтому они воспринимаются нашим воображением и представляются достаточно простыми. Однако приходится встречаться с другими понятиями, которые не имеют аналогов в повседневности. К понятиям такого рода относится, прежде всего, энтропия. Понимание энтропии дается с большим трудом. с целью аналитического вывода закона возрастания энтропии последовательно рассмотрим:
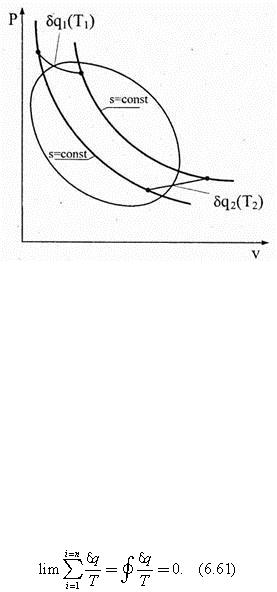
1. Обратимый цикл Карно. Известно, что эффективность прямого обратимого цикла Карно оценивается равенством ηt k = 1 – q 2 /q 1 = 1 – Т 2 /Т 1 , из которого следует q 2 /q 1 = Т 2 /Т 1 или q 1 /T 1 – q 2 /T 2 = 0. Так как отводимая теплота считается отрицательной, то q 1 /T 1 – (– q 2 /T 2 ) = 0 и ∑е (q /T ) = 0. Это значит, что в обратимом цикле Карно алгебраическая сумма приведенных теплот в изотермических процессах равна нулю. Это свойство обратимого цикла Карно остается справедливым для любого произвольного обратимого цикла.
Рис. 6.29
2. Произвольный обратимый цикл. Для доказательства высказанного только что утверждения произвольный обратимый цикл (рис. 6.29) разобьем адиабатами на большое количество элементарных циклов. В каждом из таких циклов элементарные произвольные обратимые процессы между адиабатами заменим обратимыми изотермами, соблюдая условия равенства площадей. Тогда вместо произвольного обратимого Цикла получим множество элементарных циклов Карно. В i -ом бесконечно малом цикле Карно
подводится теплота q 1 при |
расширении газа по изотерме T 1 , и отводится — q 2 при |
сжатии газа по изотерме T |
2 . КПД этого элементарного обратимого Цикла Карно |
определяется тем же равенством, что и в п. 1: ηt k = 1 – q 2 /Δq 1 = 1 – Т 2 /Т 1 из которого |
|
следует q 2 /Δq 1 |
= Т 2 /Т 1 или q 1 |
/T 1 – q 2 /T 2 = 0. |
Так как отводимая теплота |
отрицательна, то |
q 1 /T 1 – (– q 2 /T 2 |
) = 0 и ∑е (Δq /T ) = |
0. Если число п бесконечно |
малых циклов Карно стремится к бесконечности, то в пределе получим
Знак 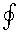 означает интегрирование по замкнутому контуру. Уравнение (6.61) получено Р. Клаузиусом и называется первым интегралом Клаузиуса. Таким образом, интегральная сумма приведенных теплот для любого обратимого цикла равна нулю. подынтегральное отношение q /T представляет собой полный дифференциал некоторой функции, которая зависит только от состояния системы. Р. Клаузиус назвал ее энтропией, то есть q /T = ds . И следовательно
означает интегрирование по замкнутому контуру. Уравнение (6.61) получено Р. Клаузиусом и называется первым интегралом Клаузиуса. Таким образом, интегральная сумма приведенных теплот для любого обратимого цикла равна нулю. подынтегральное отношение q /T представляет собой полный дифференциал некоторой функции, которая зависит только от состояния системы. Р. Клаузиус назвал ее энтропией, то есть q /T = ds . И следовательно
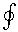 (δq /T ) =
(δq /T ) = 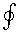 ds = 0. (6.62)
ds = 0. (6.62)

3. Необратимый цикл. Если цикл необратим, то в нем имеют место потери теплоты. Термический КПД такого цикла будет меньше термического КПД обратимого цикла
Карно, протекающего при тех же температурах теплоисточника Т 1 и теплоприемника Т 2 , то есть ηt необр < ηt k или (1 – q 2 /q 1 ) < (1 – Т 2 /Т 1 ). Из неравенства следует q 2 /q 1 > Т 2 /Т 1
или (q 1 /T 1 – q 2 /T 2 ) < 0. Так как отводимая теплота отрицательна, то (q 1 /T 1 + q 2 /T 2 ) < 0. Просуммировав, будем иметь
∑(q /T ) < 0.
Таким образом, алгебраическая сумма приведенных теплот в необратимом цикле меньше нуля.
Полученное свойство необратимого цикла справедливо для любого произвольного необратимого цикла, что доказывается так же, как и в позиции 2 настоящего пункта, и записывается неравенством
Следовательно, интегральная сумма приведенных теплот, взятая по контуру произвольного необратимого цикла, меньше нуля. Неравенство (6.63) называют вторым интегралом Клаузиуса.
Обобщая результаты (формулы (6.61) и (6.63)) проведенного анализа произвольных циклов, получим
Знак равенства соответствует обратимым циклам, знак неравенства — необратимым. Формула (6.64) представляет общую математическую формулировку второго закона термодинамики.
4. Необратимый цикл, состоящий из необратимого и обратимого процессов. Пусть даны два состояния 1 и 2 системы соответственно с энтропией s 1 и s 2 (рис. 6.30). Переведем систему из состояния 1 в состояние 2 необратимо по траектории 12, а затем возвратим ее в первоначальное состояние 1 обратимо по пути 21.
Рис. 6.30
Цикл 121 является необратимым и согласно формуле (6.63) можно сделать следующую запись
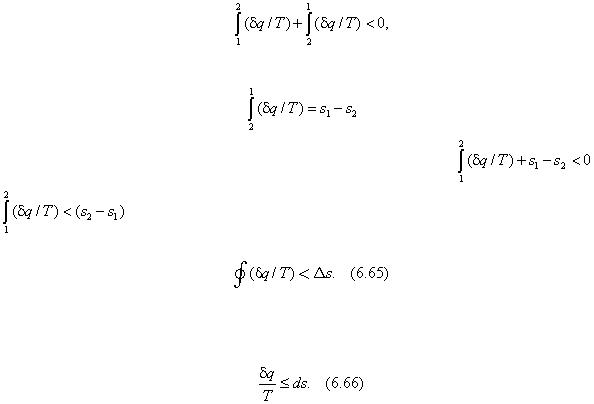
но для обратимого процесса при переходе из состояния 2 в состояние 1 имеем в
соответствии с формулой 6.62 |
. С учетом |
полученного |
значения |
криволинейного интеграла предыдущее неравенство примет вид |
|
или |
|
. Отсюда для необратимого процесса по замкнутому контуру |
|
||
Объединив формулы (6.64) и (6.65), имеем 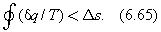 , или
, или
Для изолированных систем, которые не взаимодействуют с окружающей средой не только веществом и работой, но и теплотой, то есть когда q = 0, получим закон возрастания энтропии
ds ≥ 0.
Формулируется он следующим образом: при всех обратимых процессах в изолированной системе энтропия ее остается неизменной; при всех необратимых процессах энтропия системы только возрастает.
Вспомним, что обратимые процессы состоят из непрерывной смены состояний равновесия и происходят бесконечно медленно. Обратимые процессы называют также идеальными. Реальные процессы протекают с конечной скоростью и поэтому необратимы. Какими бы сложными ни были процессы в изолированной системе, общая направленность их такова, что суммарная энтропия системы убывать не может. Энтропия изолированной системы не может быть уничтожена. После завершения всех необратимых процессов будет достигнуто такое состояние системы, когда в ней не удастся осуществить ни одного необратимого процесса. Рост энтропии прекратится. Энтропия достигла максимального значения. Именно поэтому одной из формулировок второго закона термодинамики является формулировка Р. Клаузиуса: «Энтропия изолированной системы стремится к
максимуму».
Возрастание энтропии изолированной системы при необратимых процессах сопровождается рассеянием энергии, равномерным распределением температуры, давления и других параметров в системе. В результате диффузии наступает выравнивание концентраций в отдельных частях системы и т.д. Таким образом, в результате всех необратимых процессов система перерождается, или, как говорят, деградирует. Итогом всех изменений является состояние системы, при котором всякий повод к дальнейшему изменению системы отсутствует и в системе возможны лишь обратимые изменения.
Сказанное справедливо для макросистем конечных размеров. Однако, как уже известно, нельзя распространять этот вывод на всю Вселенную, как это сделал Р. Клаузиус, а в наши дни И. Пригожий.
Элементы неравновесной термодинамики
Неравновесные процессы, как известно, необратимы, и поэтому в литературе, говоря об одном и том же, используют словосочетания: неравновесная термодинамика или термодинамика необратимых процессов.
В классической термодинамике отсутствует понятие времени. Термодинамические процессы в ней рассматривают как квазистатические в виде цепочки незаметных переходов из одного состояния равновесия в другое. Скорость таких процессов считается очень малой. Вышеизложенным нарушается смысл термина «термодинамика» как движущей силы теплоты. Более подходящим названием этой науки было бы «термостатика».
Разработка общей термодинамической теории неравновесных (необратимых) процессов, которая позволит установить изменение параметров состояний систем во времени, трудна и далека от завершения. Пока создана теория необратимых процессов систем с небольшим отклонением от состояния равновесия в данной точке пространства и времени. Чтобы получить представление о тематике термодинамики неравновесных процессов, рассмотрим следующий пример закрытой двухкомпонентной системы. В систему поступает и уходит стационарный градиент температуры и градиент концентрации раствора. Требуется установить связь между градиентами. Задача не может быть решена методами классической термодинамики, так как рассматриваемое состояние системы является только стационарным, но не равновесным.
Имеется большое количество необратимых явлений, неравновесность процессов в которых выражается линейными соотношениями между причиной и следствием. Например, законом Ома о пропорциональности плотности тока удельной
электропроводности γg и разности потенциалов, |
отнесенной к расстоянию |
между |
контрольными поверхностями, J е = γg ( θ/Δ); |
законом теплопроводности Фурье о |
|
пропорциональности теплового потока коэффициенту теплопроводности и разности температур, отнесенной к толщине стенки, J T = λl (ΔТ /Δ); законом диффузии Фика о пропорциональности потока массы данного компонента смеси коэффициенту диффузии и разности его концентрации, отнесенной к расстоянию между контрольными поверхностями, J m = D ( C / ) и т. д.
В реальных условиях одни явления вызывают появление других. Так, явление теплопроводности в разнородной цепи приводит к возникновению термоэлектричества (тепловая энергия переходит в электрическую). Теплопроводность приводит также к термодиффузии (тепловая энергия переходит в механическую). При термодиффузии поток массы поддерживается за счет разности концентраций и за счет разности температур: J m , T = D ( C / ) + λl ( T / ). Теория таких необратимых процессов разработана Л. Онзагером в 1931 г.
Причины, вызывающие необратимые процессы, называют термодинамическими силами и обозначают Xi (i = 1, 2, ...). К ним относятся С /Δ, T /Δ, Δθ/Δ и др. Термодинамические силы определяют скорости изменения соответствующих параметров, состояния С , T , Δθ.

Теория Онзагера обобщает классическую термодинамику с линейными закономерностями указанных выше необратимых процессов. Так, к локально равновесным частям термодинамической системы применяют уравнение первого закона термодинамики в дифференциальной форме.
где ds , du , δl ф относятся к элементарному объему; θi — химический потенциал i -й компоненты системы; dvni — изменение числа молей i -й компоненты. Допускают, что энтропия, как и при равновесии, зависит от параметров состояния, а через них от времени и координат, и по прежнему является аддитивной величиной. К уравнению первого закона термодинамики добавляют три зависимости: линейный закон, уравнение возникновения энтропии и соотношения взаимности.
Линейный закон заключается в том, что вблизи от равновесия системы поток Ji пропорционален термодинамической силе
Коэффициенты Lik называют кинетическими или феноменологическими. Они характеризуют проводимость системы по отношению к соответствующему потоку. Определяют их опытным путем. При этом Lii может быть коэффициентом электроили теплопроводности, диффузии и т.п., a Lik при i ≠ k — коэффициентом термоэлектричества, коэффициентом термодиффузии и т.п.
Если в системе существует одновременно поток теплоты JT и поток массы Jm ,
вызванный диффузией, то. JT = J 1 = L 11 X 1 + L 12 X 2 и Jm = J 2 = L 22 X 2 + L 21 X 1 , где X 1 и X 2 — термодинамические силы, величина которых пропорциональна соответственно
разности температур и разности концентраций; L 11 и L 22 — кинетические коэффициенты теплопроводности L 11 = λl и диффузии L 22 = D ; L 12 и L 21 — кинетические коэффициенты, учитывающие влияние сил X 1 и Х 2 на величины соответственно потоков теплоты J 1 и массы J 2 . Справедливость уравнений подтверждена экспериментом.
При протекании потоков энтропия системы возрастает. Приращение энтропии в единицу времени на единицу объема системы выражается уравнением возникновения энтропии, называемым теоремой Пригожина. Согласно теореме при постоянных кинетических коэффициентах Lik между потоками J и силами X , с одной стороны, и скоростью изменения энтропии — с другой, в необратимых процессах существует следующая зависимость:
С помощью настоящего уравнения оценивается степень необратимости неравновесных процессов и осуществляется выбор соответствующих потоков и сил.
Соотношения взаимности Онзагера существуют при соблюдении линейного закона и теоремы Пригожина. Они имеют вид
L ц = Lki (i , k = 1, 2, 3, … n )
и устанавливают равенство перекрестных кинематических коэффициентов между собой. Эти соотношения подтверждены опытом. Для сложных систем коэффициенты зависят от большого числа факторов, поэтому термодинамическое описание необратимых процессов математически довольно сложное.
Заманчивым представляется метод, который позволит изложить на единой основе равновесную и неравновесную термодинамику. Такие попытки имели место. Одна из них построена на теории информации. Она дала положительный результат, хотя метод крайне сложен для практического пользования.
Процесс адиабатного истечения газов. Уравнение Бернулли
Законы движения жидкостей и газов изучает гидромеханика. Жидкости и газы, как предмет изучения гидромеханики, обладают двумя основными свойствами: сплошностью и легкой подвижностью или текучестью. Текучесть есть физическая величина, обратная вязкости. Текучесть объединяет газ и жидкость. Поэтому газ и жидкость называют одним термином — жидкость. А когда хотят подчеркнуть их различие, то говорят о капельной и упругой жидкости. Для газообразного состояния в противоположность жидкому характерна способность занимать весь имеющийся объем. У газообразной фазы собственных границ не существует. И, кроме этого, газы по сравнению с жидкостями обладают довольно большой текучестью и, следовательно, малой вязкостью. Понятие вязкости определяет свойство жидкостей и газов оказывать сопротивление при их перемещении. В гидромеханике пользуются гипотетической моделью идеальной жидкости, для которой вязкость принимается равной нулю, а следовательно, ее текучесть
— бесконечно большой.
Гидромеханика не занимается изучением отдельных молекул и взаимодействия их между собой, а исходит из допущения, что пространство сплошным образом заполнено веществом. Условие сплошности для жидкостей и газов выполняется, если характерные линейные размеры, как, например, диаметр трубопровода, протяженность крыла самолета, велики в сравнении с параметрами (длиной свободного пробега молекул газа, амплитудой колебаний молекул жидкости и др.), определяющими движение молекул.
Различают вынужденное и свободное движение жидкости. В первом случае жидкость или газ движутся за счет действия внешнего источника — насоса, вентилятора, полета самолета. Свободное движение, называемое естественной конвекцией, возникает за счет разности плотностей нагретых и холодных объемов жидкости. Свободное движение имеет место в жидкости с переменной плотностью в случае, когда она находится в гравитационном поле. Вынужденное движение при небольших скоростях среды может сопровождаться свободным движением. При этом относительное влияние свободного движения пропорционально разности температур отдельных объемов жидкости и обратно пропорционально скорости вынужденного движения.
До сих пор рассматривались процессы изменения состояния газа, при которых не принималось во внимание изменение его кинетической энергии. Однако в технике широко распространены процессы сжатия газа и производства работы за счет изменения кинетической энергии газа при движении с большими скоростями (более 100 м/с) по каналам переменного сечения. Такие процессы имеют место в компрессорах, турбинах, реактивных двигателях и т.д. Теория газовых потоков оформилась в виде самостоятельной дисциплины, называемой газовой динамикой (газодинамикой). Исторически сложилось так, что в связи с потребностями турбостроения, строительства и эксплуатации

авиационных двигателей задачи газодинамики стали излагаться в курсах технической термодинамики. Здесь будут рассмотрены простейшие случаи одномерного течения газа.
Рассмотрим уравнение первого закона термодинамики
δq = dh + δlp = dh – vdP = dh + dc 2 /2 + l T , Дж/кг
в условиях адиабатного течения газа по каналу, это значит, что δq = 0. И поскольку в канале нет вала вращения, то и δl 0 = 0. С учетом этого предыдущее уравнение можно записать в виде:
δlp = –vdP = dc 2 /2 = –dh , Дж/кг.
Отсюда следует уравнение Бернулли:
–vdP = cdc . (6.67)
Понятия сопла и диффузора. Основные закономерности течения газа в соплах и диффузорах
При анализе потоков делаются следующие допущения:
1.Поток считается стационарным (установившимся), когда параметры потока в конкретной точке постоянны во времени.
2.Поток считается одномерным, когда изменение его параметров имеет место только по оси потока. Это значит, что в каждом сечении потока параметры его одинаковы
ипостоянны.
3.Поток удовлетворяет условию неразрывности или, что то же самое, сплошности:
или
m = ρf с , кг/с,
где f , с , v , ρ — соответственно площадь сечения канала, скорость, удельный объем и плотность газа в сечении. Физическую величину т , кг/с, называют массовым расходом. Широко используется еще понятие объемного расхода V = т · v , м3 /с. Из уравнения сплошности следует, что массовый или объемный расход есть величина постоянная для любого сечения канала.
4. Поток удовлетворяет условию адиабатного течения. При условии т = const продифференцировав выражение (6.68), получим mdv = fdc + cdf . Разделив полученное равенство на соотношение (6.68), получим
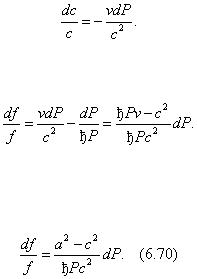
Формула (6.69) неудобна при анализе геометрии канала и характера изменения параметров потока. Поэтому ее преобразуют к иному виду, используя для этого уравнение адиабаты в виде Pv к = const и уравнение Бернулли в форме (6.67).
Продифференцируем уравнение адиабаты:
к Pv к –1 dv + v к dP = 0.
Разделив на v к , получим 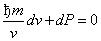 и
и 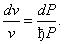
Разделив уравнение Бернулли на с 2 , получим
Подставим полученные dv /v и dc /c в формулу (6.69) и получим
Так как скорость звука в идеальном газе равна  , то предыдущее соотношение окончательно запишем в виде
, то предыдущее соотношение окончательно запишем в виде
Проанализируем формулу (6.70) для сопловых каналов, когда dc > 0, a dP < 0:
1. 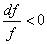 — сужающееся сопло. При этом (а 2 – с 2 ) > 0, с < а .
— сужающееся сопло. При этом (а 2 – с 2 ) > 0, с < а .
2. 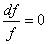 — канал постоянного сечения. Или как сечение перехода от сужающейся части канала к расширяющейся и наоборот. При этом (а 2 – с 2 ) = 0, с = а .
— канал постоянного сечения. Или как сечение перехода от сужающейся части канала к расширяющейся и наоборот. При этом (а 2 – с 2 ) = 0, с = а .
3. 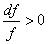 — расширяющееся сопло. При этом (а 2 – с 2 ) < 0, с > а .
— расширяющееся сопло. При этом (а 2 – с 2 ) < 0, с > а .
Проанализируем формулу (6.67) для диффузорных каналов, когда dc < 0, a dP > 0:
1. 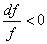 — сужающийся. При этом (а 2 – с 2 ) < 0, с > а .
— сужающийся. При этом (а 2 – с 2 ) < 0, с > а .

2. 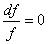 — канал постоянного сечения. Или как сечение перехода от сужающейся части канала к расширяющейся или наоборот. При этом (а 2 – с 2 ) = 0, с = а .
— канал постоянного сечения. Или как сечение перехода от сужающейся части канала к расширяющейся или наоборот. При этом (а 2 – с 2 ) = 0, с = а .
3. 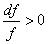 — расширяющийся диффузор. При этом (а 2 – с 2 ) > 0, с < а .
— расширяющийся диффузор. При этом (а 2 – с 2 ) > 0, с < а .
Сужающийся канал будет сопловым, если начальная скорость потока меньше начальной скорости звука, рис. 6.31. При другом начальном соотношении с 1 и а 1 (с 1 ≥ а 1 ) канал будет диффузорным.
Расширяющийся канал будет работать как сопло, если начальная скорость потока равна или больше начальной скорости звука, в противном случае канал будет работать как диффузор, рис. 6.32.
Рис. 6. 31 |
Рис. 6. 32 |
Основной характеристикой сжимаемости газа служит число Маха М = с /а , где с и а
— местная (локальная) скорость соответственно газа и звука. Если число М мало, газ можно считать несжимаемым и применять к нему следует законы гидродинамики. С увеличением числа Маха влияние сжимаемости на характер течения газа становится все основательнее. При М > 1 в упругой среде при обтекании потоком препятствия возникают возмущения, а при непрерывной пульсации скорости и давления — скачки уплотнения и ударные волны. Учет всех обстоятельств, определяющих характер течения газа, крайне непрост.
Цит. по: Физика: учебник / Демидченко В.И. — Ростов н/Д: Феникс, 2006. — С. 99–173.
Тема 2. Реальные газы, жидкости и твердые тела
Реальные газы
При давлениях газа существенно больших барометрического (более 30 · 105 Па) и низких температурах собственным объемом молекул нельзя пренебрегать, так как расстояния между молекулами при этом оказываются соизмеримыми с размерами самих молекул. На этих расстояниях проявляют себя силы межмолекулярного взаимодействия. Природа сил электрическая. Это взаимодействие проявляется в виде одновременно действующих сил взаимного притяжения — F п и взаимного отталкивания — F о . Условно принято считать силы отталкивания положительными, а силы взаимного притяжения — отрицательными. При указанном выборе знаков исходили из предположения о том, что
