
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
1.9. L`Acidité et la basicité des liaisons organiques
Pour l'estimation de l'acidité et de la basicité des liaisons organiques les deux théories ont la plus grande signification – la théorie de Brenstaide et la théorie de Luice.
Selon la théorie de Luice les fonctions acides et les fonctions basiques des liaisons sont définies par leur capacité à accepter ou rendre une paire des électrons avec la formation de la liaison.
Les acides de Luice – se sont l'atome, la molécule ou la cation, possédant l`orbitale vacante et capables d'accepter (admettre) une paire des électrons avec la formation de la liaison covalente.
Les acides de Luice – les accepteurs des paire des électrons; les fonctions basiques de Luice – les donneurs des paire des électrons. Les les fonctions basiques de Luice (l'atome, la molécule ou l'anion) doivent posséder au moins une paire des électrons, ils sont capables de l'accorder au partenaire pour la formation de la liaison covalente. Toutes les fonctions basiques de Luice représentent les réactifs nucléophiles.
Selon la théorie de Brenstaide (la théorie protolytique) l'acidité et la basicité des liaisons sont liées au transfert du proton Н +. L'acide et la fonction basique forment la paire conjuguée acido-basique, dans laquelle que l`acide est plus fort, la fonction basique conjuguée à elle est alors plus faible, et au contraire, plus la fonction basique est forte, l`acide est plus faible.
Les acides de Brenstaide (les acides protoniques) – les molecules ou les ions neutres, capable de rendre le proton (les donneurs des protons).
Les fonctions basiques de Brenstaide – les molécules ou les ions neutres, capable d'adjoindre (prendre) le proton (les accepteurs des protons).
L'acidité et la basicité ne sont pas des fonctions absolues, mais des fonctions relatives des liaisons : les fonctions acides se trouvent seulement en présence de la fonction basique ; les fonctions – seulement en présence de l'acide. Comme le dissolvant à l'étude des équilibres acido-basique on utilise d'habitude l'eau.
En fonction de la nature de l'élément, à qui est lié le proton, on distingue - les acides OH (les acides carboxyliques, les phénols, les alcools), les SH-acides (les mercaptans), NН-acides (les amines, les amides, les imides), les CH-acides (les hydrocarbures et leurs dérivées). L'élément et l'atome de l'hydrogène qui lui est accroché sont appellés comme le site acide. Dans tous les cas il y a un déplacement de la densité électronique de l'atome de l'hydrogène vers l'atome plus électronégatif, vers le proton. Plus le caractère électronégatif de l'élément, à qui est lié le proton est haut, plus l'acidité de la liaison est grande (ainsi, les acides carboxyliques sont de plus fortes acides, que les mercaptans ou les amines).
La présence dans la molecule des groupes catinoïdes possédant les effets négatifs électroniques augmente la charge positive sur le proton ce qui amène au renforcement des fonctions acides.
Pour la formation de la liaison covalente avec le proton, les fonctions basiques de Brenstaide doivent représenter une paire libre des électrons, ou bien les électrons de -liaison. Les fonctions basiques de Brenstaide sont divisés en n- fonctions basiques et - fonctions basiques.
n- fonctions basiques peuvent être neutre ou négativement chargé. En général, les anions possèdent le caractère basique mieux exprimé, que les substances neutres. C'est-à-dire l'amide-ion NН2–ou l`hydrate-ion HO - selon surpassent par la basicité l'ammoniaque NН3 et l'eau Н2О.
Dans les -fonctions basiques, à qui se rapportent les alcènes, les alcadiènes, les arènes, le centre de la basicité, c.a.d. la place de l'adjonction du proton, sont les électrons du -liaison. Ce sont des fonctions basiques très faibles, puisque протонируемые les paires électroniques protonés ne sont pas libres.
La présence des substituants donneurs augmente la basicité des liaisons organiques.
Les significations de рН de certains systèmes liquides de l'organisme.
Le fonctionnement normal des organismes vivants est probablement seulement dans les conditions de la constance définie рН et d'autres paramètres de leur milieu intérieur. Cette permanence est soutenue par les systèmes tampon correspondants.
Les tâches standartes et leur résolution
La tâche I. Les acides fumarique et cyc-aconitique sont les liaisons intermédiaires dans le cycle tricarbonique. Appelez ces liaisons selon la nomenclature internationale.
Н
 ООС
Н
НООС
СООН
ООС
Н
НООС
СООН
С = С С = С
Н СООН Н СН2 – СООН
L’acide fumarique l’acide cys-aconitique
La
résolution.
Le squelette carbonique de la molécule de l’acide fumarique s’est
présenté par la chaîne de quatre atomes du carbone. En tenant
compte de l’insaturation de la chaîne la structure initiale (une
chaîne principale) recevra le nom buten (en réalité – 2-buten).
Cependant dans le cas présent il ne faut pas indiquer la position du
lien double puisque le groupe caractéristique СООН occupe
toujours la position finale à la chaîne et pour 1-buten la
structure correspondante de l’acide dicarbonique est inconcevable.
Le groupe carboxylique si son atome du carbone c’est la partie de
la structure initiale est désigné par le suffixe-ique
l'acide. La présence de deux groupes identiques se reflète par le
préfixe multipliant di - directement devant le suffixe. Puisque les
groupes fonctionnels se trouvent dans la trans-position (selon de
différentes parties de la ligne conventionnelle qui joint deux
atomes sp![]() -hybrides
du carbone), le nom systématique de la liaison donnée : transe -
butendique l'acide.
-hybrides
du carbone), le nom systématique de la liaison donnée : transe -
butendique l'acide.
Dans la molecule de l’acide aconitique il est impossible de choisir la chaîne carbonique, dans laquelle les atomes du carbone de tous les groupes carboxyliques entreraient. C’est pourquoi en qualité de la structure initiale on choit le fragment de la chaîne plus court — propen, dans lequel trois atomes du carbone sont remplacés par les groupes carboxyliques. Dans ce cas les groupes СООН sont désignés par la combinaison - l'acide carbonique avec le préfixe multipliant trios et il est nécessaire d’indiquer leur position. Donc, le nom de l’acide aconitique selon la nomenclature remplaçante — propen-1,2,3-tricarbonique acide.
La tâche II. Dans la synthèse du moyen antituberculeux médicinal de phtivaside on utilise la vanilline : 4-hydroxi-3-métoxybensaldéhyde. Amenez la formule structurale de cette liaison.
La
résolution.
Du nom il est clair que la structure initiale de la liaison c’est
le noyeu benzénique. Le groupe principal fonctionnel de trois
énuméré c’est le groupe aldéhydique, donc l'atome du noyeu
benzénique lié au groupe aldéhydique, sera considéré comme
premier. Le substitut près du troisième atome sera
ménoxi-groupe-OCH![]() ,
près du quatrième – hydroxi-groupe.
,
près du quatrième – hydroxi-groupe.
Ainsi, la structure de la vanilline :
 O
La vanilline possède l'odeur caractéristique. Mais
O
La vanilline possède l'odeur caractéristique. Mais
CH![]() O
3 1 C ses isomères ne correspondent
pas selon la forme
O
3 1 C ses isomères ne correspondent
pas selon la forme
H aux récepteurs de la personne et il nous semble qu'ils
HO 4 6 n'ont pas l'odeur.
La tâche III. Appelez toutes les substances. Dans quelle liaison l'atome du carbone se trouve dans l'état de sp-hybridation ? Appelez-le.
а) СН3-СН2-СН2СН3, b) СН3-С-СН3, c) СНС-СН2СН3, d) СН3-С-СН3.

 О
СН3
О
СН3
Amenez la formule structurale et le nom de son isomère. Amenez la formule structurale et le nom de son homologue. S'il y a parmi les liaisons amenées des isomères ? Si oui, appelez-les.
La résolution. L'atome du carbone se trouve dans l'état sp –hybridation si ses deux p-orbitales non-hybridisées prennent part à la formation de deux -liens. Ce peut être ou l'alcyne, ou le dioléfine avec les liens doubles cumulés, ou le nitrile de l'acide contenant le groupe –СN. Parmi les liaisons énumérées il n’a pas de nitriles des acides et de dioléfines et la liaison c se rapporte à la classe des alcynes : СНССН2СН3. On commence à numéroter la chaîne carbonique à partir de la fin vers laquelle le lien triple se trouve plus proche, en générale il y a quatre atomes du carbone, le lien multiple se trouve entre les premiers et deuxièmes atomes, donc, c’est 1-butin. L'isomérie du squelette carbonique est impossible dans le cas présent, l'isomère c’est 2-butin СН3СССН3 (selon la position du lien multiple) ou 1,3 butadiène СН2=СН-СН=СН2 (l'isomérie interclasse).
Homologue c’est le membre d'une même série homologique se distinguant par le nombre des groupes–СН2–. Nous recevrons : СНССН2СН2СН3 1-pentin ou СНССН3 propin.
Parmi
les liaisons amenées il y a 2 isomères selon la structure du
squelette carbonique : le butane et méthylpropan. Les deux liaisons
ont la composition identique (4 atomes de C et 10 atomes de H), mais
une diverse structure et de divers propriétés (ainsi la température
d'ébullition du butane +0,6
![]() С
et du méthylpropan – 11,8
С
et du méthylpropan – 11,8![]() С.)
С.)
La tâche IV. En train du métabolisme des hydrates de carbone se passe l'oxydation stéréospécifique du L-acide lactique à l’acide pyruvique. Représentez les deux liaisons. Si l'acide pyruvique c’est l’acide chirale ou la molécule prochirale?
La résolution. Les molécules sont chirales (actives optiquement) si elles sont incompatibles avec la représentation de miroir. La cause de l'activité optique des liaisons organiques c’est la présence de l'atome asymétrique du carbone (lié avec quatre différents substituts). Dans l’acide lactique (2-hydroxipropanoïque) c’est le deuxième atome du carbone. Dans l’acide pyruvique (2-oxopropanoïque) l'atome asymétrique du carbone est absent, car le premier et le deuxième atomes du carbone sont liés seulement à trois substitutes, et le troisième a trois substituts identiques (les atomes de l'hydrogène). Mais à la restitution l'acide pyruvique se transforme en l’acide lactique et le deuxième latome du carbone deviendra asymétrique, donc on peut la trouver comme la liaison prochirale. Dans la projection de Fichère pour les L-isomères le substitut principal près de l'atome asymétrique du carbone est représenté à gauche, pour les D-isomères – à droite.
С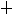
 ООН
СН3
– С – СООН
ООН
СН3
– С – СООН
НО Н О
СН3 l’acide pyruvique
L- acide lactique
L a
tâche V.
Appelez les liaisons amenées plus bas. Lesquelles d'eux sont les
liaisons aromatiques et lesquelles ne sont pas aromatiques et
pourquoi ?
a
tâche V.
Appelez les liaisons amenées plus bas. Lesquelles d'eux sont les
liaisons aromatiques et lesquelles ne sont pas aromatiques et
pourquoi ?
–СН=СН2 –СН=СН2
a) b) c)
La résolution. La liaison a le nom trivial «styrène», selon la nomenclature sis-thématique il s'appellera comme vinillbenzène, car le radical «vinill» est lié avec le noyeu benzéique. Dans la liaison b le radical «vinill» est lié avec le noyeu du cyclohexane, donc, c’est vinillcyclohexane. La liaison c c’est l'hétérocycle de cinq members «le furanne».
Les liaisons aromatiques ce sont les systèmes plats cycliques dans la composition desquels entre le système des liens associés doubles dont le nombre -électrons correspond à la règle de Chukkel: 4 + 2. Le benzène c’est le cycle plat avec six -électrons (n= 1). Mais dans la molécule du styrène avec le noyeu benzénique est associé encore un lien double. Dans le cas présent le quatrième lien double ne fait pas partie du cycle, donc dans la liaison il y a un fragment aromatique (le noyeu benzénique) et le lien double dans la chaîne latérale. Le système aromatique entre principalement dans les réactions de la substitution électrophile et le lien double — aux réactions d'addition. Dans la liaison b le cycle avec les liens multiples associés manque, la liaison non aromatique.
Dans la liaison c il y a un système cyclique avec deux liens associés doubles (4 - l'électrons) que, apparemment, ne correspond pas à la règle de Chukkel. Mais une des p- orbitales non-hybridisées de l'atome de l'oxygène s'installe parallèlement aux orbitales de - liens et entre dans le couplage (p- - le couplage), c-à-d le furanne c’est le système aromatique.
La
tâche VI.
L'acide sorbique СН![]() –СН=СН–СН=СН–СООН
pour la première fois dégagés du jus du sorbier (du latin sorbus
c’est le sorbier) c’est la substance antiséptique. Comparez la
distribution de la densité électronique dans le fragment diène de
l’acide sorbique avec la distribution de la densité électronique
dans le 1,3-butadiène. Quels effets électroniques manifestent les
groupes méthyle et carboxylique dans cette liaison ?
–СН=СН–СН=СН–СООН
pour la première fois dégagés du jus du sorbier (du latin sorbus
c’est le sorbier) c’est la substance antiséptique. Comparez la
distribution de la densité électronique dans le fragment diène de
l’acide sorbique avec la distribution de la densité électronique
dans le 1,3-butadiène. Quels effets électroniques manifestent les
groupes méthyle et carboxylique dans cette liaison ?
La résolution. L'influence des substituts sur la distribution de la densité électronique dans la molécule est estimée comme le résultat de l'action commune des effets inductifs et mesomères. La molécule de l’acides sorbique peut être considérée comme le 1,3-butadiène, dans lequel aux positions 1 et 4 "sont introduits" deux substitutes—les groupes méthyle et carboxylique.
La
différence dans l'électrocaractère négatif des atomes du carbone
dans les états sp![]() - et sp
- et sp![]() -hybridations
n’est pas grande, c'est pourquoiСН
-hybridations
n’est pas grande, c'est pourquoiСН![]() -groupe
manifeste un petit +I-effet et donne une l'influence faible des
électrodonneurs sur le fragment diène de la molécule.
-groupe
manifeste un petit +I-effet et donne une l'influence faible des
électrodonneurs sur le fragment diène de la molécule.
Le groupe carboxylique contenant deux atomes fortement électronégatifs de l'oxygène, possède -I-effet. Simultanément grâce au -lien le groupe carboxylique se trouve à , -couplage avec le système diène en manifestant – M-effet considérable. À la suite de la direction identique des actions de deux effets du groupe carboxylique la densité électronique comme --lien, et le -système associé se déplace de côté du groupes carboxylique. Le groupe carboxylique joue le rôle principal dans la réduction de la densité électronique dans le fragment diène de la molécule de l’acide sorbique par comparaison avec le 1,3-butadiène. Cela amène au changement de la conduite chimique du fragment diène: sa capacité réactionnaire diminue dans ces réactions, qui commencent par l'attaque par les particules électrophiles, par exemple les réactions de l'oxydation et l'addition électrophile.
La tâche VII. Quel acide dans chaque cas plus fort et pourquoi : a) fourmique, vinaigre; et triméthylacétique; b) butanoïque, - chlorbutanoïque et -chlorbutanoïque.
La résolution. Selon Brensted les acides sont les molécules neutres ou les ions qui sont capables de rendre le proton. Le proton se détache plus facilement que la charge partielle positive plus grande se localise sur lui. L'augmentation de cette charge est provoquée par la présence dans la molécule des substituts-électroaccepteurs (EА). En outre EА-substituts contribuent à la délocalisation de la charge négative ils stabilisent les anions et par cela augmentent l’acidité. Electrodonneurs (ED)-substituts, au contraire, la baissent.
Dans
la molécule de l'acide formique НСООН
il n’a pas ni ED, ni EА-substituts,
dans l'acide acétique СН![]() СООН
avec par le groupe carboxylique est lié ED le groupe méthyl, dans
l'acide triméthylacétique (СН
СООН
avec par le groupe carboxylique est lié ED le groupe méthyl, dans
l'acide triméthylacétique (СН![]() )
)![]() ССООН
il y a encore plus grande quantité de groupes donneurs. Donc, dans
ce cas l’acide fourmique est le plus fort et l’acide
triméthylacétique est le plus faible.
ССООН
il y a encore plus grande quantité de groupes donneurs. Donc, dans
ce cas l’acide fourmique est le plus fort et l’acide
triméthylacétique est le plus faible.
Dans les molécules des acides chlorbutanique isomères assiste EА-substitut — l’ atome du chlore dont l'effet négatif inductif contribut à l'augmentation de leur acidité en comparaison de l'acide butyrique (son acidité sera la plus petite). Mais l'effet inductif selon la chaîne s’éteint et donc son action se fait sentir dans une plus grande mesure dans la molécule -chlorbutanique acide et son acidité sera dans ce cas le plus haut.
La tâche VIII. Dans la pratique médicale le novocaïnarure est appliqué dans l'aspect de l’hydrochlorure. Définissez le centre de la protonition dans la molécule.
La résolution. Les liaisons manifestant les propriétés basiques possèdent la capacité à adjoindre le proton. Dans la molécule du novocaïnarure on peut dégager un centre -basique (le noyeu benzénique) et plusieurs centres p - basiques (les atomes de l'azote et l'oxygène).
H 2N
– – CO – NH – CH2
– CH2
– N(C2H5)2
2N
– – CO – NH – CH2
– CH2
– N(C2H5)2
Quatre centres basiques font partie du fragment associé de la molécule (ce fragment est dégagé le cadre).
Le centre -basique est plus faible en comparaison des centres p - basiques. De toutes les р - centres basiques se trouvant dans la molécule de novocaïnarure c’est l’atome de l'oxygène du groupe carboxylique qui possède la plus petite basicité en conséquence de plus grand l'électrocaractère négatif en comparaison de l'atome de l'azote. La force de la basicité dépend non seulement de la nature de l'hétéroatome portant la paire non partagée des électrons, mais aussi se définie par l’influence mutuelle des substituts. Ainsi, grâce au р, -couplages de l'atome de l'azote avec le groupe carboxylique a lieu une redistribution de la densité électronique dans le fragment de l’amide et l'atome de l'oxygène du groupe carboxylique devient relativement un centre basique plus fort que l'atome de l'azote qui est associé avec lui.
Le groupe aminé dans la para-position du noyeu benzénique est aussi associé avec le groupe carboxylique. On peut examiner ce fragment comme l'aniline ayant dans la para-position le groupe d’amide – CONH-. Le groupe d'amide-accepteur baisse la basicité de l'atome de l'azote dans la structure d'aniline.
L'atome de l'azote dans le fragment aliphatique–CH2N(C2H5)2 de la molécule du novocaïnarure a la paire des électrons non partagée ne participant pas au couplage, cette paire conditionne les propriétés basiques assez fortes. Grâce à l’influence électrodonneuse des groupes des alcoyles la basicité du groupe aminé remplacé est comparée avec la basicité des amines tertiaires aliphatiques. C'est pourquoi on peut pronostiquer que dans la molécule novocaïnarure la protonition se passera selon l'atome de l'azote basique tertiaire:
[ H2N
– – CO – NH – CH2
– CH2
– +NH
(C2H5)2]
Cl–
H2N
– – CO – NH – CH2
– CH2
– +NH
(C2H5)2]
Cl–
Les tâches pour la résolution indépendante :
1.1. L’aminalon c’est la substance prenant part aux processus d’échange de l'encéphale il a la structure : Н2N–CH2–CH2–CН2–СOOH. Indiquez son nom selon la nomenclature systématique : a)1-aminobutanoïque acide, b) 4- аminopentanoïque acide, c) 4-aminobutanoïque acide, d) 3-carboxy - 1-propilamin.
1.2. L'acide acétondicarbonique ayant la structure HОOC–CH2–СО–CH2–COOH entre dans la composition des corps cétoniques. Indiquez son nom selon la nomenclature systématique: a) l'acide pentandique, b) 2-oxopentandique acide, c) 3-oxopentandique acide, d) le dicarboxyacétone.
1.3.
Le produit de la désagrégation du glycogène dans les muscles c’est
l'acide lactique : CH![]() –CH(OH)–COOH.
Indiquez son nom selon systématique nomenclature : a) oxopropanoïque
acide, b)1-hydroxypropanoïque acide, c) 2-hydroxypropanoïque acide,
c) 2-méthyl-2-hydroxyéthanoïque acide.
–CH(OH)–COOH.
Indiquez son nom selon systématique nomenclature : a) oxopropanoïque
acide, b)1-hydroxypropanoïque acide, c) 2-hydroxypropanoïque acide,
c) 2-méthyl-2-hydroxyéthanoïque acide.
1.4. Le produit intermédiaire de l'échange carbonique c’est l'acide pyruvique — 2-oxopropanoïque acide. Indiquez la formule de cet acide :

1.5. Le jus de l'oignon contient 1-propantïol. Indiquez sa formule :
a) CН3–CH2–CH2–CH2–CH2–SH, b) CH3–CH2–S–СН3,
c) СН3–СН(SН)–СН3, d) CH3–CH2–CH2–SН.
1.6. Écrivez les formules des liaisons : a) propane; b) méthylpropane; c) propanon, d) diméthylpropanon, e) propanal. Indiquez la liaison dans lequel il y a un atome tertiaire du carbone. S’il y a parmi les liaisons amenée des homologues ? Des isomères ?
1.7. Écrivez les paires des substances :
a) 1-propanol et 2-propanol; b) propanal et propanon;
c) 1-propanol et 1 butanol; d) 1-butanol et 2-méthyl-1-propanol.
Laquelle de ces paires de liaisons se présente:
1) homologues; 2) les isomères selon la structure du squelette carbonique;
3) les isomères par la position du groupe fonctionnel;
4) les isomères selon le groupe fonctionnel ?
1.8. Appelez toutes les liaisons et choisissez les liaisons optiquement actives:
а) СН3-СН(ОН)-СН2-СН3, b) СН3-СН(Br)-СН3, c) СН3-СН2-СН2ОН
d) НООС-СН(ОН)-СООН, e) НООС-СН(ОН)-СН2-СООН.
1.9. Choisissez les liaisons optiquement actives présentez-les dans l'aspect des enantiomères: a)1-butanol, b) 2-butanol, c) l'alanine, d) аminoacétique acide, e) l'acide citrique, f) chlorbenzène.
1.10. -aminoacides rapportant aux rangs différents stéréochimiques se distinguent par le goût. Ainsi D-glutamique acide (2-aminopentandique) n’a pas de goût, mais son enantiomère a le goût de la viande. Représentez les formules structurales de ces liaisons.
1.11. Écrivez les formules des liaisons suivantes: a) la naphtaline; b) toluène; c) cyclohexène; d) le pyrrole; e) cyclopentadiène. Lesquelles de ces liaisons sont aromatiques, et lesquelle – non et pourquoi ?
1.12. Appelez les liaisons amenées plus bas. Dans lesquelles il y a des liens associés multiples ?
а) СН3–СН2–СН=СН–СООН, b) СН2=СН–СН=СН–СН3,
c) СН3–СН2–СН=СН–СН2ОН, d) СН2=СН–СН2–СН=СН–СН3.
1.13. Écrivez les formules des liaisons suivantes :
a) 1-butanol; b) 4-nitrophénol; c) 1,2-propandiol; d) -naftol.
Choisissez les liaisons dans lesquells le groupe hydroxyle c’est le substitut électrodonneur.
1.14. Lesquels effets électroniques (+М, -M, +I,-I) manifeste le groupe hydroxyle dans les liaisons suivantes :
а
 )
НОСН2СН2СООН,
b)ОН–NН2,
в) ОНСН2
– –NН2,
)
НОСН2СН2СООН,
b)ОН–NН2,
в) ОНСН2
– –NН2,
c) НО–СН=СН–СООН, d) НО–СН2–СН=СН–СООН.
1.15. Lesquels effets électroniques (+М, – M, +I,–I) manifeste le groupe aminé dans les liaisons suivantes : a) 3-aminopropanoïque acide; b) 2-aminophénol; c)3-aminopropenoïque acide; d) benzilamine (phénylméthylamine).
1.16. Lequel des acides possède les propriétés acides plus fortes: a) acétique; b) trichloacétique; c) chloracétique; d) stéarique? Expliquez la réponse.
1.17. Les amines aliphatiques manifestent les propriétés basiques. Comparez les propriétés basiques de la méthylamine, diméthylamine, triméthylamine et l'aniline.
1.18. Comme le moyen augmentant la pression artérielle noadrénaline est appliqué en forme du sel de l'acide de vin (hydrotartrate). Définissez la place de la protonition dans la molécule.
Le SUJET 2. La Caractéristique générale des réactions des liaisons organiques.
