
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
Le travail de laboratoire № 7.
Les acides nucléiques et leurs composants structuraux.
Le but du travail : apprendre à réaliser l'hydrolyse des fractions bioorganiques contenant des nucléoprotéines, identifier les composants des nucléoprotéines dans l'hydrolysat des fractions.
Les réactifs : la solution concentrée de l'ammoniaque; 1 М la solution de l’hydroxyde du sodium; 10 % solution du sulfate du cuivre (II); 10 % solution du nitrate de l'argent; la solution saturée du molybdate de l'ammonium; 1 М les solutions des acides sulfuriques et nitriques.
L'expérience 7.1. L’hydrolyse de la fraction contenant des nucleoproteins.
Dans l’éprouvette grande et large pour l’hydrolyse on place 5g. de levure, on ajoute 10 ml de 1M solution de l’acide sulfurique. On ferme l’éprouvette par le bouchon avec le frigo inverse et on fait bouillir pendant 60 min. Ensuite on refroidit le contenu de l’éprouvette jusqu’à la température ordinaire on filtre.
L'expérience 7.2. Les réactions qualitatives sur les composants des nucléoprotéines dans l'hydrolysat de la fraction.
7.1.1. Dans l’éprouvette on place 0,5 ml de l’hydrolysat filtré et on fait la réaction biurétique (ex. 5.3.), on écrit les résultats.
7.1.2. À l'éprouvette on place 0,5 ml du filtrat de l'hydrolysat, on ajoute 2 gouttes de la solution concentrée de l'ammoniaque, 0,5 ml 10 % - solution du nitrate de l'argent. Dans 5 minutes on observe la formation du dépôt mou brun. Cette réaction prouve la présence dans la solution des bases puriques.
7.1.3. À l'éprouvette on place 0,5 ml du filtrat de l'hydrolysat, on ajoute 0,5 ml 1 М de la solution de l’hydrolyse du sodium et 0,25 ml 10 % solution du sulfate du cuivre (II). On observe l'apparition du depot finement dispersé. On chauffe le contenu de l'éprouvette jusqu'au bouillonnement.
7.1.4. À l'éprouvette on place 0,5 ml du filtrat de l'hydrolysat, 2 ml de la solution saturée de molybdate l'ammonium et 1 ml de la solution de l'acide nitrique. On mélange le mélange et font bouillir 3 - 5 minutes. On observe l'apparition de la coloration jaune citron. Cette réaction prouve la présence dans la solution de l'acide phosphorique.
Les questions de contrôle
1. Ecrivez les formules des bases azoteuses qui font partie dans la composition de ARN et ADN. Quelles sont les fonctions de ARN et de AND dans les organismse?
2. Quelles formes tautomères sont possibles pour l’uracile et laquelle des formes participle dans la formation du nucléoside de l’uridine?
3. Quels liens condionnent les structures primaire et secondaire des acides nucléiques?
4. Ecrivez la structure de la domaine de ARN avec la succession des bases: adéninuracilcytosine.
Le travail de laboratoire № 8.
L'étude des propriétés des lipides et leurs composants structuraux.
Le but du travail : apprendre expérimentalement à prouver la présence dans les lipides des composants principaux structuraux; définir le degré de la saturation des acides supérieurs gras; réaliser la saponification des graisses.
Les réactifs : les huiles; l'eau de brome; 35 % solution NaOH.
L'expérience 8.1. La définition du degré de l’insaturation des acides supérieurs gras.
À l'éprouvette placez 1,0 ml de l'eau de brome et 0,5 ml de l'huile de tournesol (contient une grande quantité d'acides non limites gras), mélangez; il y a une décoloration de l'eau de brome :
L'équation de la réaction :

On définit le degré de l’insaturation des graisses quantitativement par la quantité de l'halogène adjoint (l'iode, le brome) selon la place des liens doubles.
L'expérience 8.2. L'isomérisation de l'acide oléique.
À l'éprouvette placez 1 ml de l'acide oléique, un peu de copeaux de cuivre et 1,5 ml de l'acide nitrique concentré. Secouez le contenu de l'éprouvette énergiquement et laissez dans le support sous la traction. Observez le dégagement de l’oxyde de l'azote (IV) de la couleur brune se formant à la suite de la coopération de l'acide nitrique concentré avec le cuivre. Les oxides de l'azote sont les catalyseurs du procès de l'isomérisation de l'acide oléique à l’acide élaïdique. La masse écumée de l'acide oléique (le tsis-isomère) pendant 1 heure durcit en conséquence de la formation de l’acide solide (trans-isomère) :
L'équation de la réaction :

Les questions de contrôle
1. Qu'est-ce que c'est les lipides ? Leur classification.
2. Qu'est-ce que c'est les graisses ? De quels facteurs dépend l'état initial des graisses ?
3. Énumérez les fonctions biologiques des graisses.
4. A quel type de réactions (l'addition, la substitution ou d’autres) se rapporte la réaction de l'huile de tournesol avec l'eau de brome ?
5. Amenez les équations de la coopération du dioléolynoléine avec l'eau de brome et avec du permanganate du potassium.
La littératire
1. Tukavkina N.A. La chimie bioorganique/ N.A. Tukavkina, U.I. Baoukov.-M.: Drofa, 2006. – 542p.
2. Ovchinnicov U.A. La chimie bioorganique/ U.A. Ovchinnicov.- M.: Instruction, 1987. – 1630p.
3. Grandberg I.I. La chimie organique/ I.I. Grandberg. – M.: Drofa, 2002. – 542p.
L’application 1. La classification des aminoacides selon la structure du radical hydrocarbure
le radical non-polaire alyphatique
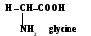




2. le radical polaire aliphatique










le radical carbocyclique aromatique


le radical hétérocyclique



L’application 2. La structure des glucides de D-série
La structure des aldoses:


















 СНО
СНО
Н ОН
ОН
СН2ОН
D–aldèhydeglycérique
СНО СНО
Н

 ОН
НО Н
ОН
НО Н
Н ОН Н
ОН
ОН Н
ОН
СН2ОН СН2ОН
D– érythroseD–tétrose

 СНО
СНО СНО
СНО
СНО
СНО СНО
СНО
Н ОН НО Н Н ОН НО Н
 Н ОН
Н ОН НО Н НО
Н
Н ОН
Н ОН НО Н НО
Н

 Н ОН
Н ОН Н ОН
Н ОН
Н ОН
Н ОН Н ОН
Н ОН
 СН2ОН
СН2ОН СН2ОН
СН2ОН
СН2ОН
СН2ОН СН2ОН
СН2ОН
D –riboseD–arabinoseD–xyloseD-lyxose
–riboseD–arabinoseD–xyloseD-lyxose







 СНО
СНО СНО СНО СНО
СНО СНО СНО
СНО
СНО СНО СНО СНО
СНО СНО СНО
Н ОН НО Н Н ОН НО Н Н ОН НО Н Н ОН НО Н
Н ОН Н ОН НО Н НО Н Н ОН Н ОН НО Н НО Н
Н ОН Н ОН Н ОН Н ОН НО Н НО Н НО Н НО Н
Н ОН Н ОН Н ОН Н ОН Н ОН Н ОН Н ОН Н ОН
СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН
D-allose D-altrose D-glucose D-mannose D-gulose D-idose D-galactose D-talose
La structure des cétoses:

 СН2ОН
СН2ОН
СН2ОН
СН2ОН

 С = О
С = О
С = О
С = О
 СН2ОН
Н ОН
СН2ОН
Н ОН
dioxyacétonСН2ОН

 СН2ОН
СН2ОНD– érythrulose
СН2ОН
СН2ОНD– érythrulose



 С = О С = О
СН2ОН
СН2ОН
С = О С = О
СН2ОН
СН2ОН



 Н ОН НО Н
С = О
С = О
Н ОН НО Н
С = О
С = О

 СН2ОН
СН2ОН Н ОН
НО Н
СН2ОН
СН2ОН Н ОН
НО Н

 D-
érythruloseL-érthruloseН ОН Н
ОН
D-
érythruloseL-érthruloseН ОН Н
ОН
СН2ОН СН2ОН
D–ribuloseD-xylulose



 СН2ОН
СН2ОН СН2ОН
СН2ОН
СН2ОН
СН2ОН СН2ОН
СН2ОН



 С
= О С = О С = О
С = О
С
= О С = О С = О
С = О



 Н
ОН НО Н Н ОН
НО Н
Н
ОН НО Н Н ОН
НО Н



 Н
ОН Н ОН НО Н
НО Н
Н
ОН Н ОН НО Н
НО Н



 Н
ОН Н ОН Н ОН
Н ОН
Н
ОН Н ОН Н ОН
Н ОН
СН2ОН СН2ОН СН2ОН СН2ОН
D–psycoseD–fructoseD–sorboseD-tagatose
L’application 3. Les exemples des tests
Le test № 1
Choisissez les signes qui se touvent dans le fond de la classification des liaisons organiques:
la structure de la chaîne carbonique; b) la quantité des atomes du carbon dans la molécule;
c) la présence des groupes fonctionnels; d) la quantité des atomes d’hydrogène dans la molecule.
2. Les liaisons 1-butanol et l’éther diéthylique représentent : a) les isomères selon la structure de la chaîne carbonique; b) les isomères selon le groupe fonctionnel; c) les isomères géométriques; d) des enantiomères; e) les isomères selon la position du groupe fonctionnel; f) epimère 3. Lequel des acides possède les propriétés acides plus forts: a) butanique; b) 2-méthylbutanique; c) 2-fluorbutanique; d) 2-chlorbutanique? 4. Appelez les liaisons amenées plus bas. Dans lesquelles d'eux il y a des liens conjugués multiples ?
а) СН3–СН2–СН=СН–СООН, b) СН2=СН–СН=СН–СН3,
c) СН3–СН2–СН=СН–СН2ОН, d) СН2=СН–СН2–СН=СН–СН3.
Le test № 2
Choisissez l'hydrocarbure dans les molécules duquel les orbitales de tous les
atomes
du carbone se trouvent dans l'état sр![]() hybridations :
hybridations :
a) propène; b) propanal; c) 2-méthylpropane; d) propine.
Pour la liaison choisie dans le premier devoir les réactions plus caractéristiques sont :
a) de la substitution électrophile; b) de l'addition radicale; c) de la substitution nucléophile; d) de l'addition électrophile; e) de la substitution radicale; f) de l’addition nucléophile.
