
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
6.4 Les oligo - et les polysaccharides
Les disaccharides représentent le produit de la condensation de deux molécules des monoholosides joints par la liaison O-osidique. Si les deux hydroxyles semi-acétaliques prennent part à la réaction de la condensation et les deux restes des monosaccharides se lient de la liaison osidique-osidique, se forme le bioside (le diholoside) non-réducteur, qui ne contient pas l'hydroxyle osidique. Il ne peut pas passer à la forme ouverte aldéhydique et c`est pourquoi il ne réduit pas les oxydes métalliques (ne donne pas la réaction «du miroir en argent»).
Si à la réaction de la condensation prennent part un hydroxyle semi-acétalique, un hydroxyle d'alcool et deux restes des monosaccharides de la liaison se lient de la liaison osidique-osidique, le bioside réducteur se forme alors. Un tel bioside contient l'hydroxyle osidique, à l`aide duquel il peut passer à la forme ouverte aldéhydique et jouer le rôle de l`agent réducteur.
Les disaccharides, comme tous les glucosides, s`hydrolysent dans un milieu acide. Les disaccharides importants sont la saccharose, la maltose, la lactose et la cellobiose.
Par exemple, la formule structurale de la maltose, qui est le produit principal de la désagrégation de l'amidon à la cavité buccale sous l'effet du ferment du salive - -ferments amylolytiques, on peut représenter:


La lactose et la cellobiose ont la structure suivante:




La saccharose - c`est le disaccharide non-réducteur, elle se trouve dans la canne à sucre, la betterave à sucre, différents légumes et fruits.
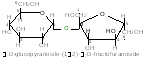
Les produits de la condensation de quelques (jusqu'à 12) les molécules des monosaccharides s`appellent les oligosaccharides; de plus grand nombre des monoholosides – les polysaccharides (les polyholosides).
Si les macromolécules sont construites des restes d'un monoholoside, tels polyholosides s`appellent des homopolysaccharides. Parmi les homopolysaccharides les plus biologiquement importants sont poly-D-glucopyranoses : l'amidon (l`amylose et l`amylopectine), et la cellulose.
L`amylose est un polymère de la structure non ramifiée (le polymère linéaire) à la masse moléculaire près de 60000; au chauffage elle se dissout dans l'eau, en formant la solution lyophile colloïdale; elle interagit avec l'iode avec la formation du composé complexe de la couleur bleue.

À l'hydrolyse enzymatique par le -amylase, qui se détache par le pancréas et se trouve dans le salive, l`amylose se désagrège en glucose et la maltose; l'hydrolyse commence par le terminal non-réducteur de l`amylose et se réalise par l`élimination successive des molécules de la maltose.
L`amylopectine a la structure ramifiée et comprend à côté des (14) - liaisons les (16)-liaisons osidiques. À l`aide de ces-derniers se forment les ramifications dans la structure:



À la dissolution dans l'eau l`amylopectine gonfle, en formant le système fixe dispersé - le gel. Avec l'iode l`amylopectine forme la liaison de la couleur rouge violet.
Le mélange de l`amylose (20-25 %) et de l`amylopectine (75-80 %) représente le polyholoside de l'origine naturelle - l'amidon. Au chaud avec les acides l'amidon s`hydrolyse selon la place des liaisons glocoside-glucidiques, en donnant successivement les dextrines, la maltose et le glucose.
Le glycogène («l'amidon animal») selon la structure et les propriétés est ressemble à l`amylopectine, mais il a la chaîne encore plus ramifiée polymérique et il est le polyholoside de réserve des animaux, stocké dans le foie et le tissu musculaire. La macromolécule du glycogène à cause d'un grand montant ne passe pas par la membrane et elle reste à l'intérieur de la cellule, jusqu`aux besoins énergétiques. Dans les intervalles entre les repas le glycogène se désagrège peu à peu jusqu'au glucose, qui entre au sang et puis est utilisé par les cellules de l'organisme. Chez une personne adulte les stocks du glycogène atteignent 0,5 kg.
L`un des polyholosides les plus importants est la cellulose. Elle forme un principal composant des parrois des cellules végétales. La cellulose représente le polymère comprenant entièrement les séquances de -D-glucopyranose, qui sont lies par des liaisons osidiques (14).
La cellulose - le polymère linéaire, dont les chaînes peuvent contenir plus de 10000 séquances:

Les hétéropolysaccharides (dont les macromolécules sont construites des restes de plus, qu`un monoholoside) sont répandus aussi assez largement dans la nature.
Le tissu conjonctif est distribué par tout l'organisme et conditionne la solidité et l'élasticité des organes, l'élasticité de leur combinaison, la résistance à la pénétration des infections. Les polysaccharides du tissu conjonctif sont liés aux protéines.
Les chondroïtine-sulfates sont étudiés le plus complètement (la peau, les cartilages, les tendons), l`acide hyaluronique (le corps vitré de l'oeil, le cordon ombilical, les cartilages, le liquide articulaire), l'héparine (le foie). Ces polysaccharides possèdent les traits communs dans la structure : leurs chaînes non ramifiées sont construites des restes des disaccharides, dans la composition desquels entrent les acides uroniques (D- acide glucuronique, D - acide galacturonique, L-acide iduronique) et N- acétylhexoamines (N - acétylglucoseamine, N-acétylgalactoseamine). Certains contiennent les restes de l'acide sulfurique.
Les tâches standartes et leur résolution
La tâche ХХ. Ecrivez les formes -furanose et -pyranose de L-arabinose. Représentez ses anomères en forme des projections de Ficher.
La résolution: Dans la littérature référentielle on amène d'habitude les formules des glucides de D-série dans lesquelles l'hydroxyle chez le dernier le plus exclu du groupe carbonique l'atome asymétrique du carbone se trouve à droite. La configuration de L-isomère représente la réflexion de miroir de la D-liaison.
Les formes furanose et pyranose de l'hydrate de carbone ce sont des cycles de cinq- et sixmembres avec un atome de l'oxygène. Les formes cycliques se forment grâce à la coopération du groupe aldéhydique avec l'hydroxyle du cinquième (С5) ou, moins souvent, du quatrième (С4) atome carbonique. A la cyclisation l'hydrogène du groupe hydroxyle (С5 ou С4) se joint à l'oxygène du groupe aldéhydique grâce à la rupture du -lien le carbone-oxygène en formant l’hydroxyle semi-acétal ou glucosique (qui est conclu au cadre). L'oxygène du groupe hydroxyle près de l'atome С4 ou С5 après l’élimination de l'hydrogène se lie avec le carbone du groupe aldéhydique près de l'atome С1. La passerelle oxygénée apparaît liant les atomes С1–С4 en fermant le cycle de cinqmembres, ou С1–С5 en fermant le cycle de sixmembres.

Dans la forme semi-acétale le premier atome du carbone s'est transformé à l’atome asymétrique. À la suite de cela au circuit du cycle d'une forme ouverte aldéhydique se forment deux formes cycliques semi-acétales distinguant une de l'autre par la position de l'hydroxyle semi-acétal.
La forme cyclique près de laquelle l'hydroxyle semi-acétal est disposé sur une seule partie (dans la cyc-position) avec l'hydroxyle définissant la configuration (l'appartenance à D – ou à L-série) de la monosaccharide s'appelle -forme. La forme cyclique près de laquelle l'hydroxyle semi-acétal se trouve dans la trans-position avec l'hydroxyle définissant la configuration s'appelle -forme. et -formes ne sont pas les antipodes optiques mais se représentent les diactéréomères appelant anomères.
La tâche ХХI. Ecrivez la formule structurale du disaccharide formé par deux restes du -D-galactose qui sont liés par le lien 1,4-glucosique. Ecrivez la formule structurale du produit de la coopération de ce disaccharide avec l'alcool méthylique dans la présence du chlorhydrogène. Si ces liaisons peuvent participer à la réaction"du miroir en argent» ? Ecrivez les équations des réactions nécessaires.
La résolution: les molécules du -D-galactose peuvent former entre eux-mêmes les liens avec la participation de 1-er et 4-ème atomes carboniques. Par l'astérisque est désigné l'hydroxyle glucosique qui peut être remplacé sur le groupe-OCH3 pendant la réaction avec l'alcool méthylique :
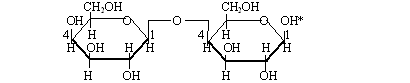

Grâce à la présence de l'hydroxyle glucosique le disaccharide -D-galactose peut se transformer dans la solution d'eau en forme linéaire avec le groupe aldéhydique (à la façon du glucose), c'est pourquoi il donne la réaction du miroir en argent (l'équation est amené dans l'aspect simplifié) :
С12Н22О11
+ Аg2О
![]() С12Н22О12
+ 2Ag
С12Н22О12
+ 2Ag
L'éther monométhylique du disaccharide -D-galactose ne contient pas l’hydroxyle glucosique, c'est pourquoi il ne peut pas exister sous la forme linéaire et n'entre pas dans la réaction du miroir en argent.
Les tâches pour la résolution indépendante :
6.1. Ecrivez les formes furanoses : a) D - gulose; b) L - talose.
6.2. Amenez les formules de: a) -D-glucofuranose; b) -L-galactopyranose; c)--D-ribofuranose; d) -D - fructofuranose.
6.3. Représentez la formule de l’épimère de la mannose.
6.4. Représentez la formule de l’anomère de -D - аllopyranose.
6.5. À la restitution du D-glucose se forme l'alcool sixatomique D-glucite (sorbite). Combien de produits se forment à la restitution de la D-fructose? Amenez les équations des réactions.
6.6. L’aldohexose optiquement active s'oxyde par l'acide nitrique concentré jusqu'à l’acide dicarbonique inactif. Laquelle peut être cette aldohexose? Amenez les équations des réactions.
6.7. La fructose ne contient pas le groupe aldéhydique, mais elle donne la réaction "le miroir en argent". Grâce auquel regroupement se passant dans le milieu basique cela se réalise ?
6.8. Dans la nature les monoholosides se rencontrent d'habitude liés grâce au centre glucosique. Quels produits résulteront à la coopération de -L-xlylopyranose avec l’éthanol dans un milieu acide ?
6.9. Quels produits peuvent se former à l'oxydation de L-galactose dans le milieu basique ou acide ?
6.10. Amenez le schéma de la formation du 6-phosphate D -glucopyranose.
6.11. En quoi consistent la ressemblance et les différences de la structure de l'amidon et de la cellulose ? De l'amidon et du glycogène ?
6.12. Dans trois éprouvettes se trouvent l'amidon, le thyrosine, l’acide aminoacétique. Décrivez l'identification des substances.
6.13. Dans trois éprouvettes se trouvent le glucose, l'acide palmitique, le phénilalanin. Décrivez l'identification des substances.
6.14. Dans la solution se trouvent le dipeptide du phénilalanin, la ribose et la saccharose. Comment à l'aide des réactions chimiques prouver la présence dans la solution de toutes substances?
LE SUJET 7. LES NUCLéOTIDES ET LES ACIDES NUCLÉIQUES
Les acides nucléiques (polynucléotides) sont des biopolymères les élements monomères desquels sont nucléotides.
Le nucléotide représente la structure à trois composants en comprenant le monoholoside lié par le lien N-glucosique avec la base hétérocyclique et par le lien ésther avec le reste de l'acide phosphorique.
Les acides nucléiques les plus importants sont l’acide désoxyribonucléique (ADN) et l’acide ribonucléique (ARN) les composants monosaccharides desquels représentent la 2-désoxyribose et la ribose en conséquence. Pendant l’hydrolise des nucléotides dans le milieu basique à la désagrégation hydrolytique subit seulement le lien ésther et se forment les nucléosides comprenant le reste de la monnose et de la base. Les nucléotides subissent l'hydrolyse seulement dans un milieu acide.
Les bases hétérocycliques sont les dérivées des liaisons hétérocycliques contenant l’azote—la pyrimidine ou la purine. Les bases pyrimidiques se dégagées dans la composition des chaînes polynucléotiques de l'ADN, sont présentées par la thymine et la cytosine; dans la composition de ARN —par l’uracyle et la cytosine. Ils découvrent la capacité vers la tautomérie lactime-lactame.
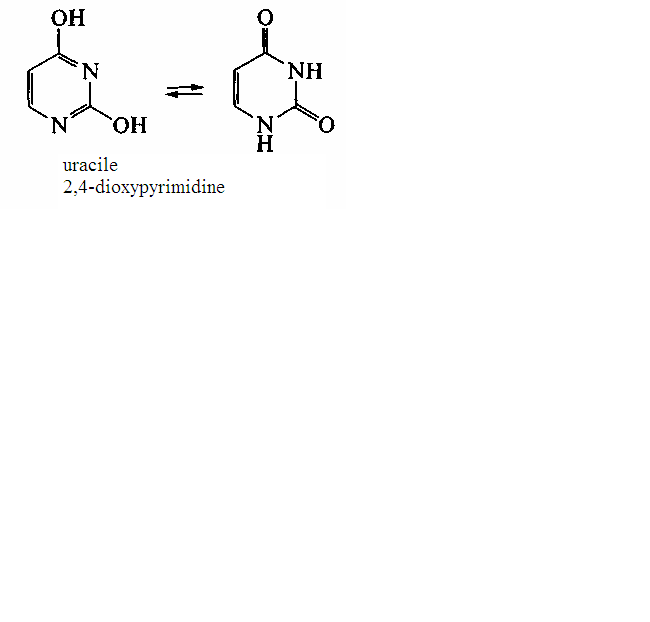


Il faut marquer que les bases pyrimidiques dans la composition des polynucléotides sont présentées par la forme lactame (contenant les groupes carboniques С=О) ce qu'est conditionné par la possibilité de la formation des liens hydrogéniques entre les restes des bases dans les chaînes des acides nucléiques : le thymine – l'adénine; la cytosine – la guanine dans l'ADN; l’uracile – l'adénine et la cytosine – la guanine dans ARN.
L 'adénine
et la guanine sont les représentants des bases puriques nucléiques.
Ces liaisons hétérocycliques sont capables à la tautomérie
lactime-lactame et à la tautomérie des azols.
'adénine
et la guanine sont les représentants des bases puriques nucléiques.
Ces liaisons hétérocycliques sont capables à la tautomérie
lactime-lactame et à la tautomérie des azols.




Guanine La
tautomérie des azols
Dans la forme lactame et lactime les hétérocycles ont le caractère aromatique et la structure plate. L'aromaticité des hétérocycles c’est la cause de leur haute stabilité thermodynamique.
