
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
2.5 Les réactions nucléophiles
Les réactions de substitution nucléophile de l`atome sp3 - hybride du carbone : les réactions hétérolytiques conditionnées par la polarisation des - liaisons le carbone - l'hétéroatome (les halogénés, les alcools).
Ces réactions passent selon le mécanisme de substitution nucléophile.
Pour les liaisons primaires et secondaires on propose le mécanisme de substitution nucléophile du deuxième ordre (SN2), pour les substances tertiaires – de substitution nucléophile du premier ordre (SN1).
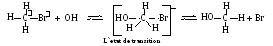
En cas des alcynes-halogénures primaire et secondaire hargés négativement le groupe hydroxyle attaque l'atome du carbone positivement chargé de la partie opposée à l'atome du brome négativement chargé. En présence de l'énergie suffisante l'hydroxyle s'approche tellement qu'entre lui et l'atome du carbone la liaison commence à se former, mais la liaison entre les atomes du carbone et le brome commence à se déchirer. Dans cet état de transition l'atome du carbone et tous les trois atomes hydrogéniques se trouvent dans le même plan. Puis l'anion du brome est mis en déhors et la molécule de l'alcool méthylique se forme. Ce processus porte le nom de la réaction de substitution nucléophile du deuxième ordre (SN2): nucléophile, parce que la parcelle attaquante est négativement chargée; du deuxième ordre — car la vitesse de la réaction dépend de la concentration du méthyle bromeux, et de l'hydroxyle. Si la combinaison initiale était optiquement active, alors en train de la réaction il y aura l`inversion de la configuration: par exemple, à l'hydrolyse de D-2-brombutane se forme L-2-butanol.
L'approche de la parcelle négativement chargée des alkyleshalogénures tertiaires est embarrassée par les résidus de volume et le procèdé va par un autre mécanisme. Bien que dans une très petite quantité, mais il y a quand même un procès de la dissociation du butyle tertiaire bromeux :
(CH3)3C – Br (CH3)3C+ + Br- (très lentement)
La butylecation tertiaire qui se forme réagit instantanément avec les particules nucléophiles se trouvant à la solution :
(CH3)3C+ + HO- (CH3)3C – OH (très vite)
Dans ce cas – là, la vitesse de la réaction dépend seulement du procèdé de la dissociation et, donc, de la concentration dans le mélange réactionnaire du butyle tertiaire bromeux et la réaction s'appelle en générale la réaction de substitution nucléophile du premier ordre - sn1. Si dans la réaction entre la liaison optiquement active, finalement se forme le mélange optiquement inactif racémique.
Les groupes partant bien sont de tels groupes, dont les formes protonées correspondent à de forts acides, par exemple : Hal - H2O, ROH, NH3 (les formes protonées: les acides halogéné hydrogéniques HHal, les ions : l`oxonium Н3О +, alkyloxonium ROH2 +, l'ammonium NH4 + — de forts acides).
Les groupes partant mal sont de tels groupes, dont les formes protonées correspondent à de faibles acides, par exemple: OH - NH2 - SH - OR - etc. Dans ce cas – là, pour le déroulement des réactions est nécessaire la protonation, c.a.d. la catalyse acide que permettra de traduire le groupe qui s`écarte mal en groupe qui s`écarte bien.
Au dernier stade (rapide) de la réaction de substitution il y a une compétition pour la carbocation entre deux particules: l'halogénure-ion (si comme l'acide on utilisait l'acide halogéné hydrogénique) et la molécule de l'eau jouant le rôle de l'accepteur du proton. Dans le premier cas se passe la substitution nucléophile (SN) de l'hydroxyle en l'halogène, et à deuxième — l`élimination (E) — l`élimination du proton.
Les
réactions de substitution nucléophile avec la participation de
l'atome
du
carbone sp![]() -hybride.
-hybride.
Le mécanisme des réactions de ce type nous examinerons à l'exemple de la coopération des acides carboxyliques avec les alcools (la réaction de l'éthérification). Au groupe carboxylique de l'acide se réalise la - conjugaison, puisqu'une paire des électrons de l'atome de l'oxygène du groupe hydroxyle OH entre dans la conjugaison avec la liaison carbone-oxygéné double (la -liaison) :
Une telle conjugaison est la raison, d'une part, de l'hyperacidité des liaisons carboxyliques, et de l'autre de la la réduction de la charge partielle positive (+) sur l'atome du carbone carboxylique les groupes (sur l`atome sp2 -hybride) ce qui embarrasse considérablement l'attaque directe du nucléophile.
En vue de l'augmentation de la charge de l'atome du carbone on utilise la protonation supplémentaire — la catalyse acide (le stade I) :


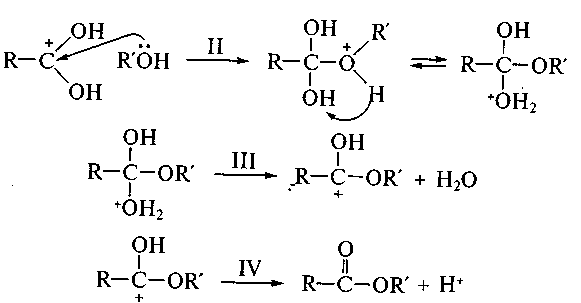

En II stade il y a une attaque du nucléophile (les molécules de l'alcool R'OH), la protonation du groupe hydroxyle avec la formation du groupe Н2О, en III stade — sa l`élimination et IV stade — la régénérescence du proton — le retour du catalyseur avec la formation du produit final — l'éther-sel.
Les réactions de l`addition nucléophile. Les réactions de l`addition nucléophile (AN) sont le plus caractéristiques pour les oxoliaisons— les aldéhydes et les cétones. Le mécanisme de ces réactions a des traits communs, c`est le procédé ionique en deux temps. Le premier stade (limitant) représente l'attaque reversible par le nucléophile Nu avec la formation d`un intermédiat tétraédrique soi-disant. Le deuxième stade — c`est l'attaque rapide par l`éléctrophile:
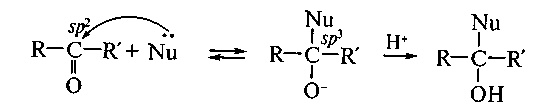
Un autre exemple d'une réaction biologiquement importante de ce type — l'addition des amines et d`autres liaisons azotées aux liaisons carboxyliques— les aldéhydes et les cétones. La réaction passe selon le mécanisme de l`addition nucléophile —élimination(AN—E):

D`autres liaisons azoteuses jouant le rôle du nucléophile dans ces réactions: l'hydrazine NH2–NH2, hydrazine phénylée, С6Н5–NH–NH2, l'hydroxylamine NH2–ОН. Les produits des réactions AN–E dans ces cas sont les hydrazones, les phénilehydrazones et l`oxime.
Les réactions de la condensation. Elles passent en présence des catalyseurs, plus souvent de la nature alcaline. Amènent à la complication du squelette carbonique. L'exemple caractéristique c`est l`aldolisation et la condensation crotonique :


Les réactions de la condensation, dans la base de qui se trouve la capacité d'une liaison carbonylée se joindre au groupe carbonylé de cette liaison ou bien d`une autre liaison carbonylée, sont caractéristiques aussi pour les dérivées des acides carbonylés, en particulier, des thio-éthers. Ces réactions ont une grande signification biologique. Avec leur aide dans l'organisme il y a une formation des nouvelles liaisons le carbone-carbone. Les participants immanquables des réactions d'après le type de l`adjonctions aldole in vivo sont des thio-éthers des acides carbonylé— les dérivées du coenzyme A. À la condensation de l`acétylcoenzyme A d'après le type de l`addition aldole de deux molécules de l`acétylcoenzyme A se forment –l`acéto-acétylecoenzyme A et le coenzyme А.
