
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
2.6 Les réactions d'oxydo-réduction (ror)
Les ROR occupent une grande place dans la chimie organique, elles ont la signification la plus importante pour les procédés de l'activité vitale. Avec leur aide l'organisme satisfait ses besoins énergétiques, puisque à l'oxydation des matières organiques se passe le dégagement de l'énergie. D'autre part, ces réactions servent pour la transformation de la nourriture en composants de la cellule.
L'oxydation dans la chimie organique — le procès de l'éloignement de l'hydrogène avec la formation de la liaison multiple ou d`une nouvelles liaison entre l'atome du carbone et l'hétéroatome, plus électronégatif, que l'hydrogène, par exemple les atomes de l'oxygène, l'azote, le soufre etc.
La réduction (la désoxydation) – le procès inverse à l'oxydation, – est accompagnée par la formation de nouvelles liaisons avec l'hydrogène et insère le transfert des électrons vers le substratum organique.
Dans les procès d'oxydo-réduction le degré de l'oxydation de l'atome du carbone est varié.
Les oxydants représentent les liaisons possédant une haute affinité à l'électron. Les oxydants peuvent être: l'oxygène, les peroxydes, l'acide nitrique, les halogènes, les hypo- halogénures, l'acide perchlorique, les liaisons des métaux dans les degrés supérieurs de l'oxydation (par exemple, l`oxyde du manganèse (IV), l`oxyde du plomb (II), le caméléon, l'acide chromique).
Les hydrocarbures saturés – les liaisons organiques qui s`oxydent le plus difficilement. Les conditions sévères sont nécessaires à leur oxydation (par exemple, le mélange chaud de chrome); les oxydants plus mous dans les conditions ordinaires n'agissent pas en eux.
Les alcools primaires et secondaires en comparaison des hydrocarbures s`oxydent dans les conditions plus molles. À l'oxydation des alcools primaires il est nécessaire de dégager vite l'aldéhyde du mélange réactionnaire pour la prévention de son oxydation ultérieure en acide carboxylique.
Les monoacides carboxyliques, en général, sont stables à l'action des oxydants. L'acide formique et les acides avec l'atome tertiaire du carbone dans la -position s`oxydent facilement. À l'oxydation des ces - derniers on résulte les -oxacides :
(CH3)2CH-COOH + [O] (CH3)2COH-COOH
Dans les organismes animaux les monoacides carboxyliques sont aussi capables de s'oxyder, et en outre l'atome de l'oxygène se dirige toujours à la -position. Ainsi, par exemple, dans l'organisme des malade du diabète l'acide butyrique passe à - l'acide oxybutyrique:
CH3-CH2-CH2-COOH + 2O CH3-CH(OH)-CH2-COOH
Les procédés d'oxydo-réduction dans l'organisme. Un des participants de ces procès est le coenzyme NAD +, qui sert de l'accepteur de l'hydrure-ion à la déshydrogénation biologique, en se transformant de plus en forme restaurée NADN.
Par exemple, avec la participation de NAD + se réalise une des réactions les plus universelles de l'oxydation biologique – la déshydrogénation de l'alcool à l'aldéhyde ou au céton.
Les aldéhydes – une des classes s`oxydant le plus facilement des combinaisons organiques. Même des faibles oxydants, comme les réactifs de Tollence ou Ferling, se rétablissent facilement par les aldéhydes. On utilisent les deux réactions comme qualitatif pour la détection du groupe aldéhydique.
L'oxydation des liaisons double le carbone – carboniques. En fonction des conditions l'oxydation des liaisons С=С peut amener aux époxydes, 1-, 2-dioles aux glycoles (dialcools) ou aux combinaisons carbonylées – les produits de la désagrégation de la liaison double.
La capacité des hydrocarbures aromatiques à l'oxydation augmente considérablement au passage du benzol vers la naphtaline et ensuite vers l'anthracène.
Ils sont largement répandus dans la nature et jouent le rôle des stimulants de la croissance, des antibiotiques, ainsi que ils participent aux procédés d'oxydo-réduction accompagnant la respiration.
Les plus importants sont 1,4-quinons, étant de forts oxydants. En acceptant deux électrons et deux protons, ils se rétablissent aux hydroquinones correspondantes.
Par rapport à la plupart des substratums organiques le système «le quinone – l'hydroquinone» joue le rôle de l'oxydant. En acceptant les électrons du substratum, le quinone remplacé in vivo, se transforme en hydroquinone correspondante, qui à son tour, en remettant les électrons (par le système cytochromatique) à l'oxygène, se rétablit à l'inverse à la quinone. Ainsi, le système la quinone – l'hydroquinone participe au procès du transfert des électrons du substratum à l'oxygène.
Pour la restitution des liaisons organiques on peut utiliser pratiquement tous les désoxydants. On utilise le plus souvent l'hydrogène en présence des catalyseurs hétérogènes, les hydrures des métaux et les métaux actifs (Na ou Zn). Le moyen le plus total de la restitution des liaisons insaturées le carbone - carboniques – c`est l'hydrogénation catalytique. Les alcènes, les alcynes, les hydrocarbures aromatiques et leurs dérivées adjoignent l'hydrogène dans la présence des métaux atomisés (le nickel, le platine, le palladium) ou des oxydes des métaux. Les conditions de la réaction dépendent de la nature des substratums et des catalyseurs.
Les tâches standartes et leur résolution
La tâche IХ. Quel produit se forme principalement à la suite de la réaction de bromuration de 3-méthylpentane ?
La
résolution.
Tous les atomes du carbone à 3-méthylpentane se trouvent dans
l'état de la sp![]() -hybridation.
Dans la molécule se trouvent seulement non polaireС–С
et moins polaires С–Н
-liens.
Cela conditionne leur participation aux réactions de la substitution
radical S
-hybridation.
Dans la molécule se trouvent seulement non polaireС–С
et moins polaires С–Н
-liens.
Cela conditionne leur participation aux réactions de la substitution
radical S![]() qui sont
régiosélectives:
en présence des atomes, primaries, secondaires et tertiaires du
carbone la bromuration passe près de l'atome tertiaire (la plus
petite solidité du lien С–Н
et l’atome tertiaire c’est la liaison intermédiaire la plus
stable). En consequence le produit principal de la réaction est
3-brom-3-méthylpentan.
qui sont
régiosélectives:
en présence des atomes, primaries, secondaires et tertiaires du
carbone la bromuration passe près de l'atome tertiaire (la plus
petite solidité du lien С–Н
et l’atome tertiaire c’est la liaison intermédiaire la plus
stable). En consequence le produit principal de la réaction est
3-brom-3-méthylpentan.
![]()
La tâche X. Appelez les produits de la cooperation du propène et 2-butenoïque acide avec le bromhydrogène en présence du peroxyde et sans lui.
La rèsolution. L'addition électrophile des halogènhydrogènes se produit selon la règle de Markovnikov: les atomes de l'hydrogène se joignent vers l'atome du carbone plus hydrogéné. Ainsi, par exemple, à la coopération du pentane avec le chlorhydrogène se forme 2-chlorpropane.
СН3СН=СН2 + НВr СН3СНВr–СН3
propène 2-brompropane
Cependant à 2-butenoïque acide les deux atomes du carbone qui sont lié par le lien double, ont le nombre égal des atomes de l'hydrogène. Dans ce cas on applique la règle de Markovnikov dans la formulation plus totale : l'addition du réactif asymétrique à l'alcène asymétrique selon le mécanisme ionique se produit en direction de la formation de la cation plus stable.
À la densité électronique du -lien s'approche avant tout la particule chargée Н +. À la suite de l'addition de l'ion de l'hydrogène au lien double de l'acide СН3СН=СНСООН se forment deux carbocations:
СН3+СН–СН2СООН (I) et СН3СН2+СНСООН (II)
Dans la cation (I) à côté de l'atome du carbone chargé positivement se trouve le groupe électrodonneur de méthyle possédant l'effet positif inductif qu'amène à la délocalisation de la charge positive et à la stabilisation de la cation. Dans la cation (II) le groupe de méthyle est disposé plus loin, son effet se fait sentir plus faiblement (l'effet inductif selon la chaîne s'éteint). Le groupe carboxylique élecroaccepteur grâce à son effet inductif négatif, au contraire, déstabilise la cation; mais dans la cation (I) elle se trouve - plus loin et son action déstabilisant se fait sentir considérablement moins que dans la cation secondaire (II). Finalement la distribution de la charge dans la cation (I) est plus égale; une telle particule est plus stable, la réaction va selon la voie dirigée par sa formation :
СН3СН=СНСООН + НВr СН3СНВrСН2СООН
2-butenoïque acide 3-brombutenoïque l'acide
En présence du peroxyde la réaction d'addition va selon le mécanisme radical et ne se soumet pas à la règle de Markovnikov :
СН3СН=СН2 + НВr (en présence de Н2О2) СН2ВrСН2СН3
propène 1-brompropane
СН3СН=СНСООН + НВr(en présence de Н2О2) СН3СН2СНВrСООН
2- butenoïque acide 3-brombutenoïque l'acide
La tâche ХI. Pendant le prossesus du métabolisme dans les organismes vivants l'acide fumarique se transforme à l’acide malique. Par quelle voie on peut recevoir l'acide malique de l’acide malique in vitro ?
La résolution. L'acide fumarique c’est l’acide bibasique insaturé (transe-butendique acide). L'acide malique appartient aux hydroxyacides bibasiques saturés (hydroxybutendique acide).
La réaction représente l'addition de l'eau selon le lien multiple. L'hydratation des alcènes passent dans la solution d'eau diluée de l’acide fort, par exemple de l’acide sulfarique. L'acide sert de la source de la particule électrophile (le proton Н +). Le mécanisme de la réaction — l'addition électrophile АЕ.
La densité électronique le carbone-carbonique du -lien dans la molécule de l’acide fumarique est diminuée en conséquence de l’action élecronoaccepteur de deux groupes carboxyliques. C'est pourquoi l'hydratation de l’acide fumarique se passe dans les conditions sévères (la chauffe avec la solution diluée d'eau de l'acide à la température 150 … 200 °С).

фумаровая l'acide l'acide de pomme
l’acide fumarique l’acide malique
L'hydratation de l’acide fumarique in vitro amène à la formation du racémate - du mélange des quantités égales de deux enantiomères de l'acide malique. À l’organisme cette réaction s’est catalisée par le ferment fumarose pour lequel est propre la spécifique sévère spatial que conduit à la formation seulement un stéréoisomère — l'acide L-malique.
La tâche ХII. Écrivez les produits de la mononitration du toluène, l'acide benzoïque et le p-nitrophénol.
La
résolution.
La réaction de la nitration des liaisons aromatiques passe selon le
mécanisme de la substitution électrophile aromatique S![]() Ar.
Le groupe du méthyle dans le toluène se rapporte aux orientants de
la première génération, donc, le groupe nitré entre à orto - et
la para - position par rapport à elle, se forment 2 produits :
o-nitrotoluène et p-nitrotoluène.
Ar.
Le groupe du méthyle dans le toluène se rapporte aux orientants de
la première génération, donc, le groupe nitré entre à orto - et
la para - position par rapport à elle, se forment 2 produits :
o-nitrotoluène et p-nitrotoluène.

Le toluène p - le nitrotoluène l'o-nitrotoluène
toluène p-nitrotoluène o-nitrotoluène
Le coefficient 2 dans l'équation devant le toluène n'est pas mis, puisque de 1 mol du toluène se forme 1 mol du mélange о- et p-nitrotoluènes. A la p-position le produit de la nitration se forme plus, car orto - position est moins avantageuse pour l'attaque à cause des obstacles spatiaux.
Le groupe carboxylique dans l'acide benzoïque se rapporte aux orientants de la deuxième génération, donc, le groupe nitré entre à meta - position par rapport à elle.

L'acide benzoïque le m-nitrotoluène
L’ l'acide benzoïque m-nitrotoluène
Le
groupe carboxylique, comme tous les orientants de la deuxième
génération, ralentit la vitesse de la réaction S![]() ,
c'est pourquoi la réaction passera avec la vitesse plus petite,
qu'en cas du toluène et dans les conditions plus sévères.
,
c'est pourquoi la réaction passera avec la vitesse plus petite,
qu'en cas du toluène et dans les conditions plus sévères.
Si dans la liaison aromatique il y a 2 substituts, il est possible l’orientation coordonnée, ainsi que l'orientation non coordonnée des substituts. En cas du p-nitrophénol le groupe hydroxyle comme orientant de la première génération dirige le groupe nitré à orto-position chez lui-même (para-position est occupé par le nitrogroupe, il n'y a pas d'atome de l'hydrogène pour la substitution); le nitrogroupe comme orientant de la deuxième génération dirige le substitut à la méta-position, c.a.d. le type d’orientation des substituts est coordonné.
La
tâche ХIII.
R-2-brombutan peut réagir avec la solution d'eau de l’hydroxyde du
sodium selon les mécanismes S![]() 1
et S
1
et S![]() 2.
Décrivez le résultat stéréochimique de la réaction dans chaque
cas.
2.
Décrivez le résultat stéréochimique de la réaction dans chaque
cas.
La
résolution.
L'hydrolyse secondaire du dérivé halogéné peut passer selon le
mécanisme mono- et bimoléculaire. 2-butanol c’est le produit.
C’est l’activité optique du produit de la réaction qui sera
divère. Si la réaction passe selon le mécanisme monomoléculaire
(S![]() 1),
le produit intermedière c’est le carbocation secondaireСН3НС+СН2СН3.
L'attaque de la cation par le réactif nucléophyle (par le groupe
hydroxyle) est probable de n'importe quelle direction, à la suite de
la réaction se forme le mélange racémique qui se compose de R - et
S-2-butanol dans le rapport de mol égal. Le mélange se compose des
composants optiquement actifs, mais en tout il n'est pas actif
optiquement.
1),
le produit intermedière c’est le carbocation secondaireСН3НС+СН2СН3.
L'attaque de la cation par le réactif nucléophyle (par le groupe
hydroxyle) est probable de n'importe quelle direction, à la suite de
la réaction se forme le mélange racémique qui se compose de R - et
S-2-butanol dans le rapport de mol égal. Le mélange se compose des
composants optiquement actifs, mais en tout il n'est pas actif
optiquement.
Si
la réaction passe selon le mécanisme bimoléculaire (S![]() 2),
l'état transitif se représente l'ensemble des molécules du
substratum et du réactif nucléophyle, pendant cela l'attaque du
réactif nucléophyle est possible de la partie opposée à l'atome
de l'halogène. La circulation de la configuration c’est le
résultat – on reçoit S-2-butanol (optiquement actif).
2),
l'état transitif se représente l'ensemble des molécules du
substratum et du réactif nucléophyle, pendant cela l'attaque du
réactif nucléophyle est possible de la partie opposée à l'atome
de l'halogène. La circulation de la configuration c’est le
résultat – on reçoit S-2-butanol (optiquement actif).
La tâche ХIV. À l'action sur l'organisme des grandes doses de l'hydrazine ou ses dérivées on observe le détraquement des nerfs. Quelle est la base chimique de l'action de l'hydrazine, si on sait que il réagit avec le coenzyme pyridoxalphosphate?
La résolution. Le pyridoxalphosphate c’est la liaison hétérocyclique contenant dans le cycle à côté d'autres substituts le groupe aldéhydique. L'hydrazine comme le réactif nucléophyle coopère avec l'atome du carbone carbonique. Le produit final de la réaction de l'addition - elimination c’est hydrazone du pyridoxalphosphate .
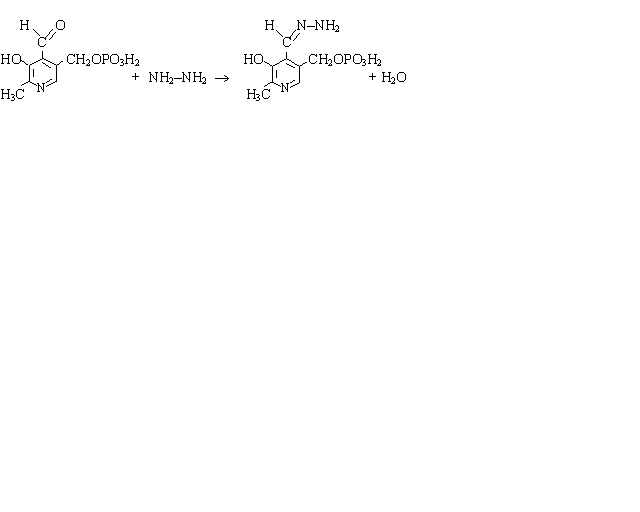
Le pyridoxalphosphate l'hydrazine l’ hydrazone du pyridoxalphosphate
La formation de l’hydrazone amène au blocage du groupe aldéhydique du pyridoxalphosphate ce que viole sa coopération comme du coenzyme avec le groupe aminé de l’acide glutamique. Cette réaction c’est une des étapes de la transformation dans l'organisme de l’acide glutamique à -aminobutyrique acide. Le blocage du coenzyme par l'hydrazine amène au manque de - -aminobutyrique acide freinant la tenue des impulsions nerveuses.
La tâche ХV. L'Alcool méthylique à l'atteinte à l'organisme provoque l'empoisonnement grave accompagné par la privation de la vue, provoqué par l'action du produit de l'oxydation de l'alcool méthylique sur les albumines de la rétine de l'oeil. Écrivez le schéma de la réaction de l'oxydation de l'alcool méthylique.
La résolution. À l'empoisonnement par l'alcool méthylique dans l'organisme sous l'effet du ferment alcooldéhydrogénase se forment le formaldéhyde (méthanal) et l'acide formique qui est plus toxique, que l'alcool méthylique. C'est l'exemple de la synthèse fatale (la transformation en train du métabolisme des liaisons moins toxiques à plus toxique).


l'alcool méthylique méthanal l'acide formique
L'alcool
éthylique C![]() H
H![]() OH
contacte mieux avec le ferment alcooldéhydrogénase . Cela freine la
transformation de l'alcool méthylique au méthanal et à l'acide
formique. L'alcool méthylique est déduit dans l'aspect invariable.
C'est pourquoi l'accueil de l'alcool éthylique à la fois après
l'empoisonnement par l'alcool méthylique réduit considérablement
le degré de l’empoisonnement.
OH
contacte mieux avec le ferment alcooldéhydrogénase . Cela freine la
transformation de l'alcool méthylique au méthanal et à l'acide
formique. L'alcool méthylique est déduit dans l'aspect invariable.
C'est pourquoi l'accueil de l'alcool éthylique à la fois après
l'empoisonnement par l'alcool méthylique réduit considérablement
le degré de l’empoisonnement.
Les tâches pour la résolution indépendante :
2.1. Écrivez les formules des produits les plus probables de la chloration et la sulfo chloration de 2-méthylpentane.
2.2. Écrivez les équations de la réaction d'addition du bromhydrogène à 1-butène en présence du peroxyde et sans elle.
2.3. Les restes de l'acide oléique entrent dans la composition des huiles. Si les huiles entreront dans les réactions de l'hydrogénation ? Si oui, amenez le schéma de la réaction.
2.4. Pourquoi le produit de la réaction de l'hydratation de l’acide propenoïque c’est -hydroxy –mais pas -hydroxypropanoïque acide ?
2.5. Amenez les schémas de la monobromuration de l'aniline, de l’anisol (metoxy-benzol), benzaldéhyde. Disposez ces liaisons en ligne selon le surcroît de vitesse de la nitration.
2.6. Quels produits se forment à la bromuration de o-hydroxybenzoïque acide (salicylique) et de l'éther ordinaire de p - aminobenzoïque acide (anéstézine) ?
2.7. À la bromuration de l’ étherbenzène la substitution peut se passer dans le noyau aromatique et la chaîne latérale. Quelles conditions sont nécessaires pour faire la bromuration de étherbenzène selon chacune de ces directions ? Appelez les produits de la réaction.
2.8. L'oxydation des liaisons aromatiques c’est une des réactions de la biotransformation des xénobiotics dans les organismes vivants. Quels produits se forment à l'oxydation du toluène et de l’isopropylbenzène ?
2.9. Synthétisez l'acide lactique (2-hydroxypropanoïque acide) de l’acide halogéncarbonique correspondent. Selon quel mécanisme passe cette réaction ?
2.10. L'ypérite (,'-dichlordiéthylsulfure C1CH2CH2SCH2CH2C1) se manifeste l'action peau-vésicatoire et le produit de son hydrolyse est moins toxyque. Ecrivez le schéma de la réaction de l'hydrolyse de l'ypérite.
2.11.
D-2-brompentane réagit avec la solution d'eau de l’hydroxyde du
sodium selon le mécanisme S![]() 1.
Décrivez le résultat stéréochimique de la réaction (indiquez la
configuration de l'alcool se formant).
1.
Décrivez le résultat stéréochimique de la réaction (indiquez la
configuration de l'alcool se formant).
2.12. Chloréthon (1,1,1-trichloro-2-méthyl-2-propanol) produit l'action calmant. Écrivez l'équation de l'oxydation de ce médicament.
2.13. Dans l'organisme l'acide pyruvique se rétablit à l’acide lactique. Écrivez le schéma de la réaction de la restitution.
2.14. L'acétone découverte dans l'urine des maladies par le diabète sucrée c’est le premier membre de la série homologique des cétons. Écrivez pour lui la réaction d'addition de l'acide prussique, la réaction de la restitution et de l'oxydation.
Le sujet 3. Les liaisons multifonctionnelles et hétérofonctionnelles,
participant aux procès de l`activité vitale
La grande majorité des matières organiques participant aux procès du métabolisme, représente les liaisons avec deux et plus groupes fonctionnels. On peut classifier ces liaisons d`une manière suivante:
1) les groupes multifonctionnels contenant les groupes fonctionnels identiques, par exemple : éthanediol (éthylèneglycol) СН2ОН – СН2ОН, l'acide oxalique HOOC-COOH;
2) hétérofonctionnels contenant de divers groupes fonctionnels, par exemple : monéthane (amino-éthanol, colamine) СН2ОН–CH2NH2, l'acide pyruvique СН3–С(O)-COOH;
3) hétéromultifonctionnel, par exemple : les monoholosides, l'acide malique: HOOC-CH (OH)- СН2-СООН.
La présence de quelques groupes fonctionnels dans la molécule influence les propriétés chimiques de laliaison. D'une part, les réactions caractéristiques pour chaque groupe séparé peuvent passer, mais sa capacité réactionnaire peut augmenter ou diminuer. D'autre part – de nouvelles propriétés spécifiques, atypiques pour les liaisons monofonctionnelles apparaissent. Les nouvelles propriétés sont très importantes pour la garantie des fonctions biologiques accomplies par ces substances dans l'organisme.
3.1 Les propriétés acide-base (les propriétés acido-basiques). Il existe la régularité totale : la présence dans la molécule des groupes OH, SH, СООН amène au renforcement de ses propriétés acides, et la présence des aminogènes (des groupes aminés) NH2, NH – au renforcement des propriétés des fonctions basiques. La présence du groupe cationoïde supplémentaire près du centre acide entraîne l'augmentation de l'acidité de la liaison, la présence du groupe nucléophile (négatogène) supplémentaire augmente les propriétés des fonctions basiques. Ainsi, l`éthylèneglycol СН2ОН–СН2ОН manifeste des propriétés acides plus fortes en comparaison avec l`alcool СН3–СН2ОН; l'acide oxalique HOOC-COOH c`est l`acide plus fort, que l`acide acétique СН3–СООН, et l'acide lactique СН3–СН (OH)-COOH est plus fort, que l`acide propanoïque СН3–СН2–СООН.
Dans tous les cas énumérés l'effet négatif inductif des résidus (-I-effet) près des groupes CO et СООН conditionne la polarisation considérable de la liaison О–Н et la facilité de l`élimination du proton, c.a.d. le renforcement des propriétés acides.
La présence dans la molécule des groupes fonctionnels divers selon les propriétés acide-base conditionne les propriétés amphotères des combinaisons.
3.2 Les propriétés nucléophile-électrophiles. Il existe la régularité totale, notamment: la présence du résidu cationoïde (-I-effet) facilite le déroulement des réactions nucléophile et embarrasse le déroulement des réactions électrophiles. Ainsi, à la présence de la fonction carboxyle, l'atome de l'halogène, par exemple dans les - acides carboxyliquehalogénés, est remplacé facilement non seulement au groupe hydroxyle (à la coopération avec l`alcali), mais aussi en aminogène (à la coopération avec l'ammoniaque), le mécanisme de la réaction SN :
С Н3–CH–COOH
+ 3NH3
СН3–CH–COONH4
+ NH4C1
Н3–CH–COOH
+ 3NH3
СН3–CH–COONH4
+ NH4C1
Cl NH2
2-chlorpropanoïque acide 2- amin propanoique sel d’ammonium
3.3 Les réactions de la cyclisation. Elles se rapportent aux réactions spécifiques des liaisons hétérofonctionnelles et peuvent être intramoléculaires, ainsi que intermoléculaires en fonction de l'éloignement des groupes fonctionnels l'un de l'autre.
La cyclisation intramoléculaire. Il existe la régularité totale : les réactions sont caractéristiques pour les liaisons hétérofonctionnelles avec - et -position des groupes fonctionnels. Les centres réactionnaires nucléophile et électrophile se trouvent à l'intérieur d'une molécule et se trouvent dans l'espace côte à côte l'un avec l'autre pour le compte de l'existence de la molécule à la forme «roulée» (à la forme de la pince). À la suite des réactions de la cyclisation intramoléculaire peuvent se former les semi-acétals cycliques des alcool-aldéhydes:

Les réactions déroulent spontanément déjà à la chauffe insignifiante. Les produits se formant cycliques s`hydrolysent dans un milieu acide et alcalin avec la formation des sels correspondants.
Dès - et - acides substitués à la suite de la cyclisation intramoléculaire résultent les lactones (des hydroxy-acides) et les lactames (des aminoacides). La lactone, c`est, par exemple la vitamine C.
La cyclisation intermoléculaire. Il y a la régularité totale : les réactions sont caractéristiques pour les - acides-substitués, passent selon le mécanisme de l`elimination intermoléculaire et sont accompagnées par la formation des cycles hexagonaux stables – des diéthers cycliques – des lactides des - hydroxy-acides; ou des diamides cycliques – des dicétopipérazines des - aminoacides :

On peut rapporter ces réactions aux réactions de la déshydratation.
3.4 Les réactions de la complexation. Il y a la régularité totale: les liaisons multifonctionnelles et hétérofonctionnelles avec la - position du groupe fonctionnel jouent le rôle des ligands à la coopération (l`action mutuelle) avec les ions des métaux de transition (de passage) avec la formation des liaisons intracomposées – des chélateurs.
Les reactions de chélation sont la propriété spécifique des liaisons multifonctionnelles et hétérofonctionnelles; sont extraordinairement répandues et jouent le rôle essentiel dans les procès du métabolisme. L` un des exemples – la formation du sel intracomplexe –glycinate du cuivre – à la coopération dans la solution du glycine (glycocolle) avec les sels du cuivre (II) :

La plupart des ions des métaux dans l'organisme se trouvent sous forme des complexes chélatés avec les ligands organiques. L` un des exemples de telles combinaisons c`est la structure hémo dans l'hémoglobine.
