
- •La chimie bioorganique
- •1.1 L'introduction
- •1.2 Les théories de la structure des liaisons organiques
- •Les positions principales de la théorie de la structure des liaisons organiques de Butlerov
- •Les alcènes Les alcadiènes Les alcynes
- •1.4. La nomenclature des liaisons organiques
- •1.5. L'isomérie des liaisons organiques.
- •1.6. La structure électronique de l'atome du carbone, l'hybridation
- •1.7. Les systèmes conjugués
- •1.8. Les effets électroniques (inductif et mésomère)
- •Н н
- •1.9. L`Acidité et la basicité des liaisons organiques
- •2.1 La caractéristique générale des réactions chimiques
- •2.2 Les réactions radicales
- •2.3 Les réactions de l'addition (l`adjonction) électrophile
- •2.5 Les réactions nucléophiles
- •2.6 Les réactions d'oxydo-réduction (ror)
- •3.5. Les classes des liaisons hétérofonctionnelles
- •3.6 Les dérivées hétérofonctionnelles du benzol comme les préparations médicinals.
- •5.5 La structure spatiale des polypeptides et des protéines
- •6.1 L`isomérie optique des monosaccharides.
- •6.4 Les oligo - et les polysaccharides
- •7.1. Les nucléosides.
- •8. 1 Les lipides simples saponifiables
- •8.2. Les lipides complexes saponifiables
- •8.3 Les lipides insaponifiables ou les biorégulateurs bas-moléculaires
- •9. Les travaux laboratoires
- •9.1. Les règles de sécurité technique au travail dans les laboratoires chimiques.
- •9.2. Les régularités totales de la capacité réactionnaire des liaisons organiques
- •3.2 Les propriétés de l'acide salicylique
- •9.3. La structure et les propriétés des biopolymères
- •Le travail de laboratoire № 7.
- •3. L-2-brombutan réagit avec la solution d'eau d’hydroxyde du sodium selon le mécanisme s2. Prédisez le résultat stéréochimique de la réaction (indiquez la
- •3. Si on peut à l'aide de la réaction de Fol (avec l'acétate du plomb) distinguer la cystéine de la sérine?
- •3. Dans la composition d’adn en quantité du composant glucidique se trouve :
- •4. Les bases puriviques dans les nucléosides se joignent à l'hydrate de carbone selon l'atome de l'azote et forment le lien :
1.5. L'isomérie des liaisons organiques.
Si deux ou plus de substances individuelles ont la composition quantitative identique (la formule moléculaire), mais se distinguent par la succession du liage des atomes ou par leur disposition dans l'espace, dans le cas total ils s'appellent les isomères. Comme la structure de ces liaisons est différente, les propriétés physiques et chimique des isomères se distinguent (sauf les enantiomères) .
Les types de l'isomérie : structural (les isomères de la structure) et la stéréoïsomérie (spatial).
L'isomérie structurale peut avoir trois aspects :
- L'isomérie du squelette carbonique (les isomères de la chaîne) : le butane et 2-méthylpropane;
- Les isomères de la position des groupes fonctionnels (ou des liens multiples): 1-butanol et 2-butanol ou 1-buten et 2-buten;
- Les isomères du groupe fonctionnel (interclasses) : 1-butanol et l’éther d’ éthyle.
La stéréoïsomérie se subdivise en la stéréoïsomérie de conformation et de configuration.
Les conformations des molécules se représentent ses diverses formes géométriques qui surgissent pendant la rotation autour des -liens simples.
La configuration c’est un ordre de la disposition des atomes dans l'espace sans compte des différences apparaissant en conséquence de la rotation autour des -liens simples.
Les conformations des molécules organiques
Le tournant autour du -lien С–С s'accomplit facilement, la chaîne de hydrocarbure peut prendre des formes différentes. Les formes conformatiques passent facilement l'une à l'autre c’est parce qu’elles ne sont pas de diverses liaisons; ce sont des formes instables dynamiques différentes de la même molécule. La difference de l’énergie entre les conformers a le même ordre que l'énergie de l'agitation thermique ( quelques kJ/mol). C'est pourquoi pendans les températures ordinaires on ne peut pas dégager les conformèrs séparés, au cause du mouvement thermique les molécules ressentent les transformations conformatique permanents.

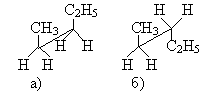
a) b) c)
La fig. 2 – les conformers du pentane: a) la disposition possible dans l’espace; b) la conformation couverte, c) la conformation freinée.


b)
La fig.3 – Les formules à projections de Njumen: a) la conformation couverte, b) la conformation freinée.
Les configurations couvertes et freinées se distinguent par la disposition munuelle des substituants près de l’atome du carbone qui tournent les uns relativement aux autres. Les molécules des alcanes se représentent les mélanges des conformers.
Pour
la représentation des conformations on utilise les formules à
projections de Niumen qu’on reçoit à la projection sur le plan de
la molécule S-S –du lien. Comme exemple sur le dessin 3 on a
montré les conformations du pentane relativement au lien С![]() –С
–С![]() .
On désigne l'atome du carbone (С
.
On désigne l'atome du carbone (С![]() )
plus proche à l'observateur par le point au centre du cercle; le
cercle symbolise l'atome du carbone plus loin (С
)
plus proche à l'observateur par le point au centre du cercle; le
cercle symbolise l'atome du carbone plus loin (С![]() ).
Trois liens de l'atome on les représente en forme des lignes qui se
separent du centre du cercle — pour l'atome proche (С
).
Trois liens de l'atome on les représente en forme des lignes qui se
separent du centre du cercle — pour l'atome proche (С![]() )
et pour l'atome loin (С
)
et pour l'atome loin (С![]() ).
Si les atomes et les groupes liés aux atomes du carbone examinés
couvrent l'un l'autre, telle conformation s'appelle couverte (fig.
3а), au tournant d'un des atomes relativement à l’autre sur 60
).
Si les atomes et les groupes liés aux atomes du carbone examinés
couvrent l'un l'autre, telle conformation s'appelle couverte (fig.
3а), au tournant d'un des atomes relativement à l’autre sur 60![]() on a reçu la conformation freinée qui énergétiquement plus
avantageuse (fig. 3b). Dans la conformation freinée la distance
entre les substituants est plus grande, en conséquence de quoi les
forces du repoussement dans la conformation freinée sont plus
faibles par comparaison avec la conformation couverte.
on a reçu la conformation freinée qui énergétiquement plus
avantageuse (fig. 3b). Dans la conformation freinée la distance
entre les substituants est plus grande, en conséquence de quoi les
forces du repoussement dans la conformation freinée sont plus
faibles par comparaison avec la conformation couverte.
Les isomères de configuration
Ce sont des stéréoïsomères avec une diverse disposition autour des atomes définis des autres atomes, des radicaux; ou des groupes fonctionnels dans l'espace relativement l'un à l'autre.
On distingue les notions de la diastéréoïsomérie et enanstéréoïsomérie.
On appelle les diastéréoïsomères les isomères actifs optiquement – les liaisons qui sont capables de changer le plan de la polarisation de la lumière plan-polarisée.
La lumière se représente les ondes électromagnétiques dans lesquelles les particules hésitent dans toutes les directions des plans mutuellement perpendiculaires et perpendiculairement à la diffusion de l'onde. Dans la lumière plan-polarisée les hésitations des particules se trouvent dans le même plan. Si le rayon passe à travers de la substance transparente qui est capable de tourner le plan des hésitations du champ électrique sur un certain angle et de leur donner la nouvelle direction on dit dans ce cas que cette substance possède l'activité optique.
On peut formuler 2 signes de l'activité chimique des liaisons organiques : la présence de l'atome asymétrique du carbone et l'absence dans la molécule des éléments de la symétrie.
L'atome asymétrique du carbone c’est l'atome lié à quatre divers atomes ou les groupes ( désigné par l'astérisque : *С).
Les axes ou les plans de la symétrie peuvent être caractérisés pour de diverses molécules. Ainsi dans la molécule du trichloro-méthane du (chloroforme) le plan de la symétrie passé à travers du fragment Н–С–С1. Il y a cependant des molécules qui ne possèdent pas le plan de la symétrie qui se trouvent incompatibles avec sa représentation de miroir. Cette propriété s'appelle la chiralité, les molecules s’appellent chirales.
Le terme "la chiralité" signifie que deux objets se trouvent sous une telle relation l'un à l'autre, comme de mains gauches et droites (vient du mot cheir — la main), c’est-à-dire ils se représentent les représentations de miroir ne coïncidant pas à la tentative de les cumuler dans l'espace. Dans notre entourage se rencontrent souvent les objets chirales : une paire des souliers, une paire des gants etc. Comme exemple spectaculaire de l'incompatibilité de l'objet et sa représentation de miroir on peut citer l'impossibilité de mettre à une main gauche le gant droit qui correspond à la disposition spatiale de la main droite. La chiralité en premier lieu la notion géométrique, et non chimique.
Du point de vue de l’optique les isomères actifs étant les réflexions de miroir l'un à l'autre s'appellent les énantiomères. Les énantiomères possèdent les propriétés identiques physiques et chimiques, tournent le plan de la polarisation de la lumière plan-polarisée sur le même angle mais dans les directions opposées. Le mélange comprenant des quantités égaux de mols des énantiomères s'appelle le mélange racémique ou le racémate. Le racémate n'est pas actif optiquement.
On appelle les enantiomères selon R, S ou D, L - nomenclatures. R, S - nomenclature décrit la configuration absolue des isomères. D, L- nomenclature - la configuration relative (en ce qui concerne la configuration de l'aldéhyde de glycérine).
Diastéréoïsomères
À la différence des enantiomères les diastéréoisomères possèdent la distinction considérable dans les propriétés physiques et chimiques. La notion diastéréoïsomérie concerne un grand nombre de stéréoisomères. Parmi eux il faut mettre en relief deux groupes : -diastéréoisomère et -diastéréoisomère.
 -Diastéréoisomères
contiennent dans la molécule plus d'un centre de la chiralité, dans
les -diastéréoisomères
les substituants sont liés au centre de la chiralité par les
-liens.
Telles diastéréoisomères s’appellent -diastéréoisomères.
Par exemple, D-ribose, D-arabinose, D-xylose et D-lyxose sont les
-diastéréoisomères,
D-lyxose et L-lyxose sont les enatiomères.
-Diastéréoisomères
contiennent dans la molécule plus d'un centre de la chiralité, dans
les -diastéréoisomères
les substituants sont liés au centre de la chiralité par les
-liens.
Telles diastéréoisomères s’appellent -diastéréoisomères.
Par exemple, D-ribose, D-arabinose, D-xylose et D-lyxose sont les
-diastéréoisomères,
D-lyxose et L-lyxose sont les enatiomères.
-Diastéréoisomère (géométriques ou cyc- trans-isomères)
On rapporte vers -diastéréoisomères les isomères de configuration contenant le -lien. Cet aspect de la diastéréoisomérie est caractéristique, en particulier, pour les alcènes. Relativement du plan du -lien les substituants identiques près de deux atomes du carbone peuvent s'installer selon une (cyc-) ou selon différente (la transe-) partie. La cause principale de l'existence de «cyc» - et «trans»-isomères consiste en impossibilité de la rotation autour du -lien sans sa violation.
Cyc- et trans-isomères ont la succession identique de la liaison des atomes, mais se distinguent par la disposition spatial des substituants et c'est pourquoi ils sont les stéréoisomères. D'autre part leur molécules sont achirales (dans les molécules il n’a pas de centres chirales). Ainsi, cyc - et trans-isomères des alcènes sont diastéréoisomères l'un relativement à l'autre et possèdent de différentes propriétés.
Н
 СООН
Н Н
СООН
Н Н
С = С С = С
Н СООН
trans-isomère et cyc-isomère de l’acide cinnamique
-diastéréoisomères se rencontrent parmi les liaisons naturelles en particulier pour la garantie de l'acuité visuelle il est particulièrement important l'isomère rétinole (vitamine A), dans lequel tout 4 liens doubles se trouvent dans la transe - configuration.
