
- •1.Общие положения
- •1.1. Экономические и экологические аспекты коррозии
- •1.2. Классификация корррозионных процессов.
- •1.3 Цели и методы коррозионных исследований
- •2. Теоретические основы химической коррозии
- •2.1. Коррозия металлов в жидких неэлектролитах
- •2.2. Газовая коррозия металлов
- •Контрольные вопросы.
- •3. Теория электрохимической коррозии
- •3.1. Механизм электрохимической коррозии
- •3.1.1. Коррозионные гальванические элементы
- •3.1.2. Термодинамическая возможность электрохимической коррозии. Стандартные электродные потенциалы
- •3.1.3. Обратимые электродные потенциалы. Уравнение Нернста
- •3.1.4. Необратимые электродные потенциалы. Диаграммы Пурбе.
- •3.2. Кинетика коррозионных процессов
- •3.2.1. Кинетика электродных процессов
- •Iкорр » k ÖaNa(Hg) (3.14.)
- •3.2.2. Коррозионные диаграммы
- •3.2.3. Кинетика катодных процессов
- •3.2.4. Кинетика анодных процессов
- •3.3. Пассивность металлов. Теории, практическое применение.
- •3.4. Многоэлектродные системы
- •3.5. Определение тока коррозии методом поляризационного сопротивления
- •3.6. Внутренние и внешние факторы электрохимической коррозии
- •3.6.1. Внутренние факторы электрохимической коррозии
- •3.6.2. Внешние факторы электрохимической коррозии
- •Контрольные вопросы
- •4. Методы защиты от коррозии
- •4.1. Защита металлов от коррозии покрытиями
- •4.1.1. Металлические защитные покрытия
- •4.1.2. Неметаллические неорганические защитные покрытия
- •4.1.3. Органические защитные покрытия
- •Взаимодействие лкм с твердой поверхностью
- •Способы нанесения лкм на поверхность
- •Органические защитные покрытия
- •4.2. Электрохимическая защита
- •4.2.1. Катодная защита
- •4.2.3. Анодная защита
- •4.2.4. Электрическая дренажная защита
- •4.3. Защита металлов от коррозии обработкой коррозионной среды
- •4.3.1. Ингибиторная защита
- •4.3.1.1. Ингибиторы кислотной коррозии металлов
- •4.3.1.2. Ингибиторы коррозии металлов в воде и водных растворах солей
- •4.3.1.3. Ингибиторы атмосферной коррозии металлов
- •4.3.1.4. Ингибиторы коррозии металлов в неводных жидких средах
- •4.3.2. Удаление и ввод кислорода.
- •4.3.3. Образование солевых пленок из солей жесткости
- •4.4. Защита металлов от коррозии путем воздействия на конструкцию
- •4.4.1. Предотвращение контактной коррозии.
- •4.4.2. Учет влияния напряженного состояния на скорость коррозии.
- •4.4.3. Учет распределения температуры между элементами конструкции
- •Контрольные вопросы
- •5. Примеры решения задач.
- •6. Лабораторный практикум
- •6.4.Оксидирование алюминия
- •6.5.Электролитическое цинкование стали
- •6.6.Фосфатирование стали
- •Рекомендуемая литература:
6.5.Электролитическое цинкование стали
Цель работы - электролитическое получение цинкового покрытия из различных электролитов и определение выхода металла по току.
Основные понятия
Цинк является наиболее распространённым металлом, применяемым для защиты железа и его сплавов от атмосферной коррозии. Около 50% мировой добычи цинка потребляется для защиты чёрных металлов от коррозии. Такое широкое применение цинковых покрытий для защиты от коррозии объясняется значительным электроотрицательным значением его потенциала (нормальный потенциал цинка по отношению к водородному электроду равен - 0,76 В). В паре с железом цинк образует короткозамкнутый гальванический элемент, в котором цинк является растворимым электродом (анодом); он защищает железо от коррозии электрохимически. Скорость коррозии цинковых покрытий в городской атмосфере составляет 40 г/(м2год), или 5 мкм/год. Таким образом, долговечность покрытия при толщине 25 мкм составляет 5 лет.
Процесс электролитического цинкования осуществляется на катоде из растворов цинковых солей по реакции
Zn+2 + 2e- Zn0 (1)
Наряду с реакцией выделения Zn на катоде может протекать реакция выделения водорода
2H+ + 2e- H2 (2)
Теоретическое количество выделившегося металла mтеорможно определить по закону Фарадея, то есть
mтеор = qI ,
где q — электрохимический эквивалент металла:
q
=
![]() ,
,
Am — атомная масса металла; n — число электронов, принимающих участие в реакции; F — число Фарадея; I — сила тока; — время осаждения металла.
С учётом того, что наряду с выделением металла по формуле (1) протекает выделение водорода по формуле (2), количество выделившегося металла
mпр = mтеор Вт = qIВт ,
где Вт — выход по току, коэффициент, показывающий, какая доля тока пошла на выделение металла из раствора.
Обычно Вт определяют в процентах
Вт = mпр / mтеор 100,%. (3)
Как правило, условия электрохимического процесса подбирают такие, при которых достигается наибольшее значение выхода по току.
Цинкование осуществляется из кислых электролитов, главным компонентом является сульфат цинка ZnSO47H2O и из щелочных электролитов, где цинк находится в виде комплексных ионов. Кислые электролиты достаточно устойчивы, высокопроизводительны, но качество осадка на сложнопрфилированных изделиях неудовлетворительно вследствие низкой рассеивающей способности. Цинкатные электролиты достаточно устойчивы, высокопроизводительны и позволяют получить высококачественные покрытия, так как обладают высокой рассеивающей способностью. В настоящее время широко применяются следующие составы электролитов и режимы электролиза :
Цинкатный электролит с добавкой блескообразователя Лимеда Ц-2
ZnO 10 - 14 г/л; NaOH 80-120 г/л:
Лимеда Ц-2 4 - 10 мл/л.
Режим электролиза: плотность тока 1-4 А/дм2; температура 20-30 0С.
2. Кислый сульфатный электролит
ZnSO47H2O 200-300 г/л; Na2SO410H2O 200-250 г/л;
Al2(SO4)310H2O 30 г/л; декстрин 8- 10 г/л.
рН = 3,5-4,5; t = 15-25; i = 1-2 А/дм2.
Рис.
6.3. Схема электролизера для нанесения
гальванических покрытий: А –
аноды(металл-покрытие), К - катоды(покрываемая
деталь).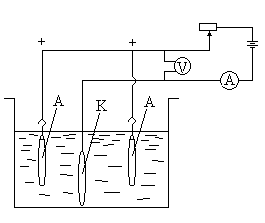
Методика и техника эксперимента
Электролитическое
цинкование стали осуществляется на
установке аналогичной той, схема которой
приведена на рисунке 6.2. при одном
существенном различии- исследуемый
образец завешивается в качестве катода;
аноды растворимые из цинка высокой
чистоты.
Выход по току определяется в электролитической ячейке. Стальной катод обезжиривают ацетоном, травят в HCl, промывают, сушат и взвешивают на аналитических весах. Ячейку заливают исследуемым электролитом и собирают схему установки. Подключают источник постоянного тока и устанавливают силу тока, рассчитанную по уравнению
I = i S ,
где S — площадь катода.
Плотность тока i выбирается в соответствии с режимом работы применяемого электролита.
Время электролиза (ч) вычисляют по формуле
= Zn/qiВт , (4)
где — толщина покрытия, мкм; Zn — плотность цинка, кг/м3 ; q-электрохимический эквивалент, кг/Ачас; I- плотность тока, А/м2.
Время электролиза должно обеспечивать получение покрытия толщиной приблизительно 10 мкм. Выход по току для расчёта по уравнению (4) принимается равным 100%. По окончании опыта катод 3 (см. рис.) промывают, сушат и взвешивают. Выход по току рассчитывают по формуле (3). Результаты экспериментов заносят в таблицу.
Состав эле- ктролита |
Плотность тока,А/м2 |
Время осаж- дения, час |
М1,г
|
М2,г |
Выход по току, % |
|
|
|
|
|
|
Выводы:
