
- •1. Основные термины и определения
- •2. Правила округления значений погрешности и результата измерений
- •3. Минимизация систематических составляющих погрешностей измерений
- •4. Расчет погрешности прямого однократного измерения
- •Пример 1. Обработка результата однократного измерения
- •5. Обработка результатов прямых многократных наблюдений
- •Коэффициент Стьюдента в зависимости от количества наблюдений n и от значения доверительной вероятности
- •Пример 2. Обработка результатов прямых многократных наблюдений
- •5. Вычисление погрешности косвенных измерений
- •Метод измерений и расчетные формулы
- •Порядок выполнения работы а) Подготовительная часть
- •Б) Измерение плотности материала призмы
- •В) Измерение плотности материала прямого цилиндра
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № I - 2 измерение ускорения свободного падения с использованием различных маятников
- •Введение
- •Описание установки и методики измерений
- •Задача 1. Определение ускорения силы тяжести с помощью модели математического маятника
- •Задача 2. Определение ускорения силы тяжести с помощью физического маятника
- •Задача 3. Определение ускорения силы тяжести с помощью оборотного маятника
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № I - 3 изучение законов вращательного движения
- •Введение
- •Задача 1. Изучение кинематики вращательного движения
- •Описание блока разгона – торможения
- •Методики измерения углового ускорения на стадии разгона
- •Методика измерения угловой скорости на стадии равномерного вращения
- •Порядок выполнения работы а. Измерение углового ускорения в режиме разгона
- •Б. Измерение угловой скорости вращения диска в режим равномерного вращения
- •В. Измерение углового ускорения в режиме торможения
- •Обработка результатов измерений
- •Задача 2. Определение момента инерции диска методом вращения
- •Описание лабораторной установки и методики измерений
- •Порядок выполнения работы и обработки результатов измерений
- •Контрольные вопросы.
- •Литература
- •Лабораторная работа № I – 4 измерение моментов инерции маятника обербека
- •Введение
- •Описание установки и метода измерения момента инерции
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № I - 5 измерение скорости полета пули с помощью баллистического маятника
- •Введение
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № I - 6 измерение ускорения свободного падения с помощью прибора атвуда
- •Введение
- •Описание прибора Атвуда
- •Измерение ускорения свободного падения
- •Порядок выполнения работы
- •Измерение ускорения свободного падения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Описание прибора и метода измерения момента инерции
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № I - 9 измерение коэффициента поверхностного натяжения
- •Введение
- •Методика измерения коэффициента поверхностного натяжения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № I - 10 измерение среднеквадратической скорости движения молекул
- •Введение
- •Измерительная установка и методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
Контрольные вопросы
1. Что представляет собой поверхностное натяжение? Дать определение коэффициента поверхностного натяжения.
2. Что такое свободная энергия поверхности жидкости?
3. Что такое радиус молекулярного взаимодействия и какова толщина поверхностного слоя жидкости?
4. Привести примеры практического использования в геофизике таких свойств тел, как смачивание и поверхностное натяжение.
5. Как коэффициент поверхностного натяжения зависит от температуры?
6. Почему маленькие капельки жидкости имею обычно сферическую форму, а большие похожи на сплющенные эллипсоиды?
Литература
1. Cавельев И.В. Курс физики: Учебник в 3-х томах. Т.1: Механика. Молекулярная физика. М., - Наука, 1989. - 352 с.
2. Трофимова Т.И. Курс физики: Учебное пособие для вузов. 6-е изд. стер. – М., Высшая школа, 1999. – 542 с.
Лабораторная работа № I - 10 измерение среднеквадратической скорости движения молекул
Цель работы: определение среднеквадратической скорости движения мол уха при нормальных условиях.
Приборы и принадлежности: стеклянный баллон, ручной поршневой насос, манометр, запорный кран, соединительные шланги.
Введение
Согласно молекулярно-кинетическим представлениям все вещества состоят из хаотически движущихся и взаимодействующих друг с другом частиц. В газах при нормальных температуре и давлении расстояния между отдельными частицами многократно превышают размеры самих частиц. Это позволяет пренебречь потенциальной энергией взаимодействия молекул газа и считать, что его внутренняя энергия целиком обусловлена кинетической энергией молекул.
Ввиду того, что в результате соударений молекул значение и направление их скорости претерпевает непрерывные изменения, причем все направления в пространстве равноправны, среднее значение вектора скорости молекулы равно нулю. Поэтому для характеристики скорости молекул используют величину, называемую среднеквадратической скоростью Vср.кв. которая определяется как:
Vср.кв. = (< V >2)1/2, (1)
где < V >2 - среднее значение квадрата скорости молекул газа.
Оценка этой скорости производится статистическими методами с помощью полученной Максвеллом функции, которая описывает распределение молекул газа по скоростям:
F(V) =![]()
![]() exp
exp![]() ,
(2)
,
(2)
где:
m - масса молекулы;
k= 1,38 ![]() Дж/К - постоянная Больцмана;
Дж/К - постоянная Больцмана;
T - абсолютная температура.
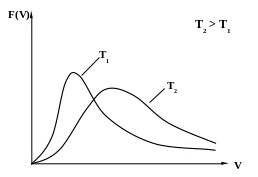
Рис. 1
Функция распределения Максвелла F(V) (рис.1) имеет следующие свойства:
1) произведение F(V)dV равно вероятности того, что скорость молекулы заключена в интервале от V до V + dV;
2) вероятность того, что скорость молекулы находится в интервале от V1 до V2 , равна:
P =
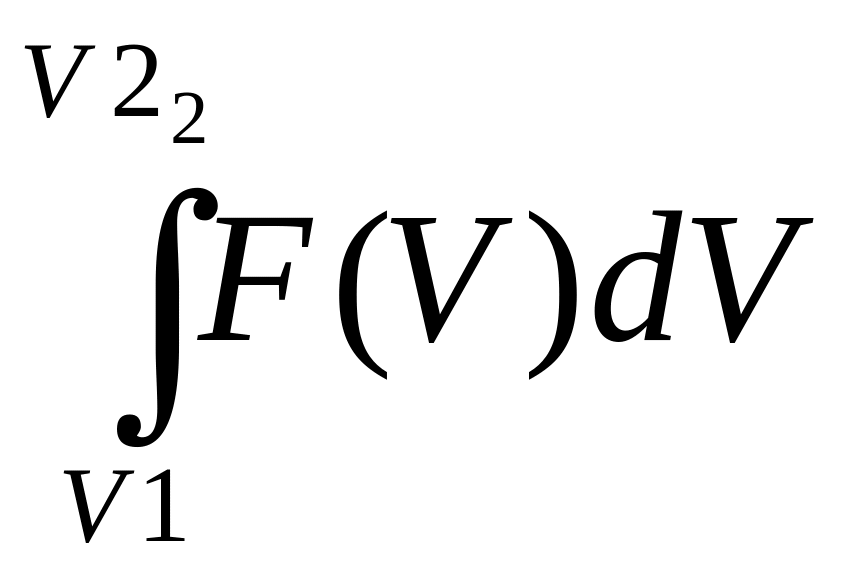 ;
;
3) полная площадь между кривой F(V) и осью абсцисс, то есть вероятность того, что скорость молекулы имеет хоть какое-нибудь значение, равна:
![]() .
.
Используя функцию F(V), среднее значение квадрата скорости молекул можно вычислить по формуле:
< V >2
=
![]() ;
(3)
;
(3)
а среднеквадратическую скорость - по формуле:
Vср.кв. =
![]()
![]() , (4)
, (4)
где: R= 8,31 Дж/(мольК) - универсальная газовая постоянная;
- масса моля газа.
Значение Vср.кв. молекул воздуха может быть вычислено по формуле (4) при известных значениях T и . Однако, это значение может быть определено экспериментально на основе зависимости скорости звука в газах от температуры. В рамках МКТ получено:
Vзв.=
![]() , (5)
, (5)
где = Cp / CV - отношение теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме.
Из (4) и (5) следует, что среднеквадратическая скорость движения молекул воздуха равна
Vср.кв.
= Vзв.![]() .
(6)
.
(6)
Таким образом, значение Vср.кв. можно рассчитать по формуле (6) на основании экспериментальных значений Vзв. и воздуха.
Теплоемкость газа зависит от условий его нагревания.
В случае выполнения условия неизменности объема газа его работа равна нулю и согласно первому закону термодинамики вся теплота, подводимая к газу, идет на изменение его внутренней энергии газа. т.е.
dQ = dU.
Поэтому для одного моля идеального газа:
CV
=
![]() =
=
![]() =
=
![]() R
, (7)
R
, (7)
где i - число степеней свободы молекулы газа.
В случае, если при подводе теплоты к газу создаются условия постоянного давления, то газ расширяется и теплота расходуется как на увеличение внутренней энергии, так и на работу против внешних сил (dA = pdV). В итоге:
Cp=
+ p![]() =
CV + p
. (8)
=
CV + p
. (8)
Для одного моля газа:
Cp = CV + R = R(i+2)/2. (9)
Из формул (7)и (9) следует, что комплекс = Cp / CV можно представить как =(i+2)/i.
Измерение Cp и Cv в отдельности представляет большие трудности, поскольку теплоемкость газа составляет ничтожную долю теплоемкости сосуда, в котором он находится. Измерение же их отношения является более простой экспериментальной задачей.
Следует отметить, что все приведенные выше соотношения, полученные для идеального газа, справедливы и для реальных газов при невысоких давлениях.
