
- •Абсолютная и относительная погрешности.
- •2. Классификация погрешностей
- •По форме представления:
- •2. По причине возникновения:
- •3. По характеру проявления:
- •5. Генеральная и выборочная совокупность
- •6. Среднее арифметическое выборочной совокупности. Случайное отклонение.
- •7. Выборочное стандартное отклонение. Дисперсия
- •8. Среднеквадратичное отклонение
- •9. Нормальное распределение
- •10. Распределение Стьюдента
- •11. Требование к пробе анализа. Генеральная, средняя, лабораторная и анализируемая проба
- •12. Отбор проб газов, жидкостей и твердых веществ.
- •13. Отбор проб пищевой продукции и продовольственного сырья.
- •14. Общие принципы подготовки проб к анализу
- •15. Метод разложения проб
- •16. Растворение проб
- •17. Сплавление пробы
- •18. Пиролиз пробы
- •19. Метод разделения и концентрирования
- •20. Сущность титриметрии
- •21. Стандартизация растворов титрантов
- •22. Точка эквивалентности
- •23. Точка конца титрования
- •24. Кривые титрования
- •Кривая титрования реакции кислотно-оснавного взаимодействия между нсi и NaOh
- •Кривая титрования слабой кислоты и сильного основания
- •Кривая титрования многоосновных кислот и оснований
- •25. Способы титрования
- •26. Индикаторы и правила выбора индикатора
- •27. Гальванический элемент
- •28. Общие принципы электрохимических методов анализа. Классификация электродов и электродных систем.
- •29. Метод прямой кондуктометрии
- •30. Безэлектродная кондуктометрия
- •31. Кондуктометрическое титрование
- •32. Сущность потенциометрического анализа.
- •33. Методы прямой потенциометрии
- •34. Электроды сравнения и индикаторный электрод
- •35. Ионоселективные электроды
- •1. Первичные:
- •2. Сложные и многомембранные
- •36. Методы потенциометрического титрования
- •38. Сущность кулонометрического анализа.
- •42. Схема установки полярографического анализа
- •43. Методы полярографии
- •44. Метод дифференциальной полярографии
- •45. Инверсионная вольтамперометрия
- •48. Основы хроматографии:
- •50. Хромотографич колонки:
- •52. Радиоактивность. Методы регистрации радиоактивности
29. Метод прямой кондуктометрии
КОНДУКТОМЕТРИЯ - совокупность электро-хим. методов анализа, основанных на измерении электропроводности анализируемого раствора.
В том, что по электропроводности определяют концентрацию анализируемого раствора заключается сущность метода прямой кондуктометрии.
![]()
![]()
Эти функциональные зависимости, рассчитанные ими, получают опытным путем.
Недостатки метода ПК: малейшие примеси в растворе могут существенно изменить электропроводность и т.о.исказить результаты анализа.
Применение метода ПК: этот метод используется для анализа чистых растворов и его широко применяют в автоматическом контроле различных продуктов, особенно широко его используют в химической, пищевой и формакологической области.
Электропроводность раствора можно определить с помощью простейшего электрического устройства, который называются мостик Кальрауша.
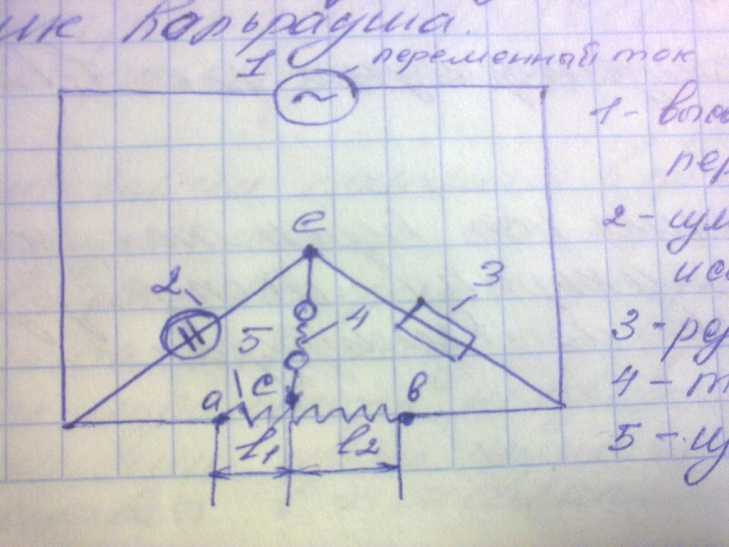
1-высокочастотный генератор переменного тока
2-измерительная ячейка с исследуемым раствором
3-резистор с постоянным сопротивлением
4-телефон переменного тока
5- измерительный мостик с клемами
30. Безэлектродная кондуктометрия
В настоящее время используют и бузэлектродную кондуктометрию, в которой используются токи применяемые в промышленности, т.е. ток с частотой 50 Гц.
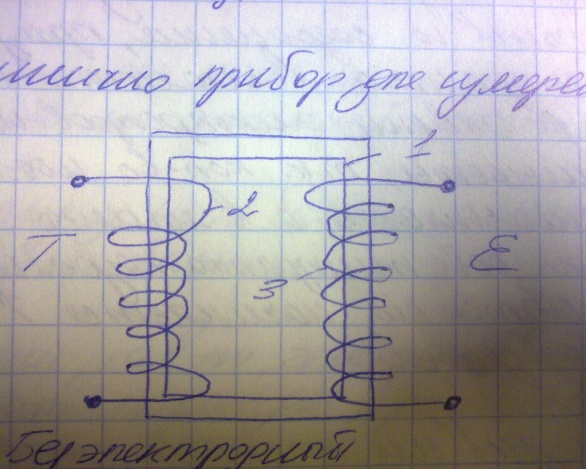
Прибор для измерения ЭДС:
1-металлическая рамка выполненная из пластин
2- первичная обмотка
3- вторичная обмотка
Если на первичную обмотку подать напряжение (Т), то во вторичной появится ЭДС = ﻉ
Отношение возбужденной во вторичной обмотке ЭДС (ﻉ) к напряжению первичной обмотки прямо пропорциональна электропроводности раствора, которая находится внутри металлической рамки и прямо пропорциональна коэффициенту трансформации(К).

31. Кондуктометрическое титрование
Наибольшее распространение имеет косвенный метод кондуктометрии – кондуктометрическое титрование, кот широко применяется при титровании окрашенных и мутных р-ров, когда обычные цветовые индикаторы не применимы, т к изменение цвета в точки эквивалентности увидеть невозможно. При титровании определяемого вещ-ва А р-ром вещ-ва В в точке эквивалентности наступает резкое изменение электропроводности р-ра. Например при титровании с получением нерастворимого или слабо диссоциирующего соединения при добавлении титранта (при его недостатке) электропроводность р-ра снижается, т к число свободных ионов уменьшается при их переходе в нерастворимое состояние, а в случае избытка титранта электропроводность р-ра начинает увеличиваться.
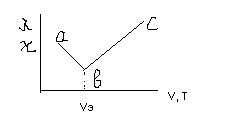
Участок ab соответствует недостатку титранта, bc – избытку. Min на кривой титрования – точка b соответствует минимуму ионов носителя токов, а значит точки эквивалентности. Т. о. по эквивалентному объему Vэ титранта можно определить концентрацию растворенного вещ-ва в р-ре. Углы наклонов участков ab и bc зависят от подвижности ионов, получаемых из вещ-ва А и В.
Замена менее подвижных ионов на более подвижные приводит к росту электропроводности р-ра и наоборот. Увеличение концентрации иона также приводит к росту электропроводности. Поэтому быстрота увеличения или уменьшения электропроводности при титровании зависит от соотношения: подвижности ионов, имеющихся в р-ре до и после добавления титранта; от концентрации ионов до и после добавления титранта. Подвижность иона, т е быстрота его разгона в электрическом поле определяется его электрическим зарядом и массой, кот зависит от атомной массы атома.
Т е больше заряд и меньше массавыше подвижность иона.
Встречаются и такие кривые титрования:
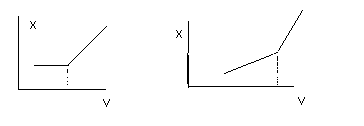
Точки перегиба линии соотв точкам эквивалентности, но 1 рисунок характерен при титровании водного р-ра нитрата серебра водным р-ром BaCl2. При избытке титранта ионов серебра в р-ре не остается, но в р-ре добавляются ионы Ba и Cl.
2 рисунок характерен процессам титрования слабой кислоты сильным основанием, либо наоборот слабого основания сильной кислотой.
