
- •Абсолютная и относительная погрешности.
- •2. Классификация погрешностей
- •По форме представления:
- •2. По причине возникновения:
- •3. По характеру проявления:
- •5. Генеральная и выборочная совокупность
- •6. Среднее арифметическое выборочной совокупности. Случайное отклонение.
- •7. Выборочное стандартное отклонение. Дисперсия
- •8. Среднеквадратичное отклонение
- •9. Нормальное распределение
- •10. Распределение Стьюдента
- •11. Требование к пробе анализа. Генеральная, средняя, лабораторная и анализируемая проба
- •12. Отбор проб газов, жидкостей и твердых веществ.
- •13. Отбор проб пищевой продукции и продовольственного сырья.
- •14. Общие принципы подготовки проб к анализу
- •15. Метод разложения проб
- •16. Растворение проб
- •17. Сплавление пробы
- •18. Пиролиз пробы
- •19. Метод разделения и концентрирования
- •20. Сущность титриметрии
- •21. Стандартизация растворов титрантов
- •22. Точка эквивалентности
- •23. Точка конца титрования
- •24. Кривые титрования
- •Кривая титрования реакции кислотно-оснавного взаимодействия между нсi и NaOh
- •Кривая титрования слабой кислоты и сильного основания
- •Кривая титрования многоосновных кислот и оснований
- •25. Способы титрования
- •26. Индикаторы и правила выбора индикатора
- •27. Гальванический элемент
- •28. Общие принципы электрохимических методов анализа. Классификация электродов и электродных систем.
- •29. Метод прямой кондуктометрии
- •30. Безэлектродная кондуктометрия
- •31. Кондуктометрическое титрование
- •32. Сущность потенциометрического анализа.
- •33. Методы прямой потенциометрии
- •34. Электроды сравнения и индикаторный электрод
- •35. Ионоселективные электроды
- •1. Первичные:
- •2. Сложные и многомембранные
- •36. Методы потенциометрического титрования
- •38. Сущность кулонометрического анализа.
- •42. Схема установки полярографического анализа
- •43. Методы полярографии
- •44. Метод дифференциальной полярографии
- •45. Инверсионная вольтамперометрия
- •48. Основы хроматографии:
- •50. Хромотографич колонки:
- •52. Радиоактивность. Методы регистрации радиоактивности
27. Гальванический элемент
Гальвани́ческий элеме́нт — химический источник электрического тока. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
Главные составные части гальванических элементов: два электрода разл. природы и электролит.
Обычно электроды - это металлич. пластинки или сетки, на к-рые нанесены реагенты ("активные в-ва"); на отрицат. электрод - восстановитель (Zn, Li и др.), на положительный -окислитель (оксиды Mn, Hg и др., а также соли). На каждом из электродов, погруженных в электролит, устанавливается определенный потенциал; разность этих потенциалов в отсутствие тока наз. напряжением разомкнутой цепи. При соединении электродов между собой с помощью внеш. электрич. цепи электроны начинают перетекать от отрицат. электрода к положительному - возникает электрич. ток.
Суммарная электрохим. р-ция на обоих электродах наз. токообразующей; по мере ее протекания восстановитель отдает,а окислитель присоединяет
электроны. Ток прекращается при размыкании внеш. цепи, а также после израсходования запаса хотя бы одного из реагентов. ЭДС гальванического элемента зависит от материала электродов и состава электролита.
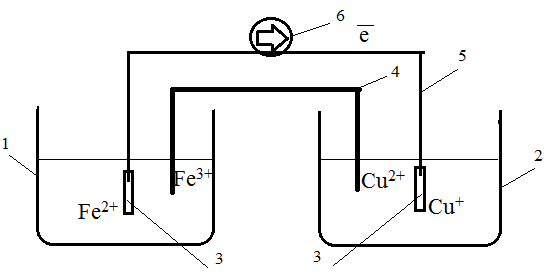
1,2-сосуды
3-платиновые электроды
4-солевой мостик
5-провод соединяющий электроды
6-гальванометр
28. Общие принципы электрохимических методов анализа. Классификация электродов и электродных систем.
Данные методы анализа связаны с направленным движением заряженных частиц, т. е. с электрическим током, возникающим при действии ЭДС или разности потенциалов. В электрохимических процессах электрический ток протекает в проводниках второго рода – электролитах, т. е. в растворах веществ. Заряженными частицами в электролитах явл-ся положительные и отрицательные ионы, образующиеся при электролитической диссоциации полярных молекул диссоциированного вещ-ва (различных солей, кислот, оснований) полярными молекулами р-ля (воды) или другими физико-химическими механизмами.
В электрохимических устройствах имеется как min 2 электрода, причем на одном из них постоянно или в данный момент времени возникает или подается положительный потенциал, а на втором электроде – отрицательный. При этом положительные ионы электролита будут двигаться к отриц электроду, а отрицательные – к положит. Возникает ток в электролите.
И только возле самих электродов возможна отдача отрицательными ионами электронов плюсовому электроду, а плюсовые ионы могут забрать электроны у отрицательного электрода.
Электроды и электродные системы классифицируются:
- по агрегатному состоянию: твердые (металлические), жидкие (ртуть), газообразные (водород)
- кинематическому исполнению: неподвижные, подвижные (совершают поступательное и вращат движение)
- по контакту с электролитом: контактирующие, безконтактные
- по способу взаимодействия с электролитами: пассивные, активные (могут растворяться в электролитах)
- твердые электроды: металлические (золото), неметалич (графит)
- электродные системы: с наложением тока из вне (с электродам подается внешняя ЭДС), без наложения тока из вне.
