
- •Стереохимия аминокислот.
- •Биосинтез жирных кислот
- •3.Ферменты
- •Образование аммиака, роль глутамина и аспарагина
- •Рацематы
- •Бэта-окисление жирных кислот
- •Общ хар. Сахаров, тригалозный сахар
- •Мажорные-минорные осн, пуриновые-пиримидиновые
- •Оксидоредуктазы
- •Таутомерные превращения азотистых оснований
- •Гликозиды. Написать формулу метил-альфа-d-глюкозогликозид
- •Кардиолипин; хар-ка
- •Кинетика ферментативных процессов;уравнение михаэлис-Мэнтен
- •Цикл глюкоза в лактат и сколько нужно и затратить атф
- •МРнк, строение и роль
- •Арахидоновая к-та и ее производные
- •Изомеразы; общая хар-ка,примеры реакций
- •Как влияет концентрац... Уравнение Михаэлиса–Ментен
- •Дыхательная цепь
- •Сахароза, как влияет её строение на хим св-ва; может ли она восстонавливать аммиачный р-р Ag
- •Высшие Жирные кислоты ; числа омыления,йодное число и кислотное тное число.
- •Важнейшие коферменты над и надф.
- •Биосинтез белка
- •Мутаротация
- •Желчные кислоты
- •Трансферазы
- •Коферменты фмн и фад
- •Цикл трикарбоновых кислот (Цикл Кребса)
- •Коферменты
- •Биосинтез рнк
- •Жирные кислоты: структура и свойства, связи
- •Гликоген,целлюлоза, амилопектин.
- •Пируват, аспартат- фермент
- •ТРнк, биороль
- •Механизм действия стероидных гормонов.
- •Изоферменты
- •Цикл пировиноградной кислоты.
- •Основные свойства генетического кода
- •Таутомерия глюкозы и что такоемутаротация
- •3.Специфические ферменты
- •5.Гликолиз
- •6. Рилизинг-факторы (либерины)
- •Факторы, влияющие на скорость ферм.Реакции
- •Биосинтез триглицерина и глицеролфосфолипидов
- •3.Нуклеотиды.
- •4. Горм.Гипофиза
- •1. Отличия и сходста днк и рнк
- •3 Роль тиреоидных гормонов
- •Цикл мочевины.
- •Гормоны поджелудочной железы
- •Гетерогликаны
- •4) Классы ферментов
- •5) Аллостерическая активность ферментов
- •Гормоны гипоталамуса
- •Кортикотропин-рилизинг-гормон
- •Специфичность ферментов
- •5.Жирные кислоты (алифатические кислоты)
- •Фолдинг белка
- •1.Стерины и стериды
- •2. Нуклеозиды и нуклеотиды
- •Метаболизим белков, липидов и углеводов.
- •Адреналин и норадреналин
- •1. Днк: типы, характеристика
- •2. Воски
- •3.Распад гликогена. Гликоген
- •Роль в организме
- •2.Аминосахара и их значение
- •5)Трансаминирование аминокислот
- •6.Отличие спиртового от молочно-кислого брожения
- •1.Методы очисткии разделения белков и пептидов,
- •2) Сахароза и её инверсия.
- •3) Глицерофосфолипиды.
- •4)Первичная структура нуклеиновых кислот
- •Пуриновые основания
- •2)Цереброзиды
- •3.Первичная и вторичная структура белков (связи)
- •4. Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •1.Пиримидиновые азотистые основания
- •2.Плазмалогены.
- •3. Способы образования аминокислот
- •4. Пути метаболизма
- •1)Строение матричной рнк.
- •2. Гормоны,как производныеАмк,гормональный цикл
- •3.Кислотно-основные свойства Аминокислот.
- •5) Регуляция активности ферментов
- •6.Пентозофосфатный путь окисления
- •1.Моносахариды.
- •2) Пептиды
- •3)Сфинголипиды.
- •4.Гликолиз и гликогенолиз.
- •1. Общие пути обмена аминокислот.
- •2. Транскри́пция
- •3.Альфа – Аминокислоты.
- •Связь между окислением жиров и циклом Кребса.
- •1. Структурная организация фермента
- •2. Регуляторные центры
- •Гормоны пептидной природы
- •Гликогенез и его рольСинтез гликогена (гликогенез)
- •Жирные кислоты
- •1.Гликофосфолипиды.
- •Гликозиды,кислоты, аминосахара как производные монасахаридов.
- •Мембранно-опосредованное взаимодействие гормонов.
- •Катаболизм аминокислот.
- •Распад стеариновой кислоты.
- •138 Молекул атф
- •Стеролы и стероиды.
- •Биосинтез пуриновых нуклеотидов.
- •ЦАмф, свойства.
- •Гидролазы.
- •Типы ингибирования. Константа Михаэлиса.
- •Свободное окисление.
- •Качественные реакции на гомо- и гетероциклические аминокислоты.
- •3) Физические и химические свойства крахмала, целлюлозы,гликогена
Типы ингибирования. Константа Михаэлиса.
Различают обратимое и необратимое ингибиро-вание. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулыфермента или модификацию функциональных группфермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрациисубстрата.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром.
В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением:
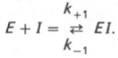
Образовавшийся комплекс, называемый фермент-ингибиторным комплексом ЕI, в отличие от фермент-субстратного комплекса ES не распадается с образованием продуктов реакции. Константудиссоциации комплекса EI, или ингибиторную константу Кi, можно, следуя теории Михаэлиса–Ментен, определить как отношение констант обратной и прямой реакций:
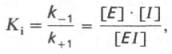
т.е. ингибиторная константа прямо пропорциональна произведению концентрациифермента и ингибитора и обратно пропорциональна концентрации комплекса EI.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулыфермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связифермент часто подвергается полной инактивации, и тогда торможение становится необратимым.
Известно, кроме того, так называемое бесконкурентное ингиби-рование, когда ингибитор связывается с ферментом также в некаталитическом центре, однако не со свободным ферментом, а только с ES-комп-лексом в виде тройного комплекса.
Для выяснения вопроса о типе ингибирования пользуются уравнениями Михаэлиса-Ментен.
и соответствующими графиками в прямолинейных координатах.
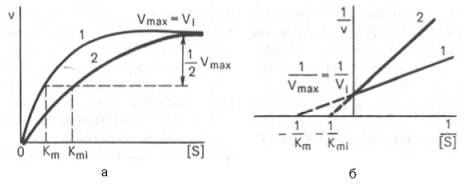
(Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора.)
При конкурентном типе ингибирования ингибитор увеличивает значение Кm, не
оказывая влияния на максимальную скорость Vmax(рис. 4.21). Это означает, что при достаточно высокой концентрациисубстрата[ S ] ингибитор вытесняется молекуламисубстрата из комплекса EI. При неконкурентном ингибировании (рис. 4.22) ингибитор снижает величину максимальной скорости. Если при этом величина Кm не уменьшается, то говорят о полностью неконкурентном ингибировании. Часто, однако, наблюдается смешанный тип ингибирования, иногда называемый частично неконкурентным, или обратимым неконкурентным ингибированием , при котором снижение Vmaxсочетается с одновременным увеличением значений Кm.
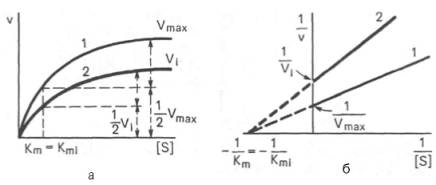
(Графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора.)
