- •Стереохимия аминокислот.
- •Биосинтез жирных кислот
- •3.Ферменты
- •Образование аммиака, роль глутамина и аспарагина
- •Рацематы
- •Бэта-окисление жирных кислот
- •Общ хар. Сахаров, тригалозный сахар
- •Мажорные-минорные осн, пуриновые-пиримидиновые
- •Оксидоредуктазы
- •Таутомерные превращения азотистых оснований
- •Гликозиды. Написать формулу метил-альфа-d-глюкозогликозид
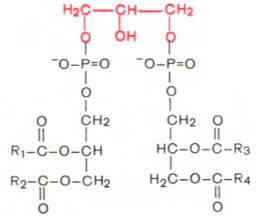
- •Кардиолипин; хар-ка
- •Кинетика ферментативных процессов;уравнение михаэлис-Мэнтен
- •Цикл глюкоза в лактат и сколько нужно и затратить атф
- •МРнк, строение и роль
- •Арахидоновая к-та и ее производные
- •Изомеразы; общая хар-ка,примеры реакций
- •Как влияет концентрац... Уравнение Михаэлиса–Ментен
- •Дыхательная цепь
- •Сахароза, как влияет её строение на хим св-ва; может ли она восстонавливать аммиачный р-р Ag
- •Высшие Жирные кислоты ; числа омыления,йодное число и кислотное тное число.
- •Важнейшие коферменты над и надф.
- •Биосинтез белка
- •Мутаротация
- •Желчные кислоты
- •Трансферазы
- •Коферменты фмн и фад
- •Цикл трикарбоновых кислот (Цикл Кребса)
- •Коферменты
- •Биосинтез рнк
- •Жирные кислоты: структура и свойства, связи
- •Гликоген,целлюлоза, амилопектин.
- •Пируват, аспартат- фермент
- •ТРнк, биороль
- •Механизм действия стероидных гормонов.
- •Изоферменты
- •Цикл пировиноградной кислоты.
- •Основные свойства генетического кода
- •Таутомерия глюкозы и что такоемутаротация
- •3.Специфические ферменты
- •5.Гликолиз
- •6. Рилизинг-факторы (либерины)
- •Факторы, влияющие на скорость ферм.Реакции
- •Биосинтез триглицерина и глицеролфосфолипидов
- •3.Нуклеотиды.
- •4. Горм.Гипофиза
- •1. Отличия и сходста днк и рнк
- •3 Роль тиреоидных гормонов
- •Цикл мочевины.
- •Гормоны поджелудочной железы
- •Гетерогликаны
- •4) Классы ферментов
- •5) Аллостерическая активность ферментов
- •Гормоны гипоталамуса
- •Кортикотропин-рилизинг-гормон
- •Специфичность ферментов
- •5.Жирные кислоты (алифатические кислоты)
- •Фолдинг белка
- •1.Стерины и стериды
- •2. Нуклеозиды и нуклеотиды
- •Метаболизим белков, липидов и углеводов.
- •Адреналин и норадреналин
- •1. Днк: типы, характеристика
- •2. Воски
- •3.Распад гликогена. Гликоген
- •Роль в организме
- •2.Аминосахара и их значение
- •5)Трансаминирование аминокислот
- •6.Отличие спиртового от молочно-кислого брожения
- •1.Методы очисткии разделения белков и пептидов,
- •2) Сахароза и её инверсия.
- •3) Глицерофосфолипиды.
- •4)Первичная структура нуклеиновых кислот
- •Пуриновые основания
- •2)Цереброзиды
- •3.Первичная и вторичная структура белков (связи)
- •4. Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •1.Пиримидиновые азотистые основания
- •2.Плазмалогены.
- •3. Способы образования аминокислот
- •4. Пути метаболизма
- •1)Строение матричной рнк.
- •2. Гормоны,как производныеАмк,гормональный цикл
- •3.Кислотно-основные свойства Аминокислот.
- •5) Регуляция активности ферментов
- •6.Пентозофосфатный путь окисления
- •1.Моносахариды.
- •2) Пептиды
- •3)Сфинголипиды.
- •4.Гликолиз и гликогенолиз.
- •1. Общие пути обмена аминокислот.
- •2. Транскри́пция
- •3.Альфа – Аминокислоты.
- •Связь между окислением жиров и циклом Кребса.
- •1. Структурная организация фермента
- •2. Регуляторные центры
- •Гормоны пептидной природы
- •Гликогенез и его рольСинтез гликогена (гликогенез)
- •Жирные кислоты
- •1.Гликофосфолипиды.
- •Гликозиды,кислоты, аминосахара как производные монасахаридов.
- •Мембранно-опосредованное взаимодействие гормонов.
- •Катаболизм аминокислот.
- •Распад стеариновой кислоты.
- •138 Молекул атф
- •Стеролы и стероиды.
- •Биосинтез пуриновых нуклеотидов.
- •ЦАмф, свойства.
- •Гидролазы.
- •Типы ингибирования. Константа Михаэлиса.
- •Свободное окисление.
- •Качественные реакции на гомо- и гетероциклические аминокислоты.
- •3) Физические и химические свойства крахмала, целлюлозы,гликогена
Кардиолипин; хар-ка
Кардиолипин. Своеобразным представителем глицерофосфолипидов явл кардиолипин, впервые выделен из сердечной мышцы. По своей хим стр-ре кардиолипин можно рассм-ть как соед-ние, в к-ром 2 мол-лы фосфатидной к-ты связаны с помощью одной мол-лыглицерина. В отличие от остальных глицерофосфолипидов кар-диолипин явл как бы «двойным» глицерофосфолипидом. Кардио-липин локализован во внутренней мембранемитохондрий. Функция его пока неясна, хотя известно, что в отличие от других фосфолипидов кардиолипин обладает иммунными св-вами.
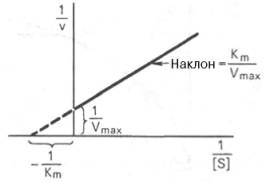
Кинетика ферментативных процессов;уравнение михаэлис-Мэнтен
Общие принципы кинетики хим р-ций применимы и к ф-тативным р-циям. Известно, что любая хим р-ция хар-ризуется константойтермодинамич равновесия.
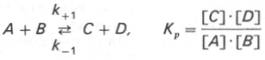
константа равновесия равнапроизведению концентраций образующихся веществ, деленному на произведение концентрации исходных веществ. Значение константы равновесия обычно находят из соотношения констант скоростей прямой (k+1) и обратной (k– 1 ) реакций:
![]()
Таким
образом, константа
равновесия равна
отношению констант скоростей прямой и
обратной реакций. Величину, обратную
константе равновесия, принято называть
субстратной
константой,
или, в случае ферментативной реакции,
константой диссоциации фермент–субстратного
комплекса, и обозначать символом :
:
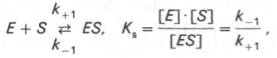
равнаотношению произведения концентрации фермента и субстрата к концентрации фермент-субстратного комплекса или отношению констант скоростей обратной и прямой реакций. Следует отметить, что константа зависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение , тем выше сродство фермента к субстрату.
При изучении кинетики ферментативных реакций следует учитывать одну важную особенность этих реакций (не свойственную обычным химическим реакциям), связанную с явлением насыщения фермента субстратом. При низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата является почти линейной и подчиняется кинетике первого порядка.
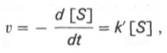
где [S] – молярная концентрация субстрата S; –d[S]/dt – скорость убыли субстрата; k' – константа скорости реакции, которая в данном случае имеет размерность, обратную единице времени.
При высокой концентрации субстрата скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [ S ].
Изучая явление насыщения, Л. Михаэлис и М. Ментен разработали общую теорию ферментативной кинетики. Они исходили из предположения, что ф-тативный процесс протекает в виде след хим р-ции:
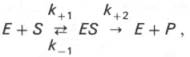
т.е. фермент Е вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р.
Уравнение Михаэлиса–Ментен, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:

где Кm представляет собой константу Михаэлиса, являющуюся экспериментально определяемой величиной. Она может быть представлена следующим уравнением:
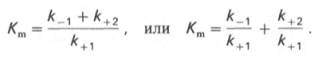
Отношение k–1/ k+1представляет собой константу диссоциации ферментсубстратного комплекса KS, тогда:
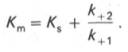
Отсюда
вытекает важное следствие: константа
Михаэлиса всегда больше константы
диссоциации фермент-субстратного
комплекса
 на
величину
на
величину
 /
/ .
.
Определение
величины
 имеет
важное значение при выяснении механизма
действия эффекторов на активность
ферментов. Константу Михаэлиса можно
вычислить по графику . Отрезок на
абсциссе, соответствующий скорости,
равной половине максимальной, будет
представлять собой
:
имеет
важное значение при выяснении механизма
действия эффекторов на активность
ферментов. Константу Михаэлиса можно
вычислить по графику . Отрезок на
абсциссе, соответствующий скорости,
равной половине максимальной, будет
представлять собой
: