
- •Стереохимия аминокислот.
- •Биосинтез жирных кислот
- •3.Ферменты
- •Образование аммиака, роль глутамина и аспарагина
- •Рацематы
- •Бэта-окисление жирных кислот
- •Общ хар. Сахаров, тригалозный сахар
- •Мажорные-минорные осн, пуриновые-пиримидиновые
- •Оксидоредуктазы
- •Таутомерные превращения азотистых оснований
- •Гликозиды. Написать формулу метил-альфа-d-глюкозогликозид
- •Кардиолипин; хар-ка
- •Кинетика ферментативных процессов;уравнение михаэлис-Мэнтен
- •Цикл глюкоза в лактат и сколько нужно и затратить атф
- •МРнк, строение и роль
- •Арахидоновая к-та и ее производные
- •Изомеразы; общая хар-ка,примеры реакций
- •Как влияет концентрац... Уравнение Михаэлиса–Ментен
- •Дыхательная цепь
- •Сахароза, как влияет её строение на хим св-ва; может ли она восстонавливать аммиачный р-р Ag
- •Высшие Жирные кислоты ; числа омыления,йодное число и кислотное тное число.
- •Важнейшие коферменты над и надф.
- •Биосинтез белка
- •Мутаротация
- •Желчные кислоты
- •Трансферазы
- •Коферменты фмн и фад
- •Цикл трикарбоновых кислот (Цикл Кребса)
- •Коферменты
- •Биосинтез рнк
- •Жирные кислоты: структура и свойства, связи
- •Гликоген,целлюлоза, амилопектин.
- •Пируват, аспартат- фермент
- •ТРнк, биороль
- •Механизм действия стероидных гормонов.
- •Изоферменты
- •Цикл пировиноградной кислоты.
- •Основные свойства генетического кода
- •Таутомерия глюкозы и что такоемутаротация
- •3.Специфические ферменты
- •5.Гликолиз
- •6. Рилизинг-факторы (либерины)
- •Факторы, влияющие на скорость ферм.Реакции
- •Биосинтез триглицерина и глицеролфосфолипидов
- •3.Нуклеотиды.
- •4. Горм.Гипофиза
- •1. Отличия и сходста днк и рнк
- •3 Роль тиреоидных гормонов
- •Цикл мочевины.
- •Гормоны поджелудочной железы
- •Гетерогликаны
- •4) Классы ферментов
- •5) Аллостерическая активность ферментов
- •Гормоны гипоталамуса
- •Кортикотропин-рилизинг-гормон
- •Специфичность ферментов
- •5.Жирные кислоты (алифатические кислоты)
- •Фолдинг белка
- •1.Стерины и стериды
- •2. Нуклеозиды и нуклеотиды
- •Метаболизим белков, липидов и углеводов.
- •Адреналин и норадреналин
- •1. Днк: типы, характеристика
- •2. Воски
- •3.Распад гликогена. Гликоген
- •Роль в организме
- •2.Аминосахара и их значение
- •5)Трансаминирование аминокислот
- •6.Отличие спиртового от молочно-кислого брожения
- •1.Методы очисткии разделения белков и пептидов,
- •2) Сахароза и её инверсия.
- •3) Глицерофосфолипиды.
- •4)Первичная структура нуклеиновых кислот
- •Пуриновые основания
- •2)Цереброзиды
- •3.Первичная и вторичная структура белков (связи)
- •4. Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •1.Пиримидиновые азотистые основания
- •2.Плазмалогены.
- •3. Способы образования аминокислот
- •4. Пути метаболизма
- •1)Строение матричной рнк.
- •2. Гормоны,как производныеАмк,гормональный цикл
- •3.Кислотно-основные свойства Аминокислот.
- •5) Регуляция активности ферментов
- •6.Пентозофосфатный путь окисления
- •1.Моносахариды.
- •2) Пептиды
- •3)Сфинголипиды.
- •4.Гликолиз и гликогенолиз.
- •1. Общие пути обмена аминокислот.
- •2. Транскри́пция
- •3.Альфа – Аминокислоты.
- •Связь между окислением жиров и циклом Кребса.
- •1. Структурная организация фермента
- •2. Регуляторные центры
- •Гормоны пептидной природы
- •Гликогенез и его рольСинтез гликогена (гликогенез)
- •Жирные кислоты
- •1.Гликофосфолипиды.
- •Гликозиды,кислоты, аминосахара как производные монасахаридов.
- •Мембранно-опосредованное взаимодействие гормонов.
- •Катаболизм аминокислот.
- •Распад стеариновой кислоты.
- •138 Молекул атф
- •Стеролы и стероиды.
- •Биосинтез пуриновых нуклеотидов.
- •ЦАмф, свойства.
- •Гидролазы.
- •Типы ингибирования. Константа Михаэлиса.
- •Свободное окисление.
- •Качественные реакции на гомо- и гетероциклические аминокислоты.
- •3) Физические и химические свойства крахмала, целлюлозы,гликогена
3.Альфа – Аминокислоты.
Аминокислотами называются соединения, в молекуле которых содержатся одновременно аминные и карбоксильные группы. Простейшим представителем их является аминоуксусная кислота (глицин) NH2- CH2- COOH. В зависимости от положения аминогруппы по отношению к карбоксилу различают альфа-, бетта-, гамма- аминокислоты и т. д.
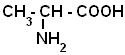
альфа- аминопропионовая кислота
Альфа-аминокислоты играют важнейшую роль в процессах жизнедеятельности живых организмов, так как являются теми соединениями, из которях строится молекула любого белка. Все альфа-аминокислоты, часто встречающиеся в живых организмах, имеют тривиальные названия, которые обычно и употребляются.
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах.
В процессе биосинтеза белка в полипептидную цепь включаются 20 важнейших α-аминокислот, кодируемых генетическим кодом:
Аланин, Аргинин, Аспарагиноваякислота,Аспарагин Валин,Гистидин,Глицин,
Глутаминоваякислота, Глутамин, Изолейцин, Лейцин, Лизин, Серин, Треонин,Триптофан,Фенилаланин,Цистеин.
Связь между окислением жиров и циклом Кребса.
Связующим звеном между этими двумя процессами явл.образование FADи фермент:ацил-КоА-синтетаза
Основной источник восстановленного FAD у эукариот — цикл Кребса и бета-окисление липидов. В цикле Кребса FAD является простетической группой фермента сукцинатдегидрогеназы, которая окисляет сукцинат до фумарата, в бета-окислении липидов FAD является коферментом Ac-CoA дегидрогеназы.
Билет 24
1. Структурная организация фермента
Ферменты – высокомол-рные в-ва, мол-рный вес к-рых достигает нескольких млн.Свыше 2000 известных в наст время ферментов, имеют белковую природу и хар-тся всеми св-вами белков. По строению ферменты делятся на:
простые или однокомпонентные;
сложные или двухкомпонентные (холоферменты).
Простые ферменты представляют собой простые белки и при гидролизе распадаются только на аминокислоты. К числу простых ферментов относятся гидролитические ферменты (пепсин, трипсин, уреаза и др.).
Сложные ферменты являются сложными белками и, помимо, полипептидных цепей содержат небелковый компонент (кофактор). К сложным белкам относится большинство ферментов.
Белковая часть двухкомпонентного фермента называется апоферментом.
Кофакторы могут иметь различную прочность связи с апоферментом.Если кофактор прочно связан с полипептидной цепью, он называется простетической группой. Между простетической группой и апоферментом – ковалентная связь.Если кофактор легко отделяется от апофермента и способен к самостоятельному существованию, то такой кофактор называется коферментом.Между апоферментом и коферментом связи слабые – водородные, электростатические и др.
Химическая природа кофакторов крайне разнообразна. Роль кофакторов в двухкомпонентных ферментах играют:
1 – большинство витаминов (Е, К, Q, С, Н, В1, В2, В6, В12 и др.);
2- соединения нуклеотидной природы (НАД,НАДФ, АТФ, КоА, ФАД, ФМН), а также целый ряд др. соединений;
3 – липолевая кислота;
4 – многие двухвалентные металлы (Мg2+, Mn2+,Ca2+и др.).
Активный центр ферментов.
Молекулы субстратов, взаимодействующих с ферментами обычно имеют гораздо меньший размер. Поэтому естественно предположить, что с субстратом взаимодействует не вся молекула фермента в целом, а только какая-то ее часть – так называемый “активный центр” фермента.
Активный центр фермента – это часть его молекулы, непосредственно взаимодействующая с субстратами участвующая в акте катализа.Активный центр фермента формируется на уровне третичной структуры. Поэтому при денатурации, когда третичная структура нарушается, фермент теряет свою каталитическую активность. Активный центр в свою очередь состоит из:
каталитического центра, который осуществляет химическое превращение субстрата;
субстратного центра (“якорной” или контактной площадки), которая обеспечивает присоединение субстрата к ферменту, формирование фермент-субстратного комплекса.
Четкую грань между каталитич и субстратным центром провести можно не всегда – у некоторых ферментов они совпадают или перекрываются.Помимо активного центра, в молекуле фермента существует т.н. аллостерический центр. Это участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного вещества (эффектора), изменяется третичная структура фермента. Это приводит к изменению конф-ции актив центра и, следовательно, к изменению акт-сти фермента. Это явление аллостерической регуляции активности фермента.
Многие ферменты являются мультимерами (или олигомерами), т.е. состоят из двух и более субъединиц- протомеров (аналогично четвертичной структуре белка).Связи между субъединицами, в основном, не ковалентные. Максимальную каталитическую активность фермент проявляет именно в виде мультимера. Диссоциация на протомеры резко снижает активность фермента.
Ферменты – мультимеры содержат обычно четкое число субъединиц (2-4), т.е. являются ди- и тетрамерами. Хотя известны гекса- и октамеры (6-8) и чрезвычайно редко встречаются тримеры и пентамеры (3-5).
Если ферменты-мультимеры образованы из субъединиц различных типов, они могут существовать в виде нескольких изомеров. Множественные формы фермента называют изоферментами (изоэнзимами или изозимами).
Изоферменты кат-уют одну и ту же хим р-цию, обычно воздействуют на один и тот же субстрат, но отличаются по некоторым физико-химическим свойствам (молекулярной массе, АМК-му составу, электрофоретической подвижности и др.), по локализации в органах и тканях.
Особую группу ферментов составляют т.н. мультимерные комплексы. Это системы ферментов, катализирующих последовательные стадии превращения какого-либо субстрат. Такие системы характеризуются прочностью связи и строгой пространственной организацией ферментов.
