
- •Стереохимия аминокислот.
- •Биосинтез жирных кислот
- •3.Ферменты
- •Образование аммиака, роль глутамина и аспарагина
- •Рацематы
- •Бэта-окисление жирных кислот
- •Общ хар. Сахаров, тригалозный сахар
- •Мажорные-минорные осн, пуриновые-пиримидиновые
- •Оксидоредуктазы
- •Таутомерные превращения азотистых оснований
- •Гликозиды. Написать формулу метил-альфа-d-глюкозогликозид
- •Кардиолипин; хар-ка
- •Кинетика ферментативных процессов;уравнение михаэлис-Мэнтен
- •Цикл глюкоза в лактат и сколько нужно и затратить атф
- •МРнк, строение и роль
- •Арахидоновая к-та и ее производные
- •Изомеразы; общая хар-ка,примеры реакций
- •Как влияет концентрац... Уравнение Михаэлиса–Ментен
- •Дыхательная цепь
- •Сахароза, как влияет её строение на хим св-ва; может ли она восстонавливать аммиачный р-р Ag
- •Высшие Жирные кислоты ; числа омыления,йодное число и кислотное тное число.
- •Важнейшие коферменты над и надф.
- •Биосинтез белка
- •Мутаротация
- •Желчные кислоты
- •Трансферазы
- •Коферменты фмн и фад
- •Цикл трикарбоновых кислот (Цикл Кребса)
- •Коферменты
- •Биосинтез рнк
- •Жирные кислоты: структура и свойства, связи
- •Гликоген,целлюлоза, амилопектин.
- •Пируват, аспартат- фермент
- •ТРнк, биороль
- •Механизм действия стероидных гормонов.
- •Изоферменты
- •Цикл пировиноградной кислоты.
- •Основные свойства генетического кода
- •Таутомерия глюкозы и что такоемутаротация
- •3.Специфические ферменты
- •5.Гликолиз
- •6. Рилизинг-факторы (либерины)
- •Факторы, влияющие на скорость ферм.Реакции
- •Биосинтез триглицерина и глицеролфосфолипидов
- •3.Нуклеотиды.
- •4. Горм.Гипофиза
- •1. Отличия и сходста днк и рнк
- •3 Роль тиреоидных гормонов
- •Цикл мочевины.
- •Гормоны поджелудочной железы
- •Гетерогликаны
- •4) Классы ферментов
- •5) Аллостерическая активность ферментов
- •Гормоны гипоталамуса
- •Кортикотропин-рилизинг-гормон
- •Специфичность ферментов
- •5.Жирные кислоты (алифатические кислоты)
- •Фолдинг белка
- •1.Стерины и стериды
- •2. Нуклеозиды и нуклеотиды
- •Метаболизим белков, липидов и углеводов.
- •Адреналин и норадреналин
- •1. Днк: типы, характеристика
- •2. Воски
- •3.Распад гликогена. Гликоген
- •Роль в организме
- •2.Аминосахара и их значение
- •5)Трансаминирование аминокислот
- •6.Отличие спиртового от молочно-кислого брожения
- •1.Методы очисткии разделения белков и пептидов,
- •2) Сахароза и её инверсия.
- •3) Глицерофосфолипиды.
- •4)Первичная структура нуклеиновых кислот
- •Пуриновые основания
- •2)Цереброзиды
- •3.Первичная и вторичная структура белков (связи)
- •4. Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •1.Пиримидиновые азотистые основания
- •2.Плазмалогены.
- •3. Способы образования аминокислот
- •4. Пути метаболизма
- •1)Строение матричной рнк.
- •2. Гормоны,как производныеАмк,гормональный цикл
- •3.Кислотно-основные свойства Аминокислот.
- •5) Регуляция активности ферментов
- •6.Пентозофосфатный путь окисления
- •1.Моносахариды.
- •2) Пептиды
- •3)Сфинголипиды.
- •4.Гликолиз и гликогенолиз.
- •1. Общие пути обмена аминокислот.
- •2. Транскри́пция
- •3.Альфа – Аминокислоты.
- •Связь между окислением жиров и циклом Кребса.
- •1. Структурная организация фермента
- •2. Регуляторные центры
- •Гормоны пептидной природы
- •Гликогенез и его рольСинтез гликогена (гликогенез)
- •Жирные кислоты
- •1.Гликофосфолипиды.
- •Гликозиды,кислоты, аминосахара как производные монасахаридов.
- •Мембранно-опосредованное взаимодействие гормонов.
- •Катаболизм аминокислот.
- •Распад стеариновой кислоты.
- •138 Молекул атф
- •Стеролы и стероиды.
- •Биосинтез пуриновых нуклеотидов.
- •ЦАмф, свойства.
- •Гидролазы.
- •Типы ингибирования. Константа Михаэлиса.
- •Свободное окисление.
- •Качественные реакции на гомо- и гетероциклические аминокислоты.
- •3) Физические и химические свойства крахмала, целлюлозы,гликогена
Билет 2
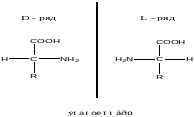
Стереохимия аминокислот.
Все аминокислоты, кроме глицерина, оптически активны и делятся на правовращающие(+) и левовращающие (-). Оптическая активность является следствием наличия в структуре аминокислот как минимум одного ассиметричного (хирального) С-атома, у которого все 4 заместителя различны. Существует 2 ряда стереоизамеров или энантиомеров аминокислот относительно хирального С-атома :L ,D( Сравниваюет их абсолютную конфигурацию заместителей у хирального С-атома с абсолютной конфигурацией заместителей у хирального С-атома двух соединений.) D/L стереоизамеры –зеркальные формы одного и того же соединения.
Биосинтез жирных кислот
1.Транспорт внутримитохондриального ацетил-КоА в цитоплазму:
ацилкарнитиновый механизм
цитрат-транспортная система
2. Образование малонил-КоА
фермент: ацетил-КоА-карбоксилаза
А цетил-КоА
+ СО2
+ АТФ Малонил-КоА +АДФ +Фн
цетил-КоА
+ СО2
+ АТФ Малонил-КоА +АДФ +Фн
3. Собственно синтез жирных кислот:
фермент: ацетил-ацилпереносящий белок(АПБ)-трансферазаHS-АПБ-SH + Ацетил-КоА ацетил-АПБ-SH + HS-КоАSH
фермент: малонил-АПБ-трансфераза
ацетил-АПБ-SH + малонил-КоА ацетил-АПБ-малонил + HS-КоАSH
фермент:-кетоацил-АПБ-синтаза
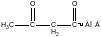
ацетил-АПБ-малонил ацетил
-кетоацил-АПБ
фермент:-кетоацил-АПБ – редуктаза
-кетоацил-АПБ + НАДФН.Н+-гидроксиацил-АПБ + НАДФ+
фермент:-гидроксиацил-АПБ – дегидратаза
-гидроксиацил-АПБ транс-еноил-АПБ
фермент:еноил-АПБ-редуктаза
транс-еноил-АПБ+ НАДФН.Н+ бутирил-АПБ+ НАДФ+
3.Ферменты
Ферменты - это специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов, т.е. ускоряющие протекание химических реакций в организме. Через их посредство реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах.
Отличие ферментов от химических катализаторов:
Скорость химических реакций ускоряется ферментами в 106 -1016 раз, по сравнению с химическими катализаторами.
Ферменты работают при нормальной температуре тела (37-42°) и нормальном давлении
Осуществляется тонкая регуляция ферментативной реакции, нет отходов и шлаков.
Ферментативные реакции подчиняются термодинамической кинетике.
Ферменты не смещают равновесие реакции, а только ускоряют его приближение.
Действуя в строго определенном порядке, ферменты катализируют сотни многостадийных реакций, в ходе которых расщепляются молекулы питательных веществ, запасается и преобразуется энергия и из молекул - предшественников строятся макромолекулы, входящие в состав клетки.
Благодаря тонкой скоординированности между всеми ферментативными реакциями соблюдается гармоническое равновесие всех метаболических процессов и обеспечивается нормальное функционирование живых организмов.
Все ферменты, в зависимости от места синтеза и места их действия делятся на две большие группы:
Внутриклеточные ферменты действуют в тех же клетках, где и синтезируются.
Внеклеточные выходят из клеток в желудочно-кишечный тракт, в кровь, лимфу, в другие биологические жидкости и там выполняют свои биологические функции.
Различают конститутивные ферменты, постоянно присутствующие в клетках, и индуцируемые ферменты, биосинтез которых активируется под влиянием соответствующих субстратов. Некоторые функционально взаимосвязанные ферменты образуют в клетке структурно организованные полиферментные комплексы. Многие ферменты и ферментные комплексы прочно связаны с мембранами клетки или её органоидов (митохондрий, лизосом, микросом и т.д.) и участвуют в активном транспорте веществ через мембраны.
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии.Еще шире область использования ферментов в научных исследованиях и в медицине.
