
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Глава 1. Термодинамика гальванического элемента
- •1.1.Гальванический элемент
- •1.2.Термодинамика гальванического элемента
- •1.3.Электродный потенциал. Электродные реакции
- •Глава 2.Основные типы электродов
- •2.1.Классификация электродов
- •2.2.Электроды 1-го рода
- •2.3.Электроды 2-го рода
- •2.4.Окислительно-восстановительные электроды
- •2.5.Газовые электроды
- •2.6.Ионоселективные электроды
- •Глава 3.Ионы в растворах электролитов
- •3.1.Классическая теория электролитической диссоциации
- •3.2.Взаимодействие растворяемого вещества с растворителем
- •3.3.Межионное взаимодействие в растворах
- •Глава 4.Термодинамика растворов электролитов
- •4.1.Формальные представления об активности ионов в растворах электролитов
- •4.2.Экспериментальные данные по коэффициентам активности
- •Глава 5.Явления переноса в растворах электролитов
- •5.1.Диффузия в растворах электролитов
- •5.2.Диффузионный потенциал
- •5.3.Электрическая проводимость растворов электролитов
- •Глава 6.Электрохимическая поляризация
- •6.1.Эдс поляризации и электродная поляризация
- •6.2.Теории электродной поляризации
- •Аллотропические цепи
- •Концентрационные цепи
- •7.3.Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Глава 8.Химические источники тока
- •8.1.Эталонные гальванические элементы
- •8.2.Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •8.3.Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Глава 9.Формальная кинетика
- •9.1.Основные понятия
- •9.2.Классификация химических реакций по их кинетике
- •9.3.Необратимая реакция первого порядка
- •9.4.Необратимая реакция второго порядка
- •9.5.Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •9.6.Необратимая реакция n-ого порядка
- •9.7.Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Глава 10.Кинетика сложных реакций
- •10.1.Параллельные реакции
- •10.2.Обратимая реакция
- •Последовательные реакции
- •Глава 11.Влияние температуры на скорость химических реакций
- •11.1.Эмпирические закономерности влияния температуры на скорость реакций
- •11.2.Уравнение Аррениуса
- •Глава 12.Элементарные акты химических превращений
- •12.1.Теория активных столкновений
- •12.2.Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •12.3.Теория переходного состояния (теория активного комплекса)
- •Глава 13.Химическая индукция
- •Глава 14.Фотохимические процессы
- •14.1.Основные законы фотохимии
- •14.2.Механизм фотохимических реакций
- •Глава 15.Цепные реакции
- •15.1.Общие сведения о цепных реакциях
- •15.2.Зарождение цепи и методы обнаружения свободных радикалов
- •15.3.Развитие и обрыв цепи
- •Глава 16.Катализ
- •16.1.Общие сведения
- •16.2.Гомогенный катализ
- •16.3.Кислотно-основной катализ
- •16.4.Ферментативный катализ
- •16.5.Гетерогенный катализ
- •Предметный указатель
- •Оглавление
- •Часть 3. Химическая кинетика и катализ 78
- •Глава 9. Формальная кинетика 79
Глава 12.Элементарные акты химических превращений
12.1.Теория активных столкновений
Теория активных столкновений (она также называется теорией активных соударений) явилась первой теорией, количественно объяснившей данные кинетических исследований на основе молекулярно-кинетических представлений. Эта теория разработана как для случая бимолекулярных столкновений, так и для тримолекулярных столкновений. Ниже рассматриваются основные результаты, полученные для бимолекулярных столкновений.
В основе теории использованы следующие предположения (постулаты теории активных соударений):
Первым актом возможного взаимодействия молекул является их столкновение.
Столкновение молекул может служить причиной превращения молекул только в том случае, если энергия столкновения превышает или по крайней мере равна некоторой критической величине а. Столкновения с энергией, равной этой величине или превышающей ее, называются активными.
Активные столкновения приводят к благоприятному исходу, то есть к началу химической реакции, если расположение молекул в момент столкновения соответствует данной реакции.
Первый постулат теории означает, что теория не рассматривает реакции, протекающие под непрерывным воздействием квантов света или частиц высокой энергии (гамма-квантов, электронов и т.д.).
Второй постулат теории предполагает, что для начала химического превращения сталкивающиеся молекулы должны обладать энергией, достаточной для преодоления вполне определенного энергетического барьера. Если энергия столкновения молекул оказывается меньше а, то происходит упругий удар без каких-либо химических превращений.
Рис.
12 - 1. Условное
представление положений молекул в
момент столкновения.
Молекулярно-кинетическая теория дает возможность рассчитывать число столкновений с определенной энергией.
Общее число столкновений Z0 в единичном объеме газовой фазы определяется уравнением:
![]() ,
(12 - 1)
,
(12 - 1)
в котором A - числовой коэффициент, P - давление, - эффективный диаметр столкновения, M - эффективная молярная масса сталкивающихся молекул.
Объединив все характеристики сталкивающихся молекул с числовым коэффициентом в единую константу для данной реакции , уравнение (12 - 1) можно записать в следующей форме:
![]() .
(12 - 2)
.
(12 - 2)
Число столкновений с энергией i подчиняется распределению Больцмана:
 .
(12 - 3)
.
(12 - 3)
Число
активных столкновений в единичном
объеме представляет собой сумму всех
столкновений, энергия которых не
меньше а:
_______________________![]()
или
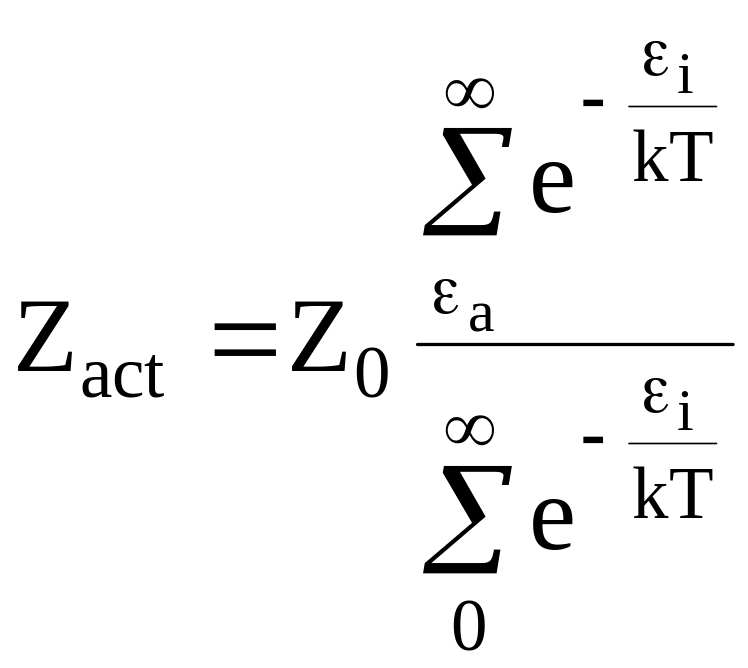 .
(12 - 4)
.
(12 - 4)
Число первичных химических превращений за единицу времени в единичном объеме в соответствии с третьим постулатом теории окажется равным:
![]() ,
(12 - 5)
,
(12 - 5)
а с учетом уравнений (12 - 2) и (12 - 4):
 .
(12 - 6)
.
(12 - 6)
Для бимолекулярной реакции в газовой фазе зависимость скорости от давления выражается уравнением:
![]() .
(12 - 7)
.
(12 - 7)
Сравнивая уравнения (12 - 6) и (12 - 7), получим уравнение для константы скорости реакции:
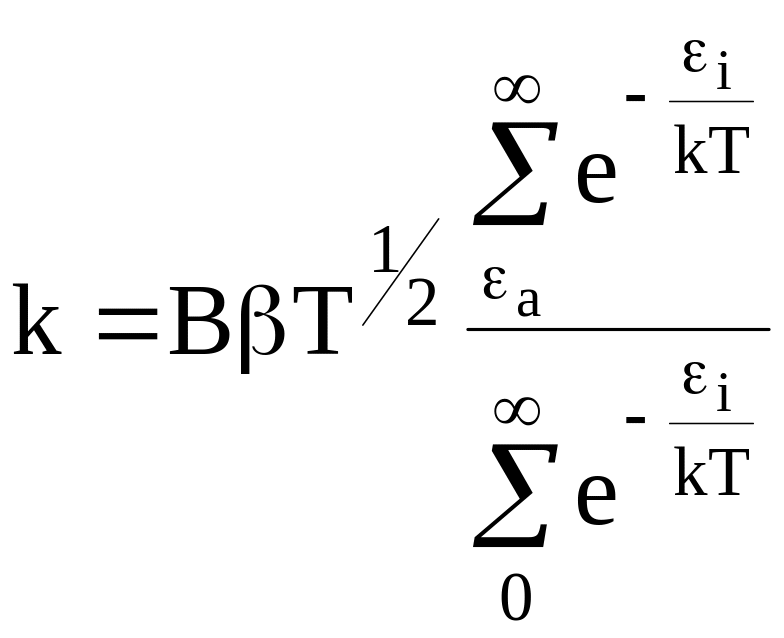 .
(12 - 8)
.
(12 - 8)
Прологарифмируем уравнение (12 - 8):

и продифференцируем по температуре:
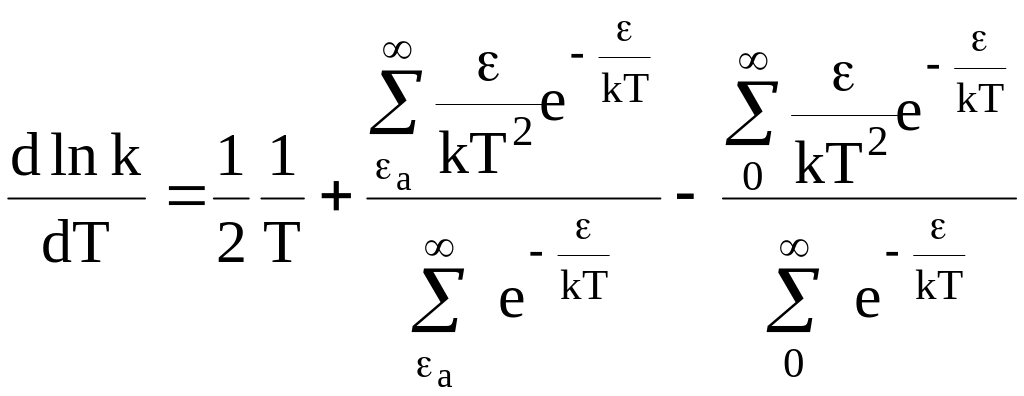 .
(12 - 9)
.
(12 - 9)
Пренебрегая
в первом приближении величиной
![]() и проведя преобразования, получим:
и проведя преобразования, получим:
 .
(12 - 10)
.
(12 - 10)
Для выяснения смысла отношений сумм, заключенных в скобках в правой части уравнения (12 - 10), отметим, что энергия всех активных соударений act равна:
![]() .
(12 - 11)
.
(12 - 11)
С учетом уравнения (12 - 3) равенство (12 - 11) приобретает следующий вид:
 .
(12 - 12)
.
(12 - 12)
Отношение полной энергии активных столкновений к числу всех активных столкновений представляет собой среднюю энергию активного столкновения:
![]() .
(12 - 13)
.
(12 - 13)
Сравнение уравнений (12 - 4), (12 - 12) и (12 - 13) показывает, что первое отношение сумм в уравнении (12 - 10) представляет собой среднюю энергию активного соударения:
 .
(12 - 14)
.
(12 - 14)
Второе отношение сумм представляет среднюю энергию всех столкновений в системе:
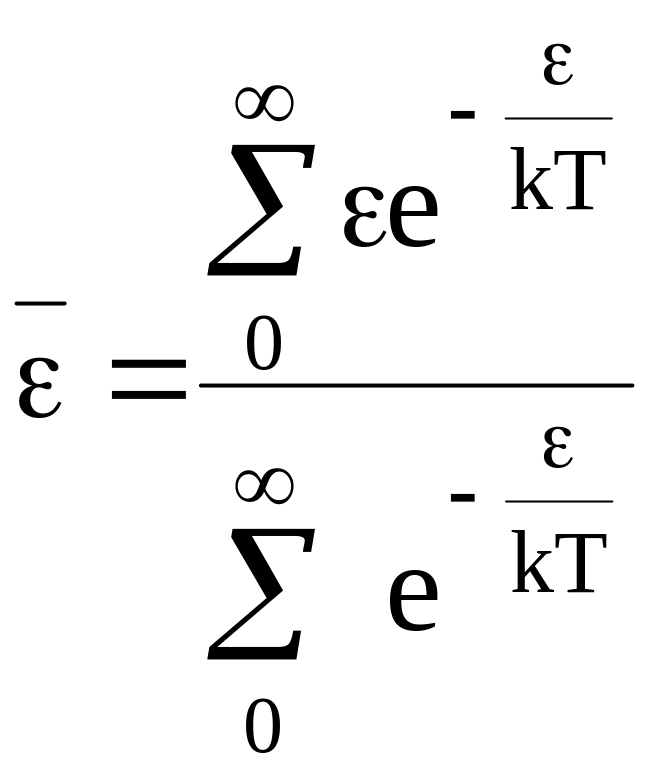 .
(12 - 15)
.
(12 - 15)
Равенства (12 - 14) и (12 - 15) позволяют представить уравнение (12 - 10) следующим образом:
![]() .
(12 - 16)
.
(12 - 16)
Умножение числителя и знаменателя правой части уравнения (12 - 16) на постоянную Авогадро дает:
![]() ,
(12 - 17)
,
(12 - 17)
где
![]() и
и
![]() - соответственно средняя энергия 1 моль
активных соударений и средняя энергия
1 моль
всех соударений.
- соответственно средняя энергия 1 моль
активных соударений и средняя энергия
1 моль
всех соударений.
Сравнение уравнения Аррениуса в дифференциальной форме (11 - 7) и уравнения (12 - 17) позволяет установить, чем же в соответствии с теорией активных соударений является энергия активации.
Энергия активации равна разности средней энергии 1 моль активных соударений и средней энергии 1 моль всех соударений:
![]() .
(12 - 18)
.
(12 - 18)
Напомним,
что уравнение (12 - 18) имеет приближенный
характер, так как при его выводе была
исключена производная
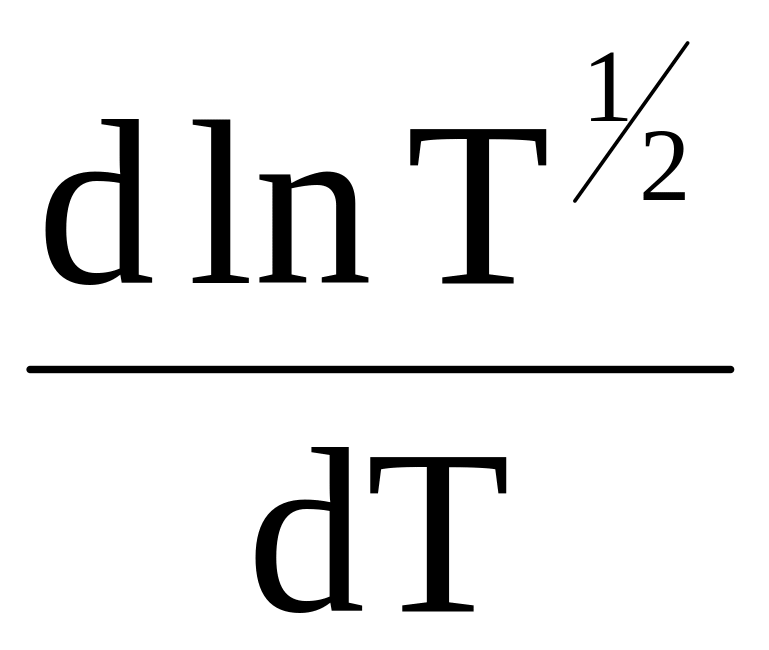 .
Уточненное значение энергии активации
EA
со значением величины E
выражается соотношением:
.
Уточненное значение энергии активации
EA
со значением величины E
выражается соотношением:
![]() .
(12 - 19)
.
(12 - 19)
Иная трактовка энергии активации дается теорией активированного комплекса, которая будет рассмотрена в дальнейшем.
