
- •В.Н. Захарченко Курс физической химии Москва
- •Часть 2. Электрохимические системы и электрохимические процессы
- •Глава 1. Термодинамика гальванического элемента
- •1.1.Гальванический элемент
- •1.2.Термодинамика гальванического элемента
- •1.3.Электродный потенциал. Электродные реакции
- •Глава 2.Основные типы электродов
- •2.1.Классификация электродов
- •2.2.Электроды 1-го рода
- •2.3.Электроды 2-го рода
- •2.4.Окислительно-восстановительные электроды
- •2.5.Газовые электроды
- •2.6.Ионоселективные электроды
- •Глава 3.Ионы в растворах электролитов
- •3.1.Классическая теория электролитической диссоциации
- •3.2.Взаимодействие растворяемого вещества с растворителем
- •3.3.Межионное взаимодействие в растворах
- •Глава 4.Термодинамика растворов электролитов
- •4.1.Формальные представления об активности ионов в растворах электролитов
- •4.2.Экспериментальные данные по коэффициентам активности
- •Глава 5.Явления переноса в растворах электролитов
- •5.1.Диффузия в растворах электролитов
- •5.2.Диффузионный потенциал
- •5.3.Электрическая проводимость растворов электролитов
- •Глава 6.Электрохимическая поляризация
- •6.1.Эдс поляризации и электродная поляризация
- •6.2.Теории электродной поляризации
- •Аллотропические цепи
- •Концентрационные цепи
- •7.3.Химические электрохимические цепи
- •Простые химические цепи
- •Сложные химические цепи
- •Глава 8.Химические источники тока
- •8.1.Эталонные гальванические элементы
- •8.2.Первичные гальванические элементы
- •Элемент Лекланше
- •Ртутнооксидный элемент
- •Индийсодержащие элементы
- •Элементы с твердыми электролитами
- •Резервные элементы
- •8.3.Вторичные гальванические элементы
- •Свинцовый аккумулятор
- •Щелочной аккумулятор
- •Серебряный аккумулятор
- •Часть 3. Химическая кинетика и катализ
- •Глава 9.Формальная кинетика
- •9.1.Основные понятия
- •9.2.Классификация химических реакций по их кинетике
- •9.3.Необратимая реакция первого порядка
- •9.4.Необратимая реакция второго порядка
- •9.5.Два случая бимолекулярной реакции
- •2A Продукты реакции,
- •9.6.Необратимая реакция n-ого порядка
- •9.7.Методы определения порядка реакции
- •Дифференцирование кинетической кривой
- •Глава 10.Кинетика сложных реакций
- •10.1.Параллельные реакции
- •10.2.Обратимая реакция
- •Последовательные реакции
- •Глава 11.Влияние температуры на скорость химических реакций
- •11.1.Эмпирические закономерности влияния температуры на скорость реакций
- •11.2.Уравнение Аррениуса
- •Глава 12.Элементарные акты химических превращений
- •12.1.Теория активных столкновений
- •12.2.Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
- •12.3.Теория переходного состояния (теория активного комплекса)
- •Глава 13.Химическая индукция
- •Глава 14.Фотохимические процессы
- •14.1.Основные законы фотохимии
- •14.2.Механизм фотохимических реакций
- •Глава 15.Цепные реакции
- •15.1.Общие сведения о цепных реакциях
- •15.2.Зарождение цепи и методы обнаружения свободных радикалов
- •15.3.Развитие и обрыв цепи
- •Глава 16.Катализ
- •16.1.Общие сведения
- •16.2.Гомогенный катализ
- •16.3.Кислотно-основной катализ
- •16.4.Ферментативный катализ
- •16.5.Гетерогенный катализ
- •Предметный указатель
- •Оглавление
- •Часть 3. Химическая кинетика и катализ 78
- •Глава 9. Формальная кинетика 79
9.2.Классификация химических реакций по их кинетике
Реакции, протекающие в одном направлении и в одну стадию, называются простыми реакциями. Все остальные типы реакций называются сложными.
В основу классификации простых реакций положен их порядок или молекулярность самой медленной стадии.
Простые реакции идут только в одном направлении. Поэтому еще одним синонимом является название необратимые реакции.
Сложные реакции классифицируются по взаимным направлениям или стадиям составляющих их простых реакций.
К сложным реакциям относятся обратимые реакции, в которых две простые реакции могут протекать в противоположных направлениях. Одну из составляющих реакций (обычно записываемую слева) называют прямой, а другую - обратной:
A + B C + D.
прямая обратная
реакция реакция
Сложной реакцией считается получение из одних и тех же веществ различных продуктов по нескольким направлениям. Эти реакции называются параллельными. Например, к параллельным реакциям относится схема:
k1 C
A + B .
k2 E
Еще одним типом сложных реакций являются последовательные реакции, протекающие с образованием промежуточных соединений. Примером последовательных реакций может служить следующая схема:
k1 k2
A B C.
9.3.Необратимая реакция первого порядка
Необратимая реакция первого порядка описывается уравнением, вытекающим из уравнения (9 - 7),
![]() .
(9 - 8)
.
(9 - 8)
Уравнение (9 - 8) дополняется граничным условием:
в начальный момент времени ( = 0) концентрация вещества равна С0.
Разделив переменные и проинтегрировав уравнение (9 - 8), получим:
![]() .
(9 - 9)
.
(9 - 9)
Подстановка граничных условий в уравнение (9 - 9) дает:
const = -lnC0,
а кинетическое уравнение для необратимой реакции первого порядка в интегральной форме принимает окончательный вид:
![]() .
(9 - 10)
.
(9 - 10)
Рис.
9 - 1. Зависимость
концентрации от времени для необратимой
реакции первого порядка.
Часто в качестве характеристики интенсивности протекания химической реакции вместо константы скорости используют время полупревращения вещества 1/2, то есть время, за которое концентрация вещества уменьшается вдвое (C = 1/2C0).
Радиоактивные превращения описываются таким же кинетическим уравнением, что и химические реакции первого порядка. Для них традиционно вместо времени полупревращения используют понятие время полураспада, которое также обозначается 1/2.
Подставляя данные, определяющие время полупревращения в уравнение (9 - 10), получим:
![]()
или
![]() .
(9 - 11)
.
(9 - 11)
С учетом выражения (9 - 11) кинетическому уравнению реакции первого порядка можно придать следующую форму:
![]() .
(9 - 12)
.
(9 - 12)
Кроме времени полупревращения, реакция может быть охарактеризована временем превращения вещества на X %, которое обозначим Х%. В этом случае действующая концентрация должна быть равной:
![]() .
.
Следовательно,
![]() .
(9 - 13)
.
(9 - 13)
Если задачей кинетического исследования реакции ставится нахождение зависимости концентрации вещества от времени протекания реакции, то кинетическому уравнению придают следующий вид:
![]() .
(9 - 14)
.
(9 - 14)
Уравнение (9 - 14) описывает кинетическую кривую, показанную на рис. 9 ‑ 2.
Для необратимой реакции, при которой не образуются промежуточные вещества, концентрация продукта реакции CB определяется из условия:
C0 = C + CB.
Поэтому кинетика накопления продукта реакции описывается кинетическим уравнением:
![]() .
(9 - 15)
.
(9 - 15)
Рис.
9 - 2. Кинетическая
кривая реакции первого порядка.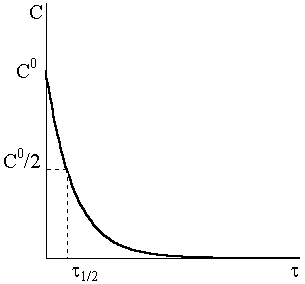
Еще
одной характеристикой необратимой
реакции первого порядка служит среднее
время жизни молекулы
![]() .
В соответствии с определением средней
величины можно воспользоваться
уравнением:
.
В соответствии с определением средней
величины можно воспользоваться
уравнением:
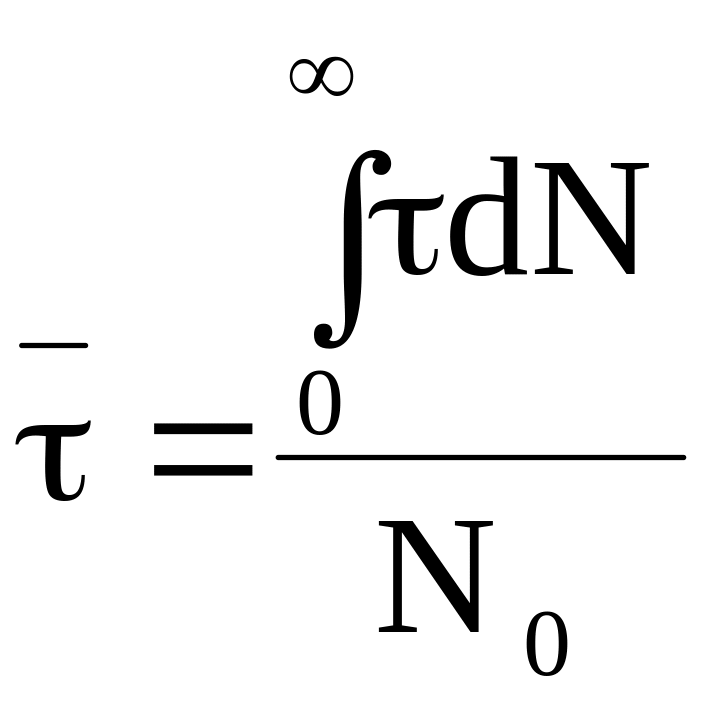 ,
(9 - 16)
,
(9 - 16)
где - время жизни молекул, число которых соответствует интервалу от N до N + dN, N0 - общее число молекул, принимающих участие в реакции.
В соответствии с уравнением (9 - 8) число молекул с заданным временем жизни можно определить, используя равенство
![]() ,
(9 - 17)
,
(9 - 17)
а из уравнения (9 - 14) следует:
![]() .
.
Уравнение для расчета среднего времени жизни молекулы принимает следующий вид:
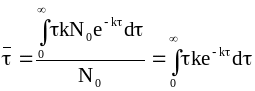 .
(9 - 18)
.
(9 - 18)
Уравнение
(9 - 18) интегрируется по частям, для чего
можно обозначить u
= ,
![]() :
:
![]() .
(9 - 19)
.
(9 - 19)
Ниже приводится соотношение между характеристиками необратимой реакции первого порядка:
![]() .
(9 - 20)
.
(9 - 20)
