
- •Часть 1
- •Введение
- •Лекция 1 единицы и размерности физических величин
- •Системы единиц измерения. Элементы теории ошибок
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 2 основы механики.
- •2.1 Кинематика точки
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 3 динамика
- •3.1 Законы Ньютона
- •3.2 Физическая природа сил
- •3.3 Масса и импульс
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 4 законы сохранения. Работа и мощность.Энергия.
- •4.1 Закон сохранения импульса и центра масс
- •4.2 Работа и мощность
- •4.3 Виды энергии
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция № 5 твердое тело в механике.Вращательное движение.
- •5.1 Вращательное движение
- •5.2 Момент инерции. Момент импульса
- •5.3 Уравнение динамики вращательного движения
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 6. Колебания
- •Кинематика гармонических колебаний. Механические волны.
- •(Уравнения гармонического колебания)
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция № 7 Гидростатика и гидродинамика
- •7.1.Давление в жидкости. Законы Паскаля и Архимеда
- •Уравнения течения жидкости
- •Формулировка уравнения Бернулли:
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция № 8 Молекулярно-кинетическая теория строения вещества.
- •8.1 Основные положения мкт
- •8.2 Внутренняя энергия молекул.
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Дополнительная
- •Лекция 9
- •9.1 Плавление, кристаллизация, парообразование, конденсация.
- •9.2 Свойства жидкости
- •Список литературы Основная
- •Дополнительная
- •Лекция 10 идеальные и реальные газы.
- •1 Уравнение идеального газа. Экспериментальные газовые законы
- •10.2 Уравнение Ван-дер-Ваальса
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция №11 явления переноса
- •Теплопроводность.
- •Диффузия
- •Внутреннее трение (вязкость)
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 12 основы термодинамики.
- •12.1 Общие понятия. Первое начало термодинамики
- •12.2 Работа, совершаемая при изменении объема
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 13 обратимые и необратимые тепловые процессы.
- •13.1 Второе начало термодинамики
- •13.2 Цикл Карно
- •13.3 Энтропия
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 14 электростатика.
- •14.1 Взаимодействие электрических зарядов. Закон кулона
- •14.2 Напряженность поля
- •14.3 Теорема Остроградского-Гаусса
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 15 потенциал электрического поля. Электроемкость.
- •15.1 Потенциал и работа электрического поля.
- •15.2 Проводники и диэлектрики в электрическом поле
- •15.3 Вектор электрической индукции
- •15.4 Электрическая емкость. Энергия электрического поля
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Лекция 16 постоянный электрический ток
- •16.1.Электрический ток. Сила тока, э.Д.С., напряжение
- •16.2 Сопротивление проводников
- •16.3 Законы Ома и Джоуля-Ленца
- •16.4 Правила Кирхгофа
- •Список литературы Основная
- •Дополнительная
- •Лекция 17 ток в жидкостях и газах
- •17.1Электролиз.
- •17.2 Самостоятельный и несамостоятельный газовые разряды
- •Вопросы для самоконтроля.
- •Список литературы Основная
- •Дополнительная
- •Лекция 18 термоэлектрические явления.
- •18.1 Электронная лампа диод и ее применение
- •18.2 Электронная лампа триод
- •18.3 Контактная разность потенциалов. Термоэлектричество
- •Контактная разность потенциалов двух металлов зависит только от их химического состава и температуры.
- •Вопросы для самоконтроля
- •Список литературы Основная
- •Дополнительная
- •Библиографический список
- •Содержание
Список литературы Основная
1. Грабовский Р.И. Курс физики / Р. И. Грабовский. – СПб.; Издательство «Лань», 2002.-608 с.
2. Пронин В.П. Краткий курс физики / В.П. Пронин. – Саратов: ФГОУ ВПО «Саратовский ГАУ», 2007 г. – 200 с.
3. Трофимова Т.И. Курс физики / Т.И. Трофимова. – М.: «Высшая школа». 2003 г. – 350с.
Дополнительная
1.Матвеев А.Н. Механика и теория относительности. Учебное пособие/ С.-Петербург: Издательство «Лань», 2009г. 500экз.
2.Рогачев Н.М. Курс физики. Учебное пособие// С.-Петербург: Издательство «Лань», 2010г.- 448с. 1000 экз.
3.Трофимова Т.И.Физика в таблицах.. М.: «Высшая школа». 2008г
Лекция 10 идеальные и реальные газы.
1 Уравнение идеального газа. Экспериментальные газовые законы
При изучении кинетической теории газа рассматривают так называемый идеальный газ. Газ, в котором пренебрегаем силами межмолекулярного взаимодействия и объемом молекул газа. Процессы в газе, при которых меняются его параметры состояния, называются газовыми процессами. Газовые процессы, в которых один из параметров остается неизменным называются изопроцессами («изо» - равный).
Для идеальных газов справедливы следующие законы:
Закон Бойля-Мариотта. (Бойль – англ., 1662г.; Мариотт – франц., 1667г.)
Если Т = const данной массы газа (m = const), а давление P и V – объем изменяются. Процесс называется изотермическим.
«Для данной массы газа при постоянной температуре давление газа изменяется обратно пропорционально объему». PV = const (1)
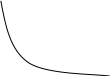
Для двух состояний газа закон имеет вид: P V = P V , где P и V - начальное состояние, P и V - в конечном состоянии. Графически изотермический процесс представляется в виде гиперболы, называемой изотермой (рис. 28).
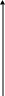

Р
Т = const
0
V,
м![]()
Рисунок 28
V
Р = const

t, С

 Рисунок
29
Рисунок
29
Законы Гей-Люссака. (1802 г.)
Давление Р = const и m = const. Процесс изобарический(Рис.29).
«Для данной массы газа при постоянном давлении объем газа изменяется линейно с температурой».
V![]() = V
= V![]() ( 1 + dt
) (2),
( 1 + dt
) (2),
где V - объем при t = 0 С;
V - объем газа при t;
d
– коэффициент объемного расширения;
d
=
![]() град
.
град
.
Графически
изобарический процесс представляет
прямую.
![]() =
=
![]() (3)
(3)
«При постоянном давлении объем газа пропорционален абсолютной температуре».
Объем V = const и m = const. Процесс изохорический. Иногда этот закон называют закон Шарля.
«Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой».
P![]() = P
( 1 + γt
) (4),
= P
( 1 + γt
) (4),
где P - давление при t = 0 С;
γ – термический коэффициент давления; γ = град .
Графически изохорический процесс представляет прямую (рис. 30).
P
V = const
P
- 273 0 t, С
Рисунок 30
![]() =
(5)
=
(5)
«При постоянном объеме давление газа пропорционально абсолютной температуре».
Закон Дальтона (1801 г., англ.)
Парциальным давлением газа, входящего в газовую смесь, называется давление, которое имел бы этот газ, если бы он один занимал весь объем, представленной смеси.
«Давление газовой смеси равно сумме парциальных давлений входящих в нее газов».
P
= P
+ P
+ P![]() + P
+ P![]() + … + P
+ … + P![]() (6)
(6)
4. Закон Авогадро (итал., 1811 г.)
«При одинаковых температуре и давлении моли любых газов занимают одинаковые объемы».
При нормальных
условиях (температура 273,16 К и давлении
1,0133 Па) этот объем равен 22,41
![]() .
.
Уравнение Клапейрона-Менделеева.
Это уравнение
выражает объединенный закон газового
состояния. Он устанавливает связь между
P,V
и T
при их изменении. Состояние некоторой
массы m
газа характеризуется параметрами P
,V
и T
.
Переведем ее в другое состояние P
,V
и T
в два этапа: а) изотермически (T
= const)
по закону Бойля – Мариотта V
P
= V
P![]() ,
откуда P
=
,
откуда P
=
![]() ;
б) изохорически (V
= const).
Этап описывается законом Гей-Люссака
(5):
;
б) изохорически (V
= const).
Этап описывается законом Гей-Люссака
(5):
![]() =
=
![]() подставим значение P
,
получим
подставим значение P
,
получим
![]() =
,
откуда
=
,
откуда
![]() =
=
![]() .
.
Для данной массы
газа величина
![]() остается неизменной:
остается неизменной:
![]() = B
= const
(7) – уравнение Клайперона (1834г.)
= B
= const
(7) – уравнение Клайперона (1834г.)
Но В является различной для различных газов. Она зависит от массы газа и его природы. Менделеев (1875г.) объединил уравнение (7) с законом Авогадро и получил
![]() = R
(8),
= R
(8),
где R
– универсальная газовая постоянная (R
= 8,32
![]() ).
).
Иногда PV![]() = RT
(9) – уравнение Клапейрона-Менделеева
для одного моля газа.
= RT
(9) – уравнение Клапейрона-Менделеева
для одного моля газа.
PV
=
![]() RT
(10) – уравнение состояния идеального
газа для любой массы газа.
RT
(10) – уравнение состояния идеального
газа для любой массы газа.
Молекулы, благодаря хаотического движения, ударяют о стенки сосуда с некоторой небольшой силой, перпендикулярной к поверхности стенки. Так как молекул бесчисленное множество стенки сосуда испытывают сравнительно большую силу. Эта сила, рассчитанная на единицу площади – есть давление газа, которое обусловлено тепловым давлением молекул.
Давление (Р) газа
является функцией φ средней кинетической
энергии поступательного движения его
молекул
![]() :
:
Р = φ ( )
Введем следующие упрощения:
Молекулы - упругие шарики пренебрежительно малого размера (мат. точки).
Силы сцепления между молекулами пренебрежительно малы.
Силы отталкивания между молекулами проявляются только в моменты взаимодействия.
Число взаимостолкновений между молекулами пренебрежимо мало по сравнению с числом их ударов о стенки сосуда.
Таким образом, газ является идеальным.
Р =
![]() n
(12) - уравнение Клаузиуса.
n
(12) - уравнение Клаузиуса.
«Давление газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в единице объема газа».
Средняя кинетическая энергия поступательного движения молекул идеального газа равна:
=
![]() ,
так как скорость молекул зависит от
температуры газа, то и средняя энергия
зависит от температуры.
,
так как скорость молекул зависит от
температуры газа, то и средняя энергия
зависит от температуры.
Обе части уравнения Р = n умножим на молярный объем газа V . Р V = n V . Зная, что n V = N (постоянная Авогадро), тогда
Р V
=
N
.
Согласно уравнению Клапейрона-Менделеева
Р V
= RT.
Приравниваем последние выражения,
откуда имеем:
N
= RT
откуда
=
![]()
![]() .
Обозначив
.
Обозначив
![]() = k,
получим
=
k
T
(13), где k
– постоянная Больцмана.
= k,
получим
=
k
T
(13), где k
– постоянная Больцмана.
«Средняя кинетическая энергия поступательного движения молекул идеального газа пропорциональна абсолютной температуре и зависит только от нее».
k
= 1,38 * 10![]()
![]()
Подставим в Р = n вместо ее выражение (13), получим зависимость давления газа от температуры: Р = n k T = n k T (14)
Из формулы (14)
получаем:
![]() N
N![]() =
=
![]() (15)
(15)
«При одинаковых температурах и давлении все газы содержат в единице объема одинаковое число молекул».
Число молекул N
в 1 м
при нормальных условиях, называется
числом
Лошмидта.
N
= 2,69 * 10![]() м
м![]() .
.
