
- •Лекція № 9 оксигеновмісні органічні сполуки
- •Класифікація оксигеновмісних органічних сполук
- •Коротка характеристика групи оксигеновмісних органічних сполук
- •1. Алканоли або спирти, або алкоголі
- •Класифікаця спиртів залежно від числа гідроксильних груп
- •За характером карбонового ланцюга
- •Залежно від положення гідроксильних груп
- •1.1. Одноатомні насичені спирти
- •Міжнародна номенклатура спиртів
- •Ізомерія одноатомних насичених спиртів
- •Властивості одноатомних насичених спиртів Фізичні властивості
- •Хімічні властивості
- •8. Якісні реакції на одноатомні спирти.
- •Добування одноатомних насичених спиртів
- •Застосування одноатомних насичених спиртів
- •1.2. Багатоатомні спирти
- •Фізичні властивості
- •Хімічні властивості
- •Добування багатоатомних спиртів
- •Застосування багатоатомних спиртів
- •2. Феноли
- •Фізичні властивості фенолу.
- •Хімічні властивості фенолу
- •Добування фенолу
- •Застосування фенолу
- •3. Альдегіди
- •Гомологічний ряд альдегідів
- •Міжнародна номенклатура альдегідів
- •Властивості альдегідів Фізичні властивості
- •Хімічні властивості
- •Добування альдегідів
- •Застосування альдегідів і кетонів
- •4. Карбонові кислоти
- •Гомологічний ряд одноосновних насичених карбонових кислот
- •Міжнародна номенклатура карбонових кислот
- •Властивості карбонових кислот Фізичні властивості
- •Хімічні властивості
- •Добування карбонових кислот
- •Застосування карбонових кислот
- •Етери або прості ефіри
- •Застосування етерів
- •6. Естери або складні ефіри
- •Застосування естерів
- •7. Жири. Мило. Смз
- •Склад і будова молекул жирів.
- •Фізичні властивості.
- •Значення жирів
- •Хімічні властивості жирів.
- •Мило. Смз
- •Застосування жирів й їхнього значення.
- •8. Вуглеводи
- •8.1. Моносахариди глюкоза
- •Властивості глюкози Фізичні властивості
- •Хімічні властивості
- •Властивості сахарози Фізичні властивості
- •Хімічні властивості
- •Виробництво цукру та застосування сахарози
- •8.3. Полісахариди
- •Властивості крохмалю та целюлози Фізичні властивості
- •Хімічні властивості крохмалю
- •Хімічні властивості целюлози
- •Добування крохмалю та целюлози
- •Застосування крохмалю та целюлози
- •Порівняльна характеристика оксигенвмісних органічних сполук
Хімічні властивості крохмалю
1. Гідроліз. У результаті дії ферментів або під час нагрівання з кислотами (каталізатор — іони Гідрогену) крохмаль піддається гідролізу:
(C6H10O5)n(крохмаль)
+ nH2O
 nC6H12O6(глюкоза)
nC6H12O6(глюкоза)
Процес повного гідролізу є поетапний:
(C6H10O5)n(крохмаль)
 (C6H10O5)m(декстрини
(m<n))
→ xC12H22O11(мальтоза)
→ nC6H12O6(глюкоза)
(C6H10O5)m(декстрини
(m<n))
→ xC12H22O11(мальтоза)
→ nC6H12O6(глюкоза)
Накопичений рослинами крохмаль розщеплюється під дією ферментів. Декстрини мають меншу молекулярну масу, ніж крохмаль. Це має місце при приготуванні їжі: варіння та смаження картоплі, випікання хліба, прасування накрохмаленої білизни. Декстрини легше, ніж крохмаль засвоюються організмом. Суміш продуктів часткового гідролізу (декстринів і глюкози) називають патокою.
2. Якісна реакція на крохмаль. Сполука крохмалю з йодом має характерне синє забарвлення.
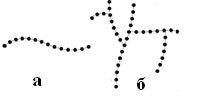
а – амілоза б – амілопектин
26
Крохмаль – неоднорідна речовина, а суміш полімерів двох типів: амілози (25 %) та
амілопектину (75 %). Амілоза має лінійні молекули, амілопектин – розгалужені. Молекули амілози, що входить до окладу крохмалю скручуються у спіралі, всередину яких можуть потрапити, як у пастку, молекули сторонніх речовин. У результаті утворюються сполуки за типом «гість – господар». Саме таким зв’язком пояснюють взаємодію йоду з крохмалем. За допомогою цієї реакції можна контролювати перебіг процесу гідролізу крохмалю. Зі зменшенням кількості молекул крохмалю синє забарвлення поступово переходить у червоне і врешті-решт зникає.
Хімічні властивості целюлози
1. Горіння:
(С6Н10О5)n + 6nO2 → 6nCO2 + 5nH2O
2. Розклад. У результаті нагрівання деревини без доступу повітря відбувається розкладання целюлози з утворенням деревного вугілля, метанолу та інших цінних оксигеновмісних сполук.
(С6Н10О5)n
 Деревне
вугілля, вода, оксигеновмісні органічні
сполуки (метанол,
Деревне
вугілля, вода, оксигеновмісні органічні
сполуки (метанол,
ацетон, оцтова кислота та ін.).
2. Також, як і крохмаль, піддається гідролізу під час нагрівання з розбавленими розчинами кислот і перетворюється на глюкозу:
(С6Н10О5)n + nH2O → (С6Н12О6)n (глюкоза)
В органах травлення жуйних тварин і термітів під впливом ферментів відбуваються гідроліз клітковини і засвоєння продуктів гідролізу. В організмі людини целюлоза, спожита з рослинною їжею, не гідролізує, отже, не засвоюється. Целюлоза зазнає часткового гідролізу в результаті силосування соломи, кукурудзи тощо, такі продукти є цінним кормом для сільськогосподарських тварин.
3. Вступає в реакцію естерифікації з кислотами.
Естер целюлози – триацетат [С6Н7О2(ОСОСН3)3]n добувають обробкою целюлози оцтовим ангідридом. На відміну від целюлози її триацетат розчиняється в органічних розчинниках, тому з целюлози можна виробляти волокна і плівку:
![]()
![]()
Унаслідок взаємодії целюлози з нітратною кислотою утворюється целюлоза тринітрат, або піроксилін. Це вибухова речовина, її використовують для виробництва бездимного пороху:
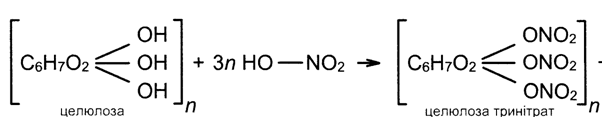
+ 3nH2O
Суміш моно- і динітрату целюлози є основою для виготовлення колодію (використовують у медицині для заклеювання невеликих ран), нітролаків, целулоїду Останній відомий як перша в історії пластмаса.
27
