
- •Методичні вказівки
- •Зміст модуля I
- •1. Основні хімічні поняття і стехіометричні закони
- •1.1. Предмет хімії і основні хімічні поняття
- •1.2. Основні закони хімічної взаємодії
- •1.3. Запитання для самоконтролю
- •1.4. Задачі для самоконтролю
- •2. Основні класи неорганічних сполук
- •2.1. Оксиди
- •2.2. Гідрати оксидів
- •2.2.1. Основи
- •2.2.2. Амфотерні гідроксиди
- •2.2.3. Кислоти
- •2.4. Запитання для самоконтролю
- •2.4. Задачі для самоконтролю
- •3. Будова атома. Періодичний закон д.І.Менделєєва
- •3.1. Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
- •3.2. Квантові числа
- •3.3. Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •3.4. Періодичний закон та періодична система елементів д.І.Менделєєва
- •3.5. Радіуси атомів та йонів елементів
- •3.6. Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •3.7. Запитання для самоконтролю
- •3.8. Задачі для самоконтролю
- •4. Хімічний зв’язок. Кристалічний стан речовин
- •4.1. Основні типи хімічного зв’язку. Ковалентний зв’язок
- •4.2. Іонний зв'язок
- •4.3. Металічний зв'язок
- •4.4. Водневий зв'язок
- •4.5. Міжмолекулярна взаємодія
- •4.6. Тверді тіла. Типи кристалічних граток
- •4.7. Запитання та задачі для самоконтролю
- •5. Основи хімічної термодинаміки
- •5.1. Основні термодинамічні поняття
- •5.2. Термохімія.
- •5.3. Напрям перебігу хімічних процесів.
- •5.4. Питання для самоконтролю
- •5.5. Задачі і вправи для самостійної роботи
- •6.Хімічна кінетика і рівновага
- •6.1. Загальні уявлення про швидкість хімічних реакцій
- •6.3. Закон діючих мас
- •6.4. Енергія активації
- •6.5. Вплив температури на швидкість реакції
- •6.6. Каталіз
- •6.7. Хімічна рівновага
- •6.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •6.9. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
6.Хімічна кінетика і рівновага
6.1. Загальні уявлення про швидкість хімічних реакцій
Розділ хімії, який вивчає перебіг хімічних процесів за певний час, має назву хімічної кінетики.
Дослідження
кінетики хімічних процесів має не тільки
теоретичний, а й практичний інтерес.
Необхідність врахування кінетичного
фактора при розгляданні хімічних реакцій
можна побачити на прикладі взаємодії
кисню і водню. Незважаючи на те що
реакція: 2Н2(г)
+ О2(г) = 2Н2О(г),
![]() =
- 456,4 кДж
=
- 456,4 кДж
характеризується
значним зменшенням ізобарного потенціалу,
тобто є можливість самовільного перебігу
процесу, за звичайних умов водень і
кисень між собою не реагують, а їхня
суміш може зберігатись будь-який час.
При наявності каталізатора або при
нагріванні до 700о С (![]() =
— 495,3 кДж) суміш реагує дуже швидко
або навіть з вибухом. В обох випадках
ізобарний потенціал системи майже
однаковий, а кінетичні особливості
різні.
=
— 495,3 кДж) суміш реагує дуже швидко
або навіть з вибухом. В обох випадках
ізобарний потенціал системи майже
однаковий, а кінетичні особливості
різні.
Розглядаючи питання хімічної кінетики, треба розрізняти гомогенні і гетерогенні реакції. Хімічні реакції, які відбуваються в гомогенній системі, називаються гомогенними. Гомогенна система складається лише з однієї фази (газова фаза, рідкий розчин). Гетерогенні реакції відбуваються в неоднорідному середовищі між речовинами, які перебувають у різних фазах (газ і рідина, кристал і рідина тощо). Якщо гомогенні реакції відбуваються у всьому об'ємі системи, то перебіг гетерогенних реакцій можливий лише на поверхні поділу фаз.
Швидкість хімічних реакцій характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії або розкладання за одиницю часу в одиниці об'єму (для гомогенних реакцій) або на одиницю поверхні поділу фаз (для гетерогенних реакцій).
Для гомогенних процесів, що відбуваються без зміни об'єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу.
Зміна концентрацій дорівнює різниці між концентрацією С2, що відповідає моменту часу τ2, і початковою концентрацією С1 в момент часу τ1. Тоді середня швидкість реакції дорівнює:
![]() (6.1)
(6.1)
Чим
менший проміжок часу ∆τ, тим менша зміна
концентрації ∆С і тим ближче відношення
∆С/∆τ
до істинної швидкості хімічної реакції.
Відомо, що концентрації речовин у
хімічному процесі змінюються безперервно
(рис.6.1),
тому правильніше описувати хімічний
процес у певний момент часу за допомогою
істинної швидкості реакції. Точний
математичний вираз істинної швидкості
реакції є перша похідна від концентрації
за часом:
![]() (6.2)
(6.2)
Оскільки швидкість хімічних реакцій завжди додатна і характеризується зміною концентрацій реагуючих речовин (С2 < С1), то величина ∆С (dC) буде від'ємна і відношення ∆С/∆τ (dC/dτ) у формулах (6.1), (6.2) треба брати із знаком «мінус». Якщо швидкість реакції визначають за зміною концентрації одного з продуктів реакцій (див. рис.6 1), то величина ∆С (dC)додатна і відношення ∆С/∆τ (dC/dτ) у формулах (6.1), (6.2) треба брати із знаком «плюс». Швидкість хімічних реакцій,
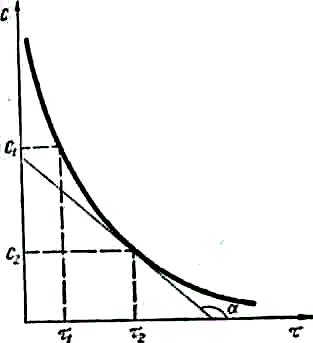

реакції (б).
а б
Рис. 6.1. Зміна концентрацій С реагуючих речовин (а) та продуктів (б)
як правило, вимірюють у моль/(см3∙хв). Істинна швидкість реакцій дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу (див. рис. 6.1):
![]() =
tg α.
=
tg α.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів.
