
- •Isbn 5-861852-282-0 © Мурманский государственный технический университет, 2006
- •© Николай Георгиевич Воронько оглавление Предисловие
- •Лабораторная работа 1 Рефрактометрия и строение молекул
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Измерение и обработка результатов измерения
- •Контрольные вопросы
- •Литература
- •Лабораторная работа 2 Калориметрия. Определение интегральной теплоты растворения хорошо растворимой соли
- •Краткие теоретические сведения
- •Зависимость энтальпии реакции от температуры. Закон Киргофа
- •Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
- •Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
- •§5. Структурная температура и растворимость солей
- •Время ядерной спин-решеточной релаксации воды т1 при 21 с
- •§ 6. Растворимость в воде неполярных газов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Примеры решения задач
- •Контрольные задачи
- •Cтандартные мольные энтальпии образования при 25 с (в кДж/моль)
- •Cтандартные мольные энтальпия образования и сгорания веществ при 25 с (в кДж/моль)
- •Энтальпия фазовых переходов Нm (в кДж/моль)
- •Значения энергии разрушения кристаллической решетки (Екр), энергии гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Энтальпия кристаллической решетки (н) при 25 с [1], энергия гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Лабораторная работа 3 Определение молярной массы растворенного вещества методом криометрии
- •Краткие теоретические сведения
- •Значения эвтектических температур водных растворов различных солей
- •Экспериментальная часть
- •Порядок выполнения работы
- •Выводы: Контрольные вопросы
- •Примеры решения задач
- •Контрольные задачи
- •Лабораторная работа 4 изучение электрической проводимости растворов электролитов
- •Краткие теоретические сведения
- •Экспериментальная часть Измерение электропроводности растворов электролитов методом компенсации
- •Измеритель rcl р5030
- •Порядок измерения сопротивления растворов электролитов на измерителе rcl р5030
- •Калибровка кондуктометрической ячейки
- •Опыт 1. Определение электрической проводимости растворов слабого электролита различной концентрации Порядок выполнения
- •Опыт 2. Определение электрической проводимости растворов сильного электролита различной концентрации Порядок выполнения
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Лабораторная работа 5 фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Краткие теоретические сведения
- •Основные понятия и определения формальной кинетики
- •Средняя и истинная скорость реакции
- •Закон действующих масс
- •Принцип независимости протекания реакций
- •Вычисление констант скорости реакций различных порядков
- •Способы определения порядка реакции
- •Экспериментальная часть
- •1. Фотометрический метод.
- •Аппаратура и техника измерений
- •Порядок измерения оптической плотности на колориметре кфк-2
- •Порядок измерения оптической плотности на фотометре кфк-3
- •Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Порядок выполнения работы
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Литература
Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
Вещество |
Число молей Н2О на 1 моль растворенного вещества |
t, C |
Нраст, кДжмоль-1 (термодинамическая система) |
KCl |
200 |
20 |
+18.28 (теплота поглощается) |
KNO3 |
400 |
15 |
+ 36.28 |
CuSO4 |
400 |
18 |
66.11(теплота выделяется) |
CuSO4 5H2O |
400 |
18 |
+11.51 |
Na2CO3 |
1000 |
25 |
23.47 |
NH3 |
|
|
+33.158 |
NaCl |
110 |
|
+2.51; +3.9 |
Растворение может сопровождаться поглощением или выделением теплоты. При растворении твердых хлористого аммония, азотнокислого аммония, гидроокиси калия и жидкой серной кислоты теплота растворения составляет (в кДжмоль1): 16.5 (NH4Cl), 26.5 (NH4NO3), – 54.2 (КОН) и – 74.5 (H2SO4), что примерно на порядок меньше энергий химических реакций.
Тепловой эффект реакции растворения соли (энтальпия растворения соли Нраст) равен алгебраической сумме тепловых эффектов составля-ющих процесса растворения:
Нраст = Нразр.кр + Нгидр, (7)
где Нразр.кр – энтальпия разрушения структуры растворяемого вещества (кристалла или жидкости); Нгидр – энтальпия гидратации растворенных веществ.
Энтальпия разрушения структуры (Нразр.кр > 0) равна энергии, необходимой для разрыва связей между структурными частицами и равномерного распределения частиц по всему объему растворителя (рис. 1). Энтальпия гидратации растворенных частиц (Нгидр < 0) равна энергии, выделяющейся при образовании новых связей между частицами растворенного вещества и молекулами растворителя.
Знак теплового эффекта растворения может быть положительным или отрицательным в зависимости от того, какая из составляющих процесса растворения больше. Величина и знак теплового эффекта зависят не только от вида соли, но и от температуры и концентрации. Поглощение энергии при растворении 1 моль NaCl в 110 молях воды показывает, что энергия, выделяющаяся при образовании связей ионов Na+ и Cl с молекулами воды (Нгидр), не полностью компенсирует величину энергии (Нразр.кр), требующейся для разрушения кристаллической решетки NaCl.
Величина энергии кристаллической решетки NaCl, точнее теплота образования Na+Cl(крист.) из газообразных ионов Na+(г) + Cl(г) Na+ Cl (крист.), показывает, что ионы натрия и хлора в кристаллической решетке прочно связаны друг с другом. Однако небольшая величина Нраст соли NaCl обусловлена тем, что при растворении соли происходит образование новых связей, энергия которых немного меньше энергии связей ионов натрия и хлора в структуре кристалла.
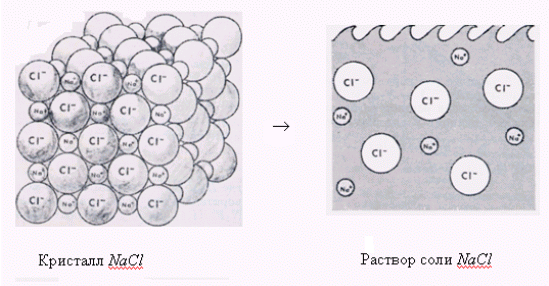
Рис. 1. Растворение в воде кристалла поваренной соли
§3. Энергия кристаллической решетки представляет собой сумму кинетической и потенциальной энергии взаимодействия структурных частиц кристалла. Принято считать, что потенциальная энергии притяжения отрицательна, а кинетическая энергия и потенциальная энергии отталкивания – положительны. Полная энергия системы связанных частиц всегда отрицательна (суммарная энергия взаимодействия частиц друг к другу больше их кинетической энергии). Энергия, требующаяся для разрушения кристаллической решетки на составные части и удаления их на бесконечно большое расстояние (отсутствие взаимодействия) без сообщения им кинетической энергии, равна по величине энергии кристаллической решетки и противоположна ей по знаку.
Ионные кристаллы образуются за счет кулоновского взаимодействия. Притяжение между ближайшими ионами противоположного знака сильнее кулоновского отталкивания между ближайшими ионами одного знака, так как расстояния между ними больше расстояния между ближайшими ионами разного знака.
Ионы простого ионного кристалла при образовании твердого состояния стремятся "заполучить" электронные оболочки атомов инертных газов. Так, например, атом Na стремится "заполучить" электронную конфигурацию атома Ne [1S2 2S2 2P6], а атом Cl – конфигурацию атома Ar [1S2 2S2 2P6 3S2 3P6]. Атомы инертных газов имеют замкнутые электронные оболочки, в которых распределение электрического заряда имеет сферическую симметрию. Поэтому предполагается, что в рассматриваемой модели распределение заряда ионов в кристалле имеет сферическую симметрию.
Энергию ионной кристаллической решетки можно оценить исходя из ее модели:
структурными частицами ионных кристаллов являются ионы, обладающие зарядами (1, 2, …);
ионы обладают сферической симметрией;
расстояние между взаимодействующими ионами равно сумме радиусов ионов;
влияние всех ионов кристалла на энергию взаимодействия выбранной ионной пары учитывается с помощью постоянной Маделунга;
отталкивательная часть энергии взаимодействия определяется с помощью упругих свойств кристалла.
Модель структуры хлористого натрия можно построить, располагая попеременно ионы Na+ и Cl в узлах простой кубической решетки. В кристалле NaCl каждый ион окружен шестью ближайшими ионами с зарядом противоположного знака и 12 ионами, следующими за ближайшими ионами и имеющими заряд того же знака, что и исходный. Пространственная решетка NaCl – гранецентрированная кубическая.
Потенциальная энергия притяжения пары ионов с равными по величине и противоположными по знаку зарядами (zie и –zje), находящимися на расстоянии Rij, определяется по выражению
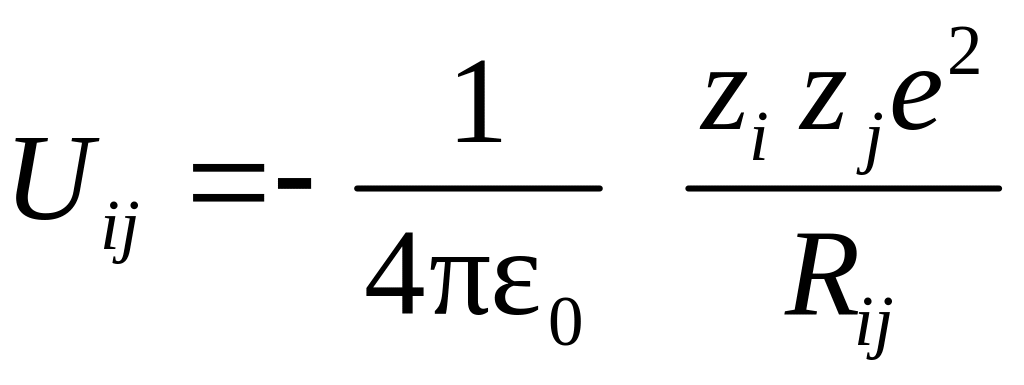 . (8)
. (8)
Энергия взаимодействия отдельного катиона со всеми другими ионами (катионами и анионами) дается выражением
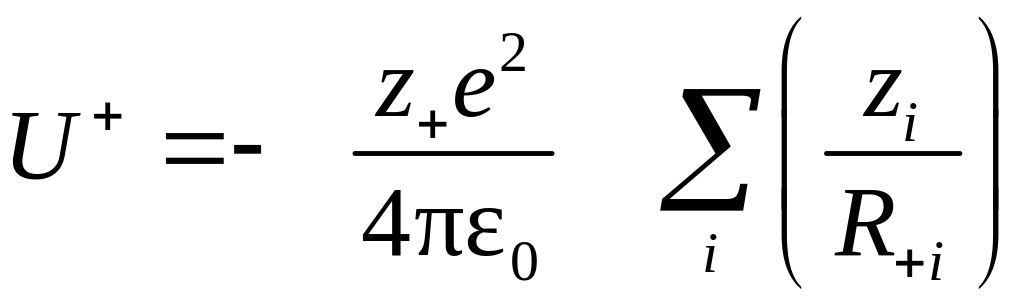 ,
,
где R+i– расстояние от выбранного катиона с зарядом (z+ie) до какого-либо иона i с зарядом (zie). Расстояние R+i в кристаллической решетке (строгое расположение структурных частиц в пространстве) можно выразить через расстояние между ближайшими ионами R0 (катионом и анионом): R+i= +I R0. Тогда для энергии U+ можно записать
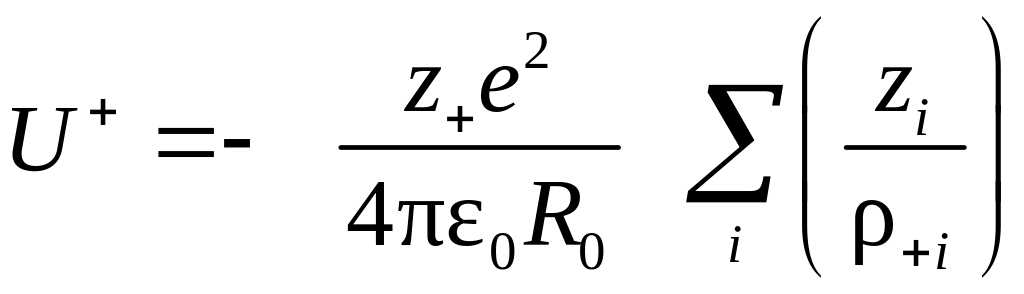 .
.
Аналогичное выражение можно записать и для энергии взаимодействия отдельного аниона
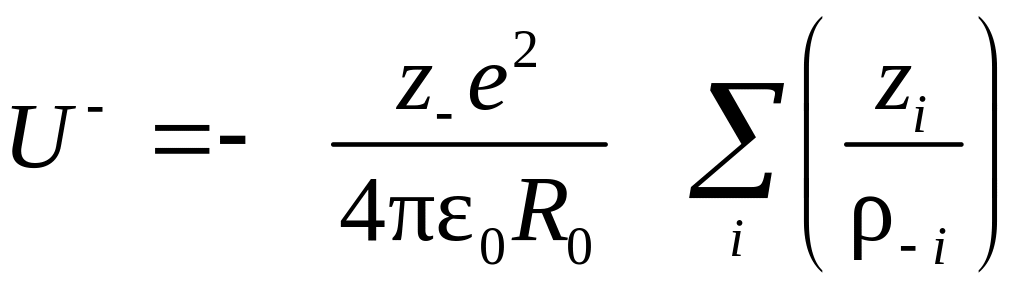 ,
,
где -i R0 – расстояние от данного аниона до i-го иона.
Общая энергия, соответствующая кулоновскому взаимодействию, равна:
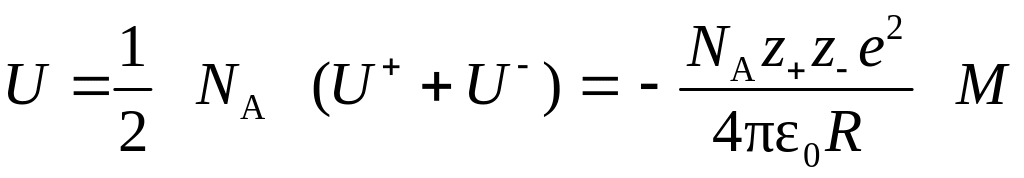 , (9)
, (9)
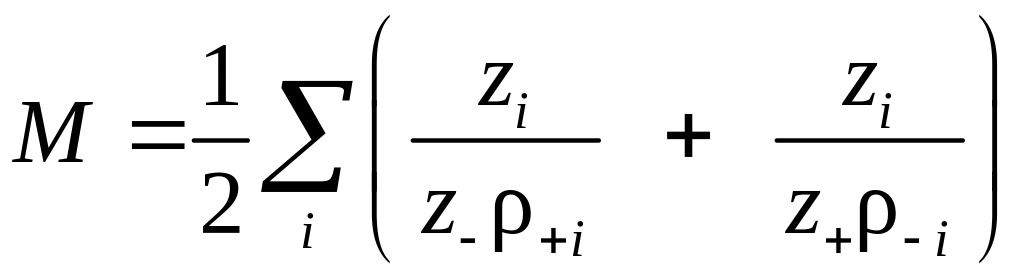 , (10)
, (10)
где М – постоянная Маделунга (величина, учитывающая взаимодействие выбранной пары ионов со всеми другими ионами кристаллической решетки). Постоянная Маделунга вычислена для различных решеток и приведена в справочной литературе.
В выражения (7) и (8) введен множитель (1/2) для того, каждая пара молекул системы при подсчете учитывалась один раз.
Полная потенциальная энергия взаимодействия в кристалле складывается из энергии кулоновского взаимодействия и энергии обменного отталкивания микрочастиц. Обменное отталкивание в количественном отношении практически не изучено, поэтому на практике часто используются различные эмпирические функции, например экспоненциальная функция
![]()
где R* – расстояние, характеризующее область сил обменного отталкивания. Расстояние R* определяется из экспериментальных значений R0 и модуля упругости (в СИ):
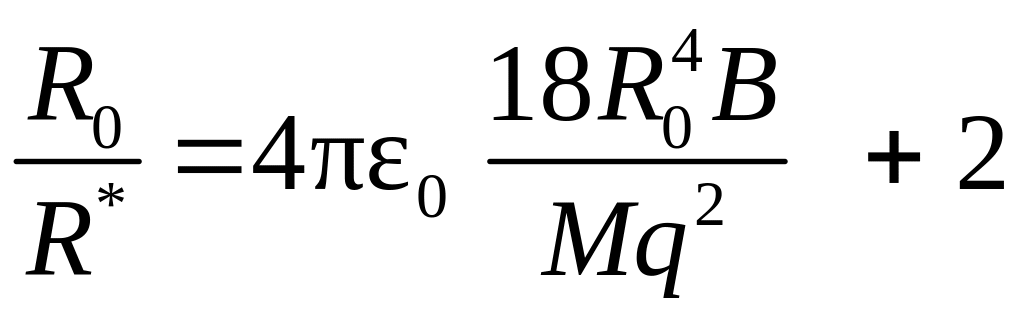 , (11)
, (11)
где В
– модуль
упругости кристалла (ВNaCl
= 2.40 1010
Нм-2, М =
1.747565, R0 =
2.820 1010
м). Отсюда
![]() = 0.3211010
м [3].
= 0.3211010
м [3].
Выражение для полной энергии взаимодействия, использующее расстояние между ближайшими ионами R0 и эмпирическую константу R*, может быть записано в виде
 . (12)
. (12)
Подставив приведенные выше данные в формулу (12), получим

Экспериментальные значения энергии кристаллических решеток при температуре 298.15 К приведены в табл. (приложение). Напомним, что энергия разрушения кристаллической решетки равна по величине и противоположна по знаку энергии кристаллической решетки (Екр= -Еразр. кр).
Рассмотрим схему расчета энергии кристаллической решетки соли NaCl по термодинамическому циклу. Из справочника [4] находим все необходимые для расчета данные:
Вид процесса |
Значение энергии, кДж /моль |
Энтальпия образования соли NaCl из простых веществ |
|
Энтальпия сублимации Na |
Нсубл = 108.7 |
Энтальпия образования Cl |
Нобр = 121.4 |
Потенциал ионизации Na |
I (Na) = 495.0 |
Сродство к электрону атома Cl |
СЭ (Cl) = –368.0 |
Энергия ионной (NaCl) кристаллической решетки равна
Е.кр = (NaCl) -Нсубл - Ндисс - I - СЭ, (13)
где - энтальпия образования данного вещества, Нсубл - энергия сублимации металла, Ндисс - энергия диссоциации молекул газа на атомы, I - энергия ионизации атомов металла, CЭ - сродство к электрону.
Из выражения (13) с учетом справочных данных, получаем:
Е.кр = 411.0 - 108.07 - 121.4 - 495 +368 -768 кДжмоль-1.
Видим, что значения энергии кристаллической решетки, найденные двумя разными методами, неплохо согласуются друг с другом.
§4. Сольватация (гидратация ионов). Сольватация (гидратация, если растворитель – вода) – взаимодействие растворенных частиц с молекулами растворителя. Явление гидратации впервые было открыто Менделеевым. Менделеев считал, что растворение (solvere – растворять) может представлять собой не только физический, но и химический процесс (образование химических связей частиц растворенного вещества с молекулами растворителя). При взаимодействии ионов солей растворенного вещества с молекулами растворителя происходит образование сольватных (гидратных) оболочек, которые экранируют кулоновское взаимодействие ионов растворенного вещества.
Вещества, в кристаллы которого входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной. Прочность связи между частицами растворенного вещества и молекулами растворителя различна. Так, кристаллогидраты соды (Na2CO3 10 H2O) на воздухе легко теряют воду и постепенно рассыпаются в порошок, а из кристаллогидрата хлорида алюминия (AlCl36H2O) вода практически не удаляется.
Структура и свойства сольватных оболочек практически не изучены. Однако существует гипотеза, что при сольватации ионы имеют внутреннюю и внешнюю оболочки. Энергия взаимодействия молекул внутренних гидратных оболочек с ионом существенно отличается от энергии взаимодействия молекул друг с другом. Так, например, многие электролиты удерживают гидратационную воду настолько прочно, что даже при выпаривании растворов твердая фаза кристаллизуется в виде кристаллогидратов (MgSO4 ∙ 7H2O, СuSO4 ∙ 5H2O, FeCl2 ∙ 5H2O и т. д.). По Х.С. Френку и В.Н. Вину [5] ионы в водном растворе окружены двумя слоями (рис. 2). Во внутреннем слое (А) ионы существуют в виде Х(Н2О)n. Энергия взаимодействия ионов с молекулами воды внутреннего слоя велика, поэтому молекулы воды внутреннего слоя менее подвижны, чем молекулы в чистой воде (табл. 2).
Образующиеся при растворении солей ионы разных знаков могут обособленно существовать друг от друга только в том случае, если кулоновское поле между ними значительно ослаблено (в результате экранизации ионов молекулами растворителя). Энергия кулоновского взаимодействия обратно пропорциональна расстоянию между центрами зарядов, поэтому с увеличением расстояния между ионами энергия взаимодействия уменьшается. Отсюда следует, что энергия взаимодействия ионов друг с другом в растворах зависит от размеров сольватных оболочек (от числа молекул в этих оболочках).
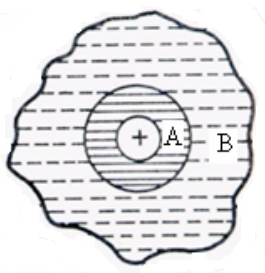
Рис. 2. Модель гидратной оболочки иона в воде
Тепловой эффект реакции растворения зависит не только от состава взаимодействующих частиц, но и от концентрации растворенного вещества. Это объясняется тем, что при увеличении концентрации уменьшается число молекул в сольватных оболочках, что приводит к усилению взаимодействия между сольватированными ионами разных знаков к усилению притяжения между ионами разного знака и отталкивания между ионами одного знака.
В настоящее время существует два основных подхода к изучению закономерностей ионной гидратации:
термодинамический (К.П. Мищенко);
молекулярно-кинетический (О.Я. Самойлов).
В термодинамическом методе гидратация рассматривается как процесс образования термодинамически устойчивых гидратных комплексов. Количественно она характеризуется числом гидратации. Мерой устойчивости гидратного комплекса является энергия взаимодействия иона с окружающими его молекулами (табл. 2).
Таблица 2
