
- •Isbn 5-861852-282-0 © Мурманский государственный технический университет, 2006
- •© Николай Георгиевич Воронько оглавление Предисловие
- •Лабораторная работа 1 Рефрактометрия и строение молекул
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Измерение и обработка результатов измерения
- •Контрольные вопросы
- •Литература
- •Лабораторная работа 2 Калориметрия. Определение интегральной теплоты растворения хорошо растворимой соли
- •Краткие теоретические сведения
- •Зависимость энтальпии реакции от температуры. Закон Киргофа
- •Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
- •Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
- •§5. Структурная температура и растворимость солей
- •Время ядерной спин-решеточной релаксации воды т1 при 21 с
- •§ 6. Растворимость в воде неполярных газов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Примеры решения задач
- •Контрольные задачи
- •Cтандартные мольные энтальпии образования при 25 с (в кДж/моль)
- •Cтандартные мольные энтальпия образования и сгорания веществ при 25 с (в кДж/моль)
- •Энтальпия фазовых переходов Нm (в кДж/моль)
- •Значения энергии разрушения кристаллической решетки (Екр), энергии гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Энтальпия кристаллической решетки (н) при 25 с [1], энергия гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Лабораторная работа 3 Определение молярной массы растворенного вещества методом криометрии
- •Краткие теоретические сведения
- •Значения эвтектических температур водных растворов различных солей
- •Экспериментальная часть
- •Порядок выполнения работы
- •Выводы: Контрольные вопросы
- •Примеры решения задач
- •Контрольные задачи
- •Лабораторная работа 4 изучение электрической проводимости растворов электролитов
- •Краткие теоретические сведения
- •Экспериментальная часть Измерение электропроводности растворов электролитов методом компенсации
- •Измеритель rcl р5030
- •Порядок измерения сопротивления растворов электролитов на измерителе rcl р5030
- •Калибровка кондуктометрической ячейки
- •Опыт 1. Определение электрической проводимости растворов слабого электролита различной концентрации Порядок выполнения
- •Опыт 2. Определение электрической проводимости растворов сильного электролита различной концентрации Порядок выполнения
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Лабораторная работа 5 фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Краткие теоретические сведения
- •Основные понятия и определения формальной кинетики
- •Средняя и истинная скорость реакции
- •Закон действующих масс
- •Принцип независимости протекания реакций
- •Вычисление констант скорости реакций различных порядков
- •Способы определения порядка реакции
- •Экспериментальная часть
- •1. Фотометрический метод.
- •Аппаратура и техника измерений
- •Порядок измерения оптической плотности на колориметре кфк-2
- •Порядок измерения оптической плотности на фотометре кфк-3
- •Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Порядок выполнения работы
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Литература
Значения эвтектических температур водных растворов различных солей
Вещество |
Температура системы, С |
CaCO3 6H2O + вторая твердая фаза |
1.9 |
Na2SO4 10H2O |
(7.2 8.2) |
СaSO4 2H2O |
15.0 |
NaCl 2H2O |
(21.1 21.6) |
KCl |
34.2 |
MgC2 12H2O |
(33.6 36) |
CaCl2 6H2O |
55 |
В зонах вечной мерзлоты часто встречается подземный лед и подземные концентрированные рассолы – криопеги. Температура вымораживания криопегов зависит от концентрации солей, их типа и давления. Встречаются подземные рассолы с температурами 10 36 С. Логично предположить, что в северных широтах криопеги и подземный лед образуются одновременно при вымораживании подземных вод. Вымораживание льда из раствора ведет к увеличению концентрации солей, т. е. к появлению подземных концентрированных рассолов.
Экспериментальная часть
Определение молярной массы вещества проводят с помощью установки, изображенной на рис. 2.
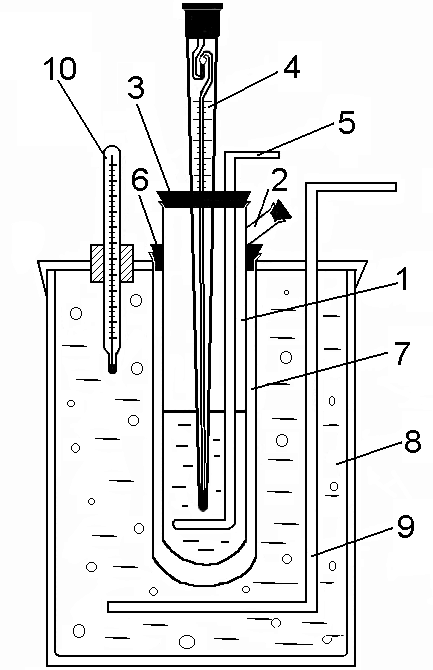
Рис. 2. Опытная установка для определения температуры замерзания раствора данной концентрации
Установка состоит из стеклянной широкогорлой пробирки 1 для растворителя с боковым отростком 3 в верхней части, через который можно вносить исследуемое вещество. Пробирка закрывается пробкой 3, в которую вставляются термометр 4 и латунная мешалка 5. При помощи резиновой прокладки 6 пробирка 1 закрепляется в более широкой стеклянной пробирке 7 и помещается в толстостенный сосуд 8 с охлаждающей смесью. Сосуд 8 закрывается крышкой с отверстиями для пробирки 7, мешалки 9 и термометра 10. Воздушная прослойка между пробирками 1 и 7 служит для более равномерного охлаждения жидкости. При работе с водными растворами используется охлаждающая смесь из снега или мелкого раздробленного льда с поваренной солью. При смешении поваренной соли со снегом или мелко раздробленным льдом происходит образование раствора, сопровождающееся выделением значительной теплоты, что приводит к существенному понижению температуры смеси. При растворении NaCl можно получить охлаждающую смесь с температурой –21,6 С, а при растворении СаСl2 – смесь с температурoй –55 С.
Порядок выполнения работы
1. Определение температуры замерзания растворителя.
1.1. Приготовьте охлаждающую смесь с температурой t 5… 6 оС. Для этого кристаллизатор заполните снегом или мелко раздробленным льдом и добавьте в него небольшое количество холодной воды (около 100 мл). Постепенно добавляя соль NaCl и перемешивая смесь, доведите температуру смеси до 5… 6 оС. Температуру смеси измерьте обычным термометром.
1.2. Заполните сосуд 8 на 2/3 охлаждающей смесью. В пробирку 1 налейте 40 мл (g1 = 1 V1) охлажденной примерно до плюс (12) оС дистиллированной воды. Температура кристаллизации дистиллированной воды равна 0 оС. Вставьте термометр с ценой деления (Сдел = С/дел) в пробирку 1 так, чтобы уровень ртути был закрыт жидкостью, и поместите пробирку в сосуд с охлаждающей смесью.
1.3. Наблюдая за показаниями термометра, переохладите дистиллированную воду примерно до t (12) оС. Достигнув необходимого переохлаждения, энергично и осторожно перемешивайте воду мешалкой до образования льда. При образовании кристаллов льда температура системы вода лед начинает увеличиваться до установления истинной температуры кристаллизации воды, которая затем остается постоянной. Температура воды при образовании льда увеличивается, так как в исследуемую систему выделяется определенное количество теплоты (внутренняя энергия льда меньше внутренней энергии воды):
Q = U + PV = Uлед – Uвода + P (Vлед – Vвода) Uлед – Uвода < 0
(работа PV невелика, поэтому ею можно пренебречь).
Отметьте деление измерительного прибора (термометра), до которого происходит увеличение температуры воды. Это значение данного измерительного прибора и будет cоответствовать температуре кристаллизации растворителя. Выньте пробирку из охлаждающей смеси и расплавьте выделившиеся кристаллы, нагревая пробирку рукой. Вставьте пробирку 1 в рубашку 7 и снова охладите жидкость, перемешивая ее мешалкой 5. При температуре примерно на 0.5 0 выше температуры кристаллизации помешивание прекратите. Переохладите жидкость на 0.5 0 ниже ориентировочно установленной температуры кристаллизации. Интенсивно перемешивая переохлажденную жидкость, вызовите процесс кристаллизации, при котором температура повышается. Максимальную температуру, наблюдаемую при кристаллизации жидкости, отметьте с помощью лупы с точностью до половины цены деления (если шкала прибора непрерывная) и запишите ее как истинную температуру кристаллизации растворителя. Измерение повторите 2-3 раза, вынимая каждый раз пробирку 1 и расплавляя кристаллы. Найдите среднее арифметическое значение температуры замерзания дистиллированной воды (растворителя) и занесите его в табл. 1.
Таблица 1
Результаты измерений и расчетов
№ п/п |
g2, кг |
g1 = 1 V1, кг |
1, кг/м3 |
tз.1,C |
tз,C |
Tз.i= tз.i - tз.1 |
M2, кг/моль |
X=tP, n |
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
< tз.1,C > |
< M2 > |
|||||||
2. Определение температуры кристаллизации раствора.
Приготовьте навеску
растворенного вещества (соли NaCl,
глюкозы или мочевины), соответствующую
![]() 0.3моль/кг,
поместите ее в заранее приготовленный
бюкс и взвесьте его с рассчитанной
навеской с точностью до 0.01 г. В
выражении для расчета
навески объем дистиллированной
воды измерьте с помощью мензурки (40
мл), а плотность охлажденной воды при
данной температуре возьмите из
справочника. После этого, подняв
пробку с термометром, всыпьте
вещество в пробирку 1 и снова взвесьте
бюкс. По разности масс найдите массу
растворенного вещества g2
и из соотношения
0.3моль/кг,
поместите ее в заранее приготовленный
бюкс и взвесьте его с рассчитанной
навеской с точностью до 0.01 г. В
выражении для расчета
навески объем дистиллированной
воды измерьте с помощью мензурки (40
мл), а плотность охлажденной воды при
данной температуре возьмите из
справочника. После этого, подняв
пробку с термометром, всыпьте
вещество в пробирку 1 и снова взвесьте
бюкс. По разности масс найдите массу
растворенного вещества g2
и из соотношения
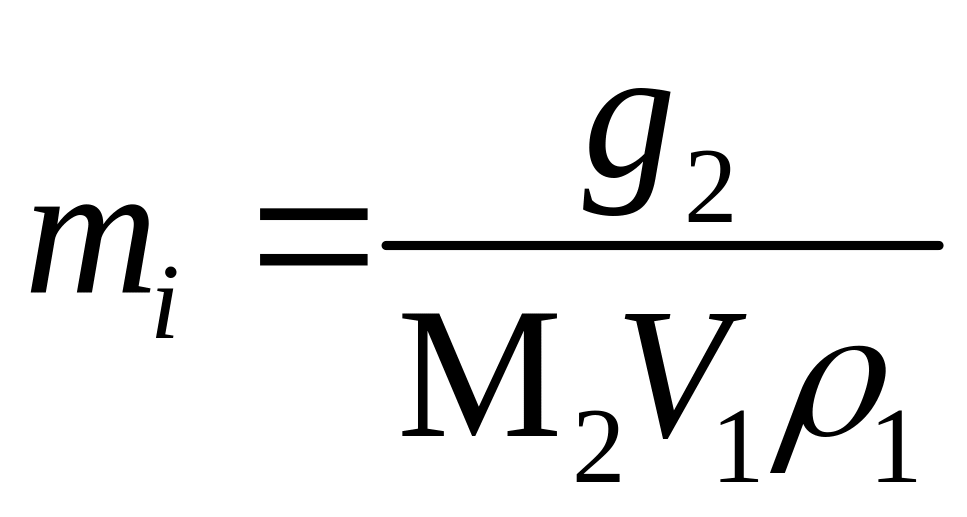
уточните величину моляльной концентрации mi, которую используйте в расчетах по определению характеристик раствора.
2. Определите температуру замерзания полученного раствора, как описано в п. 3 части I. Опыт повторите два раза, данные занесите в табл. 1.
3. По полученным данным вычислите молярную массу растворенного вещества для каждого опыта, данные занесите в табл. 1:
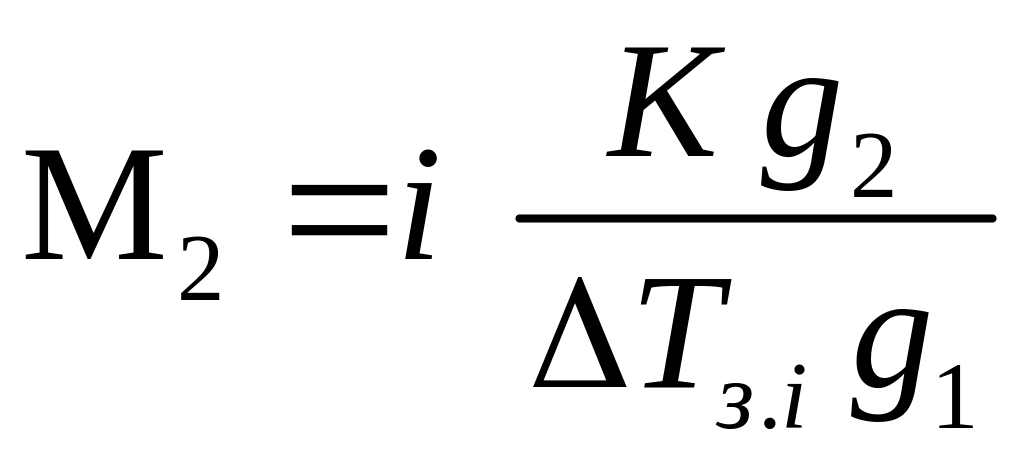 ,
,
где i = 2 для соли NaCl; i = 1 для неэлектролитов (глюкозы, мочевины и т. д.)
4. Обработайте результаты измерений:
найдите среднее
арифметическое значение молярной массы
<М2> растворенного вещества;
абсолютные погрешности М2
<М2>
– М2.i;
среднеквадратичное отклонение
![]() ;
;
определите для
вероятности Р = 0,95 ширину доверительного
интервала Х(М2)
= tP,n
,
где
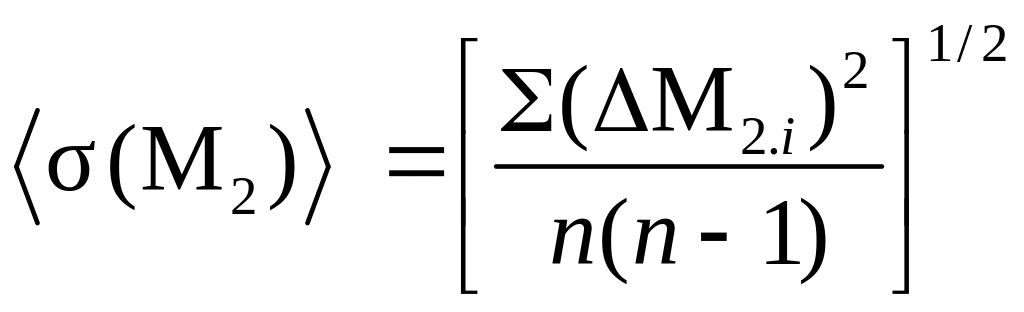 .
Для Р = 0.95 и числа измерений n
= 3 коэффициент Стьюдента tP,n
= 4,3. Если значение М2..i
выходит за пределы <М2>
tP,n,
,
то это значение является "промахом"
и при обработке результатов измерений
не учитывается.
.
Для Р = 0.95 и числа измерений n
= 3 коэффициент Стьюдента tP,n
= 4,3. Если значение М2..i
выходит за пределы <М2>
tP,n,
,
то это значение является "промахом"
и при обработке результатов измерений
не учитывается.
5. Запишите результат расчета в виде
М2 = <М2> Х.
6. Сравните значения <М2> с величиной М2, определенной из таблицы Менделеева (результат сравнения запишите в виде относительной погрешности).
