
- •Isbn 5-861852-282-0 © Мурманский государственный технический университет, 2006
- •© Николай Георгиевич Воронько оглавление Предисловие
- •Лабораторная работа 1 Рефрактометрия и строение молекул
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Измерение и обработка результатов измерения
- •Контрольные вопросы
- •Литература
- •Лабораторная работа 2 Калориметрия. Определение интегральной теплоты растворения хорошо растворимой соли
- •Краткие теоретические сведения
- •Зависимость энтальпии реакции от температуры. Закон Киргофа
- •Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
- •Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
- •§5. Структурная температура и растворимость солей
- •Время ядерной спин-решеточной релаксации воды т1 при 21 с
- •§ 6. Растворимость в воде неполярных газов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Примеры решения задач
- •Контрольные задачи
- •Cтандартные мольные энтальпии образования при 25 с (в кДж/моль)
- •Cтандартные мольные энтальпия образования и сгорания веществ при 25 с (в кДж/моль)
- •Энтальпия фазовых переходов Нm (в кДж/моль)
- •Значения энергии разрушения кристаллической решетки (Екр), энергии гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Энтальпия кристаллической решетки (н) при 25 с [1], энергия гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Лабораторная работа 3 Определение молярной массы растворенного вещества методом криометрии
- •Краткие теоретические сведения
- •Значения эвтектических температур водных растворов различных солей
- •Экспериментальная часть
- •Порядок выполнения работы
- •Выводы: Контрольные вопросы
- •Примеры решения задач
- •Контрольные задачи
- •Лабораторная работа 4 изучение электрической проводимости растворов электролитов
- •Краткие теоретические сведения
- •Экспериментальная часть Измерение электропроводности растворов электролитов методом компенсации
- •Измеритель rcl р5030
- •Порядок измерения сопротивления растворов электролитов на измерителе rcl р5030
- •Калибровка кондуктометрической ячейки
- •Опыт 1. Определение электрической проводимости растворов слабого электролита различной концентрации Порядок выполнения
- •Опыт 2. Определение электрической проводимости растворов сильного электролита различной концентрации Порядок выполнения
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Лабораторная работа 5 фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Краткие теоретические сведения
- •Основные понятия и определения формальной кинетики
- •Средняя и истинная скорость реакции
- •Закон действующих масс
- •Принцип независимости протекания реакций
- •Вычисление констант скорости реакций различных порядков
- •Способы определения порядка реакции
- •Экспериментальная часть
- •1. Фотометрический метод.
- •Аппаратура и техника измерений
- •Порядок измерения оптической плотности на колориметре кфк-2
- •Порядок измерения оптической плотности на фотометре кфк-3
- •Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Порядок выполнения работы
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Литература
Принцип независимости протекания реакций
Число элементарных химических актов по сравнению с общим числом столкновений частиц в единице объема невелико, и совершаются они за относительно короткий отрезок времени (порядка 1011 с), поэтому можно считать, что каждый из них протекает независимо друг от друга. Отсюда вытекает формулировка принципа независимости протекания реакции: если в системе имеет место несколько элементарных химических реакций (стадий), то каждая из них протекает по тем же законам, с той же скоростью, как и в отсутствии других реакций при тех же концентрациях и температуре.
Из принципа независимости вытекает важное следствие. Если в системе протекает несколько элементарных реакций или стадий одной сложной реакции с участием одного и того же вещества, то изменение концентрации последнего будет равно алгебраической сумме скоростей каждой стадии, умноженных на стехиометрический коэффициент этого вещества в данной стадии:
 , (8)
, (8)
где i – номер вещества, участвующей в j-й стадии; S – число стадий; ij – стехиометрический коэффициент i-го вещества, участвующего в j-й стадии; j – скорость реакции в j-й стадии.
В качестве примера рассмотрим реакцию разложения озона
2О3 3О2, (а)
включающую следующие элементарные стадии:
О3 О + О2, (b)
О3 + О 2О2. (c)
Для простоты изложения обе стадии реакции показаны как практически односторонние.
В соответствии с уравнениями (2), (6) и (8) изменение концентрации озона будет определяться следующим соотношением:
![]() .
.
Из приведенного примера следует, что для сложной реакции понятие скорости реакции в целом теряет смысл и можно говорить лишь о скорости образования и расходования того или иного реагента.
Вычисление констант скорости реакций различных порядков
1. Реакции нулевого порядка (p = 0). Нулевой порядок характерен для гетерогенных реакций (например, протекающих на поверхности металла), в которых скорость подвода реагирующего вещества во много раз больше скорости химического взаимодействия. В реакциях нулевого порядка скорость постоянна во времени: = const = k.
Кинетическое уравнение реакции нулевого порядка можно записать в дифференциальной форме, объединив выражения (2) и (7):
 . (10)
. (10)
Так как в уравнении
(10) речь идет о концентрации исходного
вещества, которая в процессе реакции
будет уменьшаться, производную
![]() берем со знаком "–". В начальный
момент времени (1
= 0) концентрация исходного вещества
равна С0, в конечный момент
времени (2= )
концентрация исходного
вещества равна С. Разделив переменные
в уравнении (10) и проинтегрировав левую
часть от С0 до С, а правую
– от 0 до , получим
кинетическое уравнение реакции нулевого
порядка в интегральной форме:
берем со знаком "–". В начальный
момент времени (1
= 0) концентрация исходного вещества
равна С0, в конечный момент
времени (2= )
концентрация исходного
вещества равна С. Разделив переменные
в уравнении (10) и проинтегрировав левую
часть от С0 до С, а правую
– от 0 до , получим
кинетическое уравнение реакции нулевого
порядка в интегральной форме:
 ;
;
![]() . (11)
. (11)
Отсюда можно выразить константу скорости реакции нулевого порядка
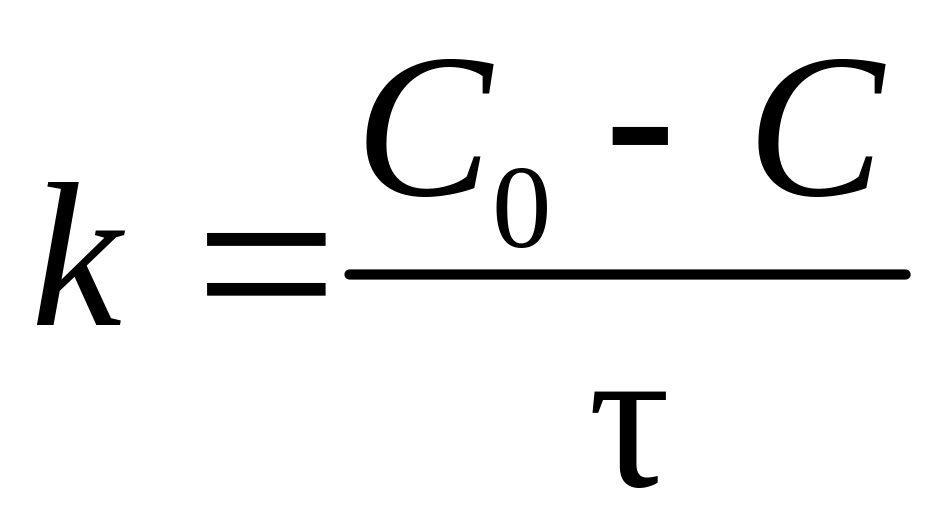 . (12)
. (12)
Из выражения (12) следует,
что константа скорости реакции нулевого
порядка имеет размерность
![]() (для гетерогенной реакции).
(для гетерогенной реакции).
Для характеристики
скорости реакции наряду с константой
скорости часто используют величину,
называемую периодом полураспада. Период
полураспада (время половинного
превращения) 1/2
– это время, за которое начальная
концентрация исходного вещества
уменьшается в два раза. Подставив в
уравнение (10)
![]() вместо С и 1/2
вместо , получим
вместо С и 1/2
вместо , получим
 ;
;
 . (13)
. (13)
Отсюда можно выразить период полураспада реакции нулевого порядка
 . (14)
. (14)
2. Реакции первого порядка (p = 1). К реакциям первого порядка относятся элементарные мономолекулярные реакции, протекающие по схеме
А Продукты. (15)
Примерами таких реакций являются:
реакция термического разложения ряда веществ:
диацетилена (см. выше);
ацетона:
СН3СОСН3 СО + С2Н6;
процессы радиоактивного распада.
Многие сложные реакции формально также можно отнести к первому порядку, например:
реакция гидролитического разложения сахара в разбавленном водном растворе с образованием глюкозы и фруктозы (инверсия сахара):
С12Н22О11 + Н2О С6Н12О6 (глюкоза) + С6Н12О6 (фруктоза);
реакция гидролиза этилацетата в водной среде
СH3COOC2H5 + Н2О CH3COOН + C2H5OH;
реакция разложения хлорида фенилдиазония в воде
С6H5N2Cl + H2O C6H5OH + H+ + Cl- + N2
В данных реакциях концентрация воды, находящейся в избытке, в ходе реакции остается практически постоянной. Такие реакции называются псевдомономолекулярными.
Дифференциальное кинетическое уравнение реакции первого порядка имеет вид
 . (16)
. (16)
Разделив переменные в уравнении (16) и проинтегрировав левую часть от С0 до С, а правую – от 0 до , получим интегральное кинетическое уравнение реакции первого порядка:
 ;
; . (17)
. (17)
Отсюда можно выразить константу скорости реакции первого порядка
 . (18)
. (18)
Из выражения (18) следует,
что константа скорости реакции первого
порядка имеет размерность
![]() измеряется в с1
и не зависит от способа выражения
концентрации.
измеряется в с1
и не зависит от способа выражения
концентрации.
Подставив в уравнение (17) С0/2 вместо С и 1/2 вместо , получим выражение для периода полураспада реакции первого порядка

![]()
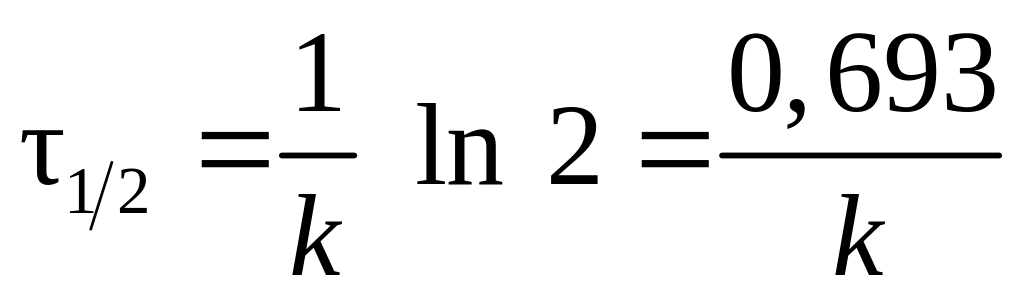 . (19)
. (19)
Из выражения (19) следует, что период полураспада реакции первого порядка не зависит от начальной концентрации реагирующего вещества С0.
3. Реакции второго порядка (p = 2). К реакциям второго порядка относятся элементарные бимолекулярные реакции, протекающие по схеме
А1 + А2 Продукты. (20)
Примерами формально бимолекулярных реакций являются реакции:
образования галогеноводорода в газовой фазе:
H2 (г) + I2 (г) 2HI (г);
омыления сложного эфира при эквивалентных количествах эфира щелочи:
СH3COОC2H5 + NaOH CH3COONa + C2H5OH;
этерификации:
CH3COOH + C2H5OH СH3COOC2H5.
Для реакции второго порядка дифференциальное кинетическое уравнение имеет вид
 . (21)
. (21)
В простейшем случае, когда концентрации двух реагирующих веществ являются одинаковыми, т. е.: С1 = С2 = С, уравнение (21) примет вид
 . (22)
. (22)
Разделив переменные в уравнении (22) и проинтегрировав левую часть от С0 до С, а правую – от 0 до , получим интегральное кинетическое уравнение реакции второго порядка
 . (23)
. (23)
Отсюда можно выразить константу скорости реакции второго порядка (для С1 = С2):
 . (24)
. (24)
Из выражения (24) следует, что константа скорости реакции второго порядка (а также и более высоких порядков) зависит от способа выражения концентрации. Если концентрация реагента выражена в моль/м3 (гомогенная реакция), то константа скорости реакции второго порядка имеет размерность измеряется в м3/(мольс).
Подставив в уравнение (23) С0/2 вместо С и 1/2 вместо , получим выражение для периода полураспада реакции второго порядка (для С1 = С2):
 (25)
(25)
Из выражения (25) следует, что период полураспада реакции второго порядка (и более высоких порядков) зависит от начальной концентрации реагирующего вещества С0.
Если концентрации реагентов в реакции второго порядка неодинаковы, т. е. С1 С2, то в начальный момент времени ( = 0) С1 = С0,1, С2 = С0,2, в момент времени ( 0) С1 = С0,1 – х, С2 = С0,2 – х (где х – количество молей реагента А1 или А2, прореагировавших к моменту времени в единице объема (или на единице поверхности)). Тогда уравнение (21) примет вид
 . (26)
. (26)
Преобразуем уравнение (26) к виду

или
 (27)
(27)
Проинтегрировав левую часть от С0 до С, а правую – от 0 до , получим интегральное кинетическое уравнение реакции второго порядка относительно k (для С1 С2):
 . (28)
. (28)
4. Реакции n-го порядка. Сложные реакции типа
А1 + А2+… Продукты (29)
могут протекать по n-му порядку, при этом n может быть целым или дробным числом. Для реакции n-го порядка дифференциальное кинетическое уравнение при равных начальных концентрациях реагентов имеет вид
 . (30)
. (30)
Разделив переменные в уравнении (30) и проинтегрировав левую часть от С0 до С, а правую – от 0 до , получим интегральное кинетическое уравнение реакции n-го порядка
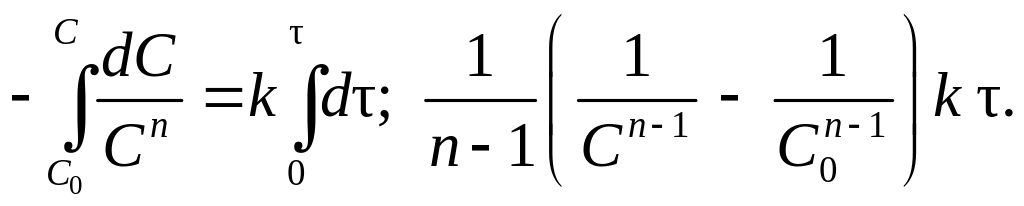 (31)
(31)
Отсюда можно выразить константу скорости реакции n-го порядка
 , (32)
, (32)
а также концентрацию
 . (33)
. (33)
Уравнение (33) позволяет рассчитать концентрацию реагента в любой момент времени , если известны k и n.
Подставив в уравнение (31) С0/2 вместо С и 1/2 вместо , получим выражение для периода полураспада реакции n-го порядка

(34)
 .
.
