
- •Isbn 5-861852-282-0 © Мурманский государственный технический университет, 2006
- •© Николай Георгиевич Воронько оглавление Предисловие
- •Лабораторная работа 1 Рефрактометрия и строение молекул
- •Краткие теоретические сведения
- •Экспериментальная часть
- •Измерение и обработка результатов измерения
- •Контрольные вопросы
- •Литература
- •Лабораторная работа 2 Калориметрия. Определение интегральной теплоты растворения хорошо растворимой соли
- •Краткие теоретические сведения
- •Зависимость энтальпии реакции от температуры. Закон Киргофа
- •Значения теплоты растворения (Нраст) некоторых веществ в воде [1], [2]
- •Энтальпия гидратации ионов и солей в кДжмоль-1[1], [4]; радиусы ионов в пм
- •§5. Структурная температура и растворимость солей
- •Время ядерной спин-решеточной релаксации воды т1 при 21 с
- •§ 6. Растворимость в воде неполярных газов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Примеры решения задач
- •Контрольные задачи
- •Cтандартные мольные энтальпии образования при 25 с (в кДж/моль)
- •Cтандартные мольные энтальпия образования и сгорания веществ при 25 с (в кДж/моль)
- •Энтальпия фазовых переходов Нm (в кДж/моль)
- •Значения энергии разрушения кристаллической решетки (Екр), энергии гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Энтальпия кристаллической решетки (н) при 25 с [1], энергия гидратации (Нгидр) и теплоты растворения (Нраст) некоторых солей в воде
- •Лабораторная работа 3 Определение молярной массы растворенного вещества методом криометрии
- •Краткие теоретические сведения
- •Значения эвтектических температур водных растворов различных солей
- •Экспериментальная часть
- •Порядок выполнения работы
- •Выводы: Контрольные вопросы
- •Примеры решения задач
- •Контрольные задачи
- •Лабораторная работа 4 изучение электрической проводимости растворов электролитов
- •Краткие теоретические сведения
- •Экспериментальная часть Измерение электропроводности растворов электролитов методом компенсации
- •Измеритель rcl р5030
- •Порядок измерения сопротивления растворов электролитов на измерителе rcl р5030
- •Калибровка кондуктометрической ячейки
- •Опыт 1. Определение электрической проводимости растворов слабого электролита различной концентрации Порядок выполнения
- •Опыт 2. Определение электрической проводимости растворов сильного электролита различной концентрации Порядок выполнения
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Лабораторная работа 5 фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Краткие теоретические сведения
- •Основные понятия и определения формальной кинетики
- •Средняя и истинная скорость реакции
- •Закон действующих масс
- •Принцип независимости протекания реакций
- •Вычисление констант скорости реакций различных порядков
- •Способы определения порядка реакции
- •Экспериментальная часть
- •1. Фотометрический метод.
- •Аппаратура и техника измерений
- •Порядок измерения оптической плотности на колориметре кфк-2
- •Порядок измерения оптической плотности на фотометре кфк-3
- •Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
- •Порядок выполнения работы
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Использованная литература
- •Литература
Зависимость энтальпии реакции от температуры. Закон Киргофа
Изменение теплового эффекта реакции в зависимости от температуры выражается законом Кирхгофа
![]() .
(5)
.
(5)
После интегрирования уравнения (5) получаем
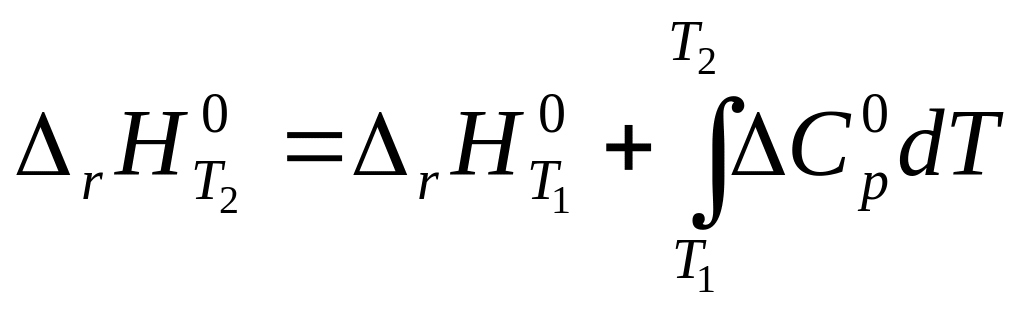 ,
(6)
,
(6)
где
![]() – разность сумм
теплоемкостей продуктов реакции и
исходных веществ, взятых с учетом
стехиометрических коэффициентов.
– разность сумм
теплоемкостей продуктов реакции и
исходных веществ, взятых с учетом
стехиометрических коэффициентов.
Выражение (6) позволяет находить тепловые эффекты реакций при исследуемых температурах. Теплоемкости продуктов реакции и исходных веществ, как правило, рассчитываются по эмпирическим уравнениям типа:
СР = а + bT + c/Т2;
СР = а + bT + c/Т-2;
СР = а + bT +сT lnT.
§2. Теплота растворения. Изменение энтальпии при переходе твердого, жидкого или газообразного вещества в растворитель называют теплотой или энтальпией растворения. Различают интегральную и дифференциальную теплоту растворения.
Интегральной теплотой растворения называют изменение энтальпии при растворении 1 моль вещества в некотором количестве растворителя. Она зависит от концентрации и температуры раствора. Интегральная теплота растворения определяется экспериментально. Возможные значения интегральных энтальпий растворения находятся между значениями первой и полной (последней) интегральных энтальпий растворения.
Первой интегральной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в бесконечно большом количестве чистого растворителя, в результате чего образуется бесконечно разбавленный раствор. Полной интегральной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в таком количестве чистого растворителя, которое необходимо для образования насыщенного раствора.
Дифференциальной или парциальной теплотой растворения называется изменение энтальпии при растворении 1 моль вещества в бесконечно большом количестве раствора данной концентрации. В этом случае концентрация раствора при добавлении к нему некоторого количества растворенного вещества практически не меняется. Дифференциальная теплота растворения 1 моль вещества в бесконечно большом количестве бесконечно разбавленного раствора совпадает с первой интегральной теплотой растворения.
Дифференциальная теплота растворения 1 моль вещества в бесконечно большом количестве насыщенного раствора называется последней теплотой растворения.
Интегральные теплоты растворения, кроме первой и полной, определяются опытным путем. Первая и полная интегральные теплоты растворения и все дифференциальные теплоты растворения находятся при обработке экспериментальных данных.
Растворы разных
концентраций можно получать, растворяя
вещества в растворителе или разбавляя
концентрированный раствор. По
экспериментальным данным об энтальпии
растворения и разбавления можно
рассчитать энтальпии образования
растворов, которые при 298.15 К обычно
обозначаются f
Н (298
К). Мольное значение энтальпии образования
при 298.15 К обозначается
![]() .
Энтальпию образования раствора можно
рассчитать по закону Гесса, используя
экспериментальную величину интегральной
энтальпии растворения. Так как физический
смысл имеет только изменение энтальпии,
а не сама энтальпия, то для удобства
полагают, что энтальпия любого элемента
в его стандартном состоянии равна нулю.
.
Энтальпию образования раствора можно
рассчитать по закону Гесса, используя
экспериментальную величину интегральной
энтальпии растворения. Так как физический
смысл имеет только изменение энтальпии,
а не сама энтальпия, то для удобства
полагают, что энтальпия любого элемента
в его стандартном состоянии равна нулю.
Изменение стандартной энтальпии реакции можно рассчитать, если известны стандартные мольные энтальпии всех участников реакции.
Таблица 1
