
- •Содержание
- •Автомобиль
- •Система индексации автомобилей
- •Мощность – величина, численно равная работе, совершенной за единицу времени.
- •Основные узлы и механизмы
- •Компоновочные схемы
- •Двигатель
- •Кривошипно-шатунный механизм
- •Такты двс
- •Фазы газораспределения
- •Т ермодинамика двс
- •Термодинамические процессы
- •Цикл Карно
- •Показатели цикла
- •Индикаторные диаграммы двс
- •Система питания
- •Карбюратор
- •Система охлаждения
- •Система смазки
- •Шестеренчатый насос
- •Система зажигания
- •Генератор
- •Стартер
- •Привод стартера «Бендикс»
- •Обгонная муфта
- •Двухтактный двигатель
- •Сцепление
- •Г идромуфта
- •Коробка передач
- •Гидротрансформатор
- •Карданная передача
- •Дифференциал
- •П а олуоси
- •Тормоза
- •Рулевое управление
- •Схемы сил, действующих на колесо:
- •У становка колес
- •В зависимости от силовой схемы автомобиля основным несущим элементом может быть рама или кузов.
- •Топливо
- •Э лектрооборудование
- •А ккумулятор
- •Силы при разгоне
- •Устойчивость автомобиля
- •Проходимость автомобиля
- •П лавность хода
- •Технические показатели автомобильных дорог
- •Тяговый расчет автомобиля
- •1. Выбор основных параметров автомобиля
- •2. Внешняя скоростная характеристика двигателя
- •3. Максимальная скорость равномерного движения автомобиля
- •4. Передаточное отношение главной передачи
- •5. Передаточное отношение на первой передаче
- •6. Выбор передаточных чисел коробки передач
- •7. Тяговая характеристика автомобиля
- •Приёмистость автомобиля
- •Сравнительный анализ и выбор предпочтительного варианта легкового автомобиля Введение
- •1. Описание характерных особенностей автомобиля
- •2. Построение структурной схемы исследуемого автомобиля
- •3. Построение Функциональной схемы автомобиля
- •4. Обоснование и выбор критериев сравнения.
- •Требования к критериям сравнения
- •4.1. Дерево критериев оценки
- •Характеристика объектов сравнения
- •6. Определение для каждого обьекта сравнения комплексной оценки качества с использованием экспертных методов
- •6.1. Граф связанности критериев.
- •6.2. Определение соотношений эквивалентности
- •6.3. Определение значений комплексного критерия оценки и относительной комплексной оценки качества
- •Выделение множества эффективных вариантов сравниваемых объектов
- •Выбор предпочтительного варианта объекта, соответствующего конкретным условиям выбора
- •Автомобильные задачи
- •Международная система единиц
- •Автомобильный словарь
- •Дополняйте и уточняйте! Знаете ли вы автомобиль
- •Технические характеристики автомобилей
- •Характеристики автомобильных двигателей
- •Литература
Кривошипно-шатунный механизм
Предназначен для преобразования возвратно-поступательного движения поршня во вращательное движение коленчатого вала;
Состоит: блок цилиндров, поршень с кольцами и пальцем, шатун, коленчатый вал с подшипниками, маховик, картер, поддон картера.
Такты двс
Часть рабочего процесса, совершаемая за один ход поршня, называется тактом. В четырехтактном двигателе рабочий цикл совершается за четыре хода поршня (два оборота коленчатого вала).
Четырехтактный двигатель ДВС:
впуск рабочей смеси
сжатие
рабочий ход
выпуск отработанных газов
Порядок работы двигателя – чередование рабочих ходов по цилиндрам в зависимости от положения коленчатого вала. Последовательность вспышек обеспечивает более равномерную нагрузку на коренные шейки коленчатого вала (1-2-4-3, 1-3-4-2).
Г![]()
![]() азораспределительный
механизм
азораспределительный
механизм

 Для своевременной
подачи, сгорания горючей смеси и выпуска
отработанных газов.
Для своевременной
подачи, сгорания горючей смеси и выпуска
отработанных газов.
С![]()
![]() остоит:
цепной привод, распределительный вал,
коромысла (рычаги) привода клапанов,
клапаны, втулки, седла, пружины.
остоит:
цепной привод, распределительный вал,
коромысла (рычаги) привода клапанов,
клапаны, втулки, седла, пружины.
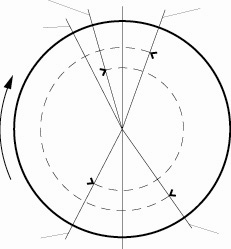
Фазы газораспределения
Ф
 азы
газораспределения – моменты начала
открытия и конца закрытия клапанов,
выраженные в углах поворота коленчатого
вала.
азы
газораспределения – моменты начала
открытия и конца закрытия клапанов,
выраженные в углах поворота коленчатого
вала.
![]()
Т ермодинамика двс
Идеальный газ – условное газообразное вещество, неизменный по весу, составу, теплоёмкости; отсутствует взаимодействие между молекулами; подчиняется уравнению идеального газа (уравнение Клайперона,1834 г.) pV=RT, где R – газовая постоянная,зависящая от природы газа. На основании закона А.Авогардо универсальная (молярная) газовая постоянная R=8314Дж/кмоль К.
П роцессы горения заменяются подводом (мгновенно) количества тепла Q1 от горячего источника к Q2 холодному источнику.
Идеальный цикл – замкнутый и обратимый цикл, в котором отсутствуют потери энергии, не обусловленные, согласно второму закону термодинамики, необходимостью отдачи теплоты холодному источнику.
П ервый
закон термодинамики
(частный случай закона сохранения и
превращения энергии) – тепловая энергия,
подводимая к замкнутой системе,
расходуется на повышение её внутренней
энергии и работу, производимую системой
против внешних сил.
ервый
закон термодинамики
(частный случай закона сохранения и
превращения энергии) – тепловая энергия,
подводимая к замкнутой системе,
расходуется на повышение её внутренней
энергии и работу, производимую системой
против внешних сил.
Второй закон термодинамики – теплоту можно превращать в работу только при условии, что часть этой теплоты одновременно перейдёт от горячего тела к холодному (принцип действия тепловых двигателей).
П
а
б
в
г
P – давление;
V – объём;
T – температура;
S – энтропия (греч. «внутрь + поворот, превращение») – мера внутренней неупорядоченности системы.
Термодинамические процессы
В се
термодинамические процессы сопровождаются
обменом или превращением энергии.
Обратимыми называются процессы, в
результате которых в прямом и обратном
направлениях термодинамическая система
возвращается в исходное положение.
Необратимыми – процессы, в которых
система не возвращается в исходное
положение.
се
термодинамические процессы сопровождаются
обменом или превращением энергии.
Обратимыми называются процессы, в
результате которых в прямом и обратном
направлениях термодинамическая система
возвращается в исходное положение.
Необратимыми – процессы, в которых
система не возвращается в исходное
положение.
а) изохорический (chora – греч. «пространство»).
Т.к. V=const газ не совершает работу. Тепловая энергия расходуется только на увеличение внутренней энергии газа. P/T=const – второй закон Гей-Люссака – давление газа в замкнутом объёме пропорционально абсолютной температуре;
б) изобарический (p=const). V/T=const – первый закон Гей-Люссака (1802 г.) – при постоянном давлении объём газа пропорционален его абсолютной температуре;
в) изотермический (T=const). P1V1=p2V2; pV=const. Подводимое тепло целиком превращается в работу (закон Бойля – Мариотта, 1662-1676 г.);
г )
адиабатический, изоэнтропический
(pVk=const)
– отсутствие теплообмена с окружающей
средой, т.е. полная теплоизоляция;
)
адиабатический, изоэнтропический
(pVk=const)
– отсутствие теплообмена с окружающей
средой, т.е. полная теплоизоляция;
д) политропный – превращение энергии согласно определённому закону – pVn=const , 1nk, n – показатель политропности.
Обобщает приведённые выше процессы: n= - изохорический процесс;
n=0 – изобарический процесс;
n=1 – изотермический процесс;
n=k – адиабатический процесс.
