
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання
-
На які класи діляться неорганічні сполуки?
-
Які сполуки називаються окислами, основами, кислотами, солями з точки зору електролітичної дисоціації?
-
Що таке амфоліти?
-
Класифікація (які бувають) окислів, основ, кислот і солей.
-
Назви окислів, основ, кислот і солей.
-
Напишіть структурні формули сполук: CO2, Al2O3, H2SO4, H3PO4, CaOHCl, Na2HPO4.
-
При допомозі яких реакцій можна здійснити переходи.
Cu → CuO → Cu(OH)2 → CuCl2
Mg → MgO → Mg(OH)2 → MgSO4
CaCO3 → CaO → CaSO4
ЗАДАЧІ
1. Назвіть слідуючи сполуки: K2O2, MnO2, BaO2, MnO, CrO3, V2O5.
2. Чи можливо здійснити у розчинах слідуючи реакції:
CuSO4 + BaCl2 → BaSO4 + CuCl2
FeS + K2SO4 → FeSO4 + K2S
AgCl + KNO3 → AgNO3 + KCl
3. Складіть рівняння реакцій отримання хлориду магнію: а) дією кислоти на метал; б) дією кислоти на основу; в) дією солі на сіль.
4. Напишіть рівняння реакцій, за допомогою яких можна отримати в лабораторії слідуючи речовини: а) хлороводень; б) сульфід свинцю; в) сульфат барію; г) орто-фосфат срібла; д) гідроксид заліза (ІІІ); е) нітрат міді (ІІ).
5. Які з указаних гідроксидів можуть утворити основні солі: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
1. Класи неорганічних сполук. Методичні вказівки кафедри.
2. Глинка Н.Л. Задачи и упражнения по общей химии.1983.
3. Глинка Н.Л. Общая химия. 1986.
Лабораторна робота №2.
БУДОВА АТОМА.
Мета роботи – вивчити квантову теорію будови атомів і виходячи з їх будови вміти пояснювати фізичну і хімічну сутність періодичних властивостей елементів і їх сполук.
ВИМОГИ ДО ЗНАНЬ ТА УМІНЬ
Студент повинен знати: основні відомості про будову атомів.
Елементарні часточки (протон, нейтрон, електрон). Ізотопи, ізобари. Сучасне поняття про хімічний елемент. Будова електронних оболонок атомів. Енергетичний стан електронів в атомах. Квантові числа. Орбіталі та їх типи. Порядок заповнення енергетичних рівнів і підрівнів, їх електронну ємність. Принцип Паулі. Формули будови електронних оболонок атомів, їх графічне вираження. Правило Хунда та В.М.Клечковського. Знати структуру періодичної системи Д.І.Менделєєва, як графічне відображення періодичного закону, в чому полягає суть менделеївської та сучасного тлумачення періодичного закону. Наукове та філософське значення періодичного закону і системи.
Студент повинен вміти: написати електронну формулу s, p, d, f- елементів і їх графічне вираження, використовуючи принцип Паулі, правило Клечковського і Хунда, виходячи з електронної формули елемента в періодичній системі, визначити положення елемента (період, група, підгрупа, родина, валентність).
Теоретична частина
І. Будова атома.
До кінця ХІХ ст., в хімії панувало уявлення, що атом це найменша частинка простої речовини, що він неподільний. Відкриття катодних променів та явище радіоактивності показало, що атом має складну будову.
Після дослідів з α частинками Е.Резерфорд запропонував одну з перших моделей будови атома – планетарну. Будучи недостатньо науковою вона не могла відповісти на питання що до стабільності атома та природи лінійних спектрів газів.
Створення квантової теорії М.Планка дало змогу Н.Бору сформулювати основні положення своєї теорії у вигляді постулатів. Але й ця теорія була досить недосконалою, так як не могла з’ясувати місце знаходження електрона при переході з одного квантового рівня на інший, та її застосування було обмежено лише атомом водню.
20
р.р. ХХ ст. дали новий поштовх для розвитку
теорії будови атомів. Завдяки роботам
де-Бройля, Е.Шредінгера, В.Гейзенберга
та ін. Було розроблено основи хвильової
теорії про двоїсту корпускулярно-хвильову
природу світла; де-Бройлем було виведено
основне рівняння хвильової механіки:
![]() .
З цього рівняння випливає, що частинці
з масою m, яка рухається з швидкістю V,
відповідає хвиля довжиною λ. Це рівняння
можна використовувати для характеристики
руху не лише фотону, але й інших
матеріальних частинок : електрона,
протона, нейтрона та ін.. Отже електрон
є одночасно частинкою і хвилею. У 1925р.
В.Гейзенберг запропонував принцип
невизначеності, згідно з яким не можна
одночасно становити місце перебування
електрона у просторі, його швидкість,
імпульс. Все це дало змогу сформулювати
сучасну модель будови атома.
.
З цього рівняння випливає, що частинці
з масою m, яка рухається з швидкістю V,
відповідає хвиля довжиною λ. Це рівняння
можна використовувати для характеристики
руху не лише фотону, але й інших
матеріальних частинок : електрона,
протона, нейтрона та ін.. Отже електрон
є одночасно частинкою і хвилею. У 1925р.
В.Гейзенберг запропонував принцип
невизначеності, згідно з яким не можна
одночасно становити місце перебування
електрона у просторі, його швидкість,
імпульс. Все це дало змогу сформулювати
сучасну модель будови атома.
Сучасна модель:
1. Основується на корпускулярно-хвильовій природі електрона.
2. Розглядає ймовірність знаходження електрона у просторі навколо ядра.
3. Електронна густина нерівномірно розподілена навколо ядра.
4. Атомна орбіталь – простір навколо ядра, де вірогідність знаходження електрона 90%.
5. Атомне ядро


нейтрони протони
n01 р+1
Ar = Z + N , де Z – кількість протонів,
N – кількість нейтронів.
Ядро заряджене позитивно, а електрони заряджені негативно. Атом в цілому електронейтральний із-за взаємної компенсації зарядів.
Ізотопи – атоми з однаковим зарядом ядра, але різною масою.
4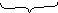
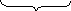 018Ar
і 39 18
Ar
;
11H
, 21D,
31
Т.
018Ar
і 39 18
Ar
;
11H
, 21D,
31
Т.
Ізобари – атоми з однаковою масою, але різними зарядами.
4018 Ar і 4019К.
-
Стан електронів в атомі характеризується набором певних характерис-тик - квантових чисел.
Їх усього чотири : n, l, m, s. Щоб з’ясувати суть квантових чисел треба зрозуміти, що всі ці числа характеризують електрони на різних енергетичних рівнях в атомі.
Рівні
N = 1 2 3 4
+




ядро
підрівні s s p s p d s p d f
L = 0 0 1 0 1 2 0 1 2 3
орбіталі
m
 l
=
↑↓
l
=
↑↓
-
-
mS
кожний рівень складається з підрівнів, а кожен підрівень з орбіталей, на яких і знаходяться електрони.
n – головне квантове число; характеризує:
1. енергію електрона в атомі або на рівні;
-
розмір електронної хмари.
Приймає значення від 1 до ∞.
Енергетичні рівні з різним значенням (n) прийнято позначати великими латинськими літерами.
n = 1 2 3 4 5 6 7
рівні К L M N O P Q
якщо n = 3, це означає, що електрон знаходиться на 3 рівні. По значенню (n) можна визначити максимальну кількість електронів на рівні:
N = 2 n2
l – орбітальне квантове число; характеризує:
-
енергію електрона на підрівні.
-
форму електронної орбіталі.
Приймає значення від 0 до (n - 1), кожному значенню l відповідає певний підрівень.
l = 0 1 2 3
підрівень s р d f
якщо l = 3, це означає, що електрон знаходиться на f- підрівні. Кількість підрівнів дорівнює номеру рівня – s, р і т.д. (див. схему).кількість електронів на підрівні розраховується за формулою: N = 2(2l + 1) звідси N е (s) = 2; N е (р) = 6; N е (d) = 10; N е (f) = 14.
ml – магнітне квантове число; характеризує орієнтацію орбіталів у просторі. Воно визначає кількість орбіталей в одному й тому електронному рівні і розраховується по формулі (2l + 1).
m = 0 -1,0,1 -2,-1,0,+1,+2 -3,-2,-1,0,+1,+2,+3
Кількість 1-s 3-р 5-d 7-f
орбіталей
m S
- спін
характеризує
оберт електрона навколо власної осі.
Приймає значення +½ і -½ .
S
- спін
характеризує
оберт електрона навколо власної осі.
Приймає значення +½ і -½ .
Заповнення енергетичних рівнів у незбудженних атомах відбувається згідно з принципом найменшої енергії: найбільш стійким станом електронів в атомі відповідає мінімальна із можливих його енергій. Тому спочатку заповнюються рівні з найменшою енергією. Зміст енергії електрона визначається правилом В.М.Клечковського:
-
заповнення електронних шарів йде у напрямку збільшення сум головного і орбітального квантових чисел (n + l).
Звідси зрозуміло, чому зразу заповнюється 4s підрівень, а потім 3d тобто:
Для 4s (n + l = 4), а для 3d (n + l = 5), якщо сума однакова , то спочатку йде заповнення підрівня з найменшим значенням (n).
При заповненні електронних рівнів крім правила Клечковського використовують принцип Паулі і правило Хунда.
Принцип Паулі: в атомі не може бути двох електронів з однаковим значенням всіх чотирьох квантових чисел.
Це означає, що на одній орбіталі може бути не більш 2-х електронів для яких значення n, m, l однакові, а спіни антипаралельні
-
↑↓
Правило Хунда: при заповненні енергетичних підрівнів електрони роз- ташовуються так, щоб їх сумарний спін був максимальний.
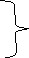



|
↑↓ |
↑↓ |
↑↓ |
Не правильно


 ↑ ↓ ↑ правильно
↑ ↓ ↑ правильно
ПРАВИЛО НАПИСАННЯ ЕЛЕКТРОННИХ ФОРМУЛ *.
1. В періодичній системі знаходимо порядковий номер елементу, його величина показує заряд ядра і загальну кількість електронів в атомі.
2. По періодичній системі знаходимо номер періоду даного елементу, його числове значення показує кількість енергетичних рівнів в даному атомі.
3. По періодичній системі знаходимо номер групи даного елементу, його числове значення показує: кількість електронів на останньому енергетичному рівні (якщо це s- чи р-елемент), якщо це d елемент, то їх, як правило, 2, а у де-яких 1 (Cr, Nb, Mo, Ru, Rh, Pt, Cu).
4. Використовуючи формулу Ne = 2 n2 записуємо максимальне число електронів на кожному рівні, крім передостанньому. Кількість електронів на передостанньому визначаємо як різницю між порядковим номером атому елементу і кількістю електронів в атомі, крім передостаннього рівня.
5. Записуємо електронну формулу користуючись правилом Клечковського, Хунда, Паулі.
Наприклад : записати електронну формулу Se.
1. Se 34 Z = +34; ∑ Nе = 34.
2


 . Se
4 період
. Se
4 період
3


 . VІ
гр. р елемент , на останньому шарі 6 ē
. VІ
гр. р елемент , на останньому шарі 6 ē
4


 . N
ē
= 2 n2
для 1-го N
ē
=2 6
. N
ē
= 2 n2
для 1-го N
ē
=2 6
для 2-го N ē = 8



 х = 34 – 16 =18
2 8 х 6
х = 34 – 16 =18
2 8 х 6
2 8 18 6
5. 1s2 2s2 2р6 3 s2 3р6 4 s2 3d10 4р4
*це правило не придатне для написання електронної формули f-елементів
