
- •Таврійський державний агротехнологічний університет
- •Змістовий модуль I. Неорганічна хімія
- •Тема 5. Гідроген. Хімія лужних металів. Хімія лужно - земельних елементів.
- •Змістовий модуль іі. Фізична та колоїдна хімія
- •Тема 14. Дисперсні системи та їх класифікація.
- •Тема 15. Мікрогетерогенні системи.
- •Тема 16. Напівколоїди та розчини високомолекулярних сполук.
- •Розподіл балів, що присвоюються студентам
- •Техніка безпеки та правила роботи в хімічній лабораторії Вимоги безпеки перед початком роботи
- •Вимоги безпеки під час роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в аварійних ситуаціях
- •Розділ і. Неорганічна хімія Лабораторна робота №1. Класи неорганічних сполук
- •Вимоги до знань та умінь
- •Теоретична частина
- •Оксиди.
- •Кислоти.
- •Основи.
- •Амфоліти.
- •Паспорт роботи
- •Експериментальна частина Техніка безпеки.
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •Теоретична частина
- •Паспорт роботи
- •Результати оформлення роботи
- •Контрольні питання
- •ТермоХімія. Мета роботи – навчитися експериментально визначати ентальпію хімічних реакцій і робити розрахунки, використовуючи термохімічні рівняння.
- •Фактори, що визначають напрямок хімічних реакцій.
- •Паспорт роботи.
- •Експериментальна частина
- •Хід роботи.
- •Результати. Оформлення роботи.
- •Контрольні питання.
- •Рекомендована література
- •Лабораторна робота №5. Кінетика та швидкість хімічних реакцій
- •Вимоги до знань та умінь
- •Теоретична частина
- •Хімічна рівновага
- •Паспорт роботи
- •Експеріментальна частина
- •Контрольні питання
- •Рекомендована література
- •Лабораторна робота №6. Періодична система та періодичний закон д.І. Менделєєва
- •Вимоги до знань та умінь
- •Теоретична частина
- •Періодична система і будова атома.
- •Контрольні питання
- •Лабораторна робота №7. Властивості гідрогену та його сполук
- •Теоретична частина
- •Проста речовина
- •Практична частина Одержання та властивості Гідрогену. Окисно-відновні властивості Гідрогену.
- •Контрольні питання
- •Лабораторна робота №8. Властивості лужних металів.
- •Теоретична частина
- •Практична частина Властивості лужних металів та їх сполук.
- •Контрольні питання
- •Лабораторна робота №9. Властивості лужноземельних металів.
- •Теоретична частина
- •Практична частина Властивості лужноземельних металів та їх сполук
- •Контрольні питання
- •Елементи іv – а групи
- •Властивості Алюмінію, Карбону, Силіцію, Стануму, Плюмбуму та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 8 Властивості Нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Галогени
- •Практична частина Властивості р-елементів та її сполук.
- •Контрольні питання
- •Лабораторна робота №13. Загальна характеристика d-елементів
- •Теоретична частина
- •Практична частина
- •Контрольні питання
- •Лабораторна робота №14. Тема: комплексні сполуки
- •Експериментальна робота Комплексні сполуки та їх властивості.
- •Контрольні питання
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 16. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 17. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 18. Розчини електролітів
- •Гідроліз солей
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 19. Поверхневі явища та адсорбційні рівноваги
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 20. Дисперсні систем та їх класифікація
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Паспорт роботи.
Розчини, посуд, апаратура.
1. 1м розчин HNO3
2. 1м розчин HCl
3. 1м розчин KOH
4. 1м розчин NaOH
5. Калориметр
6. Електроплитка
7. Термометр з ціною ділення 0,10С
8. Технохімічні ваги
9. Різноважки
10. Хімічні стакани ємністю 250-300 мл і 100 мл.
Експериментальна частина
Техніка безпеки.
При виконанні роботи необхідно пам’ятати, що ви працюєте з кислотами і лугами. Якщо кислота влучила на одяг або, тіло її треба змити водою або слабим розчином соди. Коли луг – змити водою або 5% розчином оцтової кислоти, а потім ще раз водою. Не забудьте вимкнути електроплитку.
Хід роботи.
Дослід. Визначення ентальпії реакції нейтралізації.
Робоче місце № 1 1м розчин HCl і 1м розчин NaOH
Робоче місце № 2 1м розчин HCl і 1м розчин КОН
Робоче місце № 3 1м розчин HNO3 і 1м розчин NaOH
Робоче місце № 4 1м розчин HNO3 і 1м розчин КОН
Робота проводиться в спрощеному калориметрі. Калориметр складається з двох стаканів: зовнішнього – ємністю 250-300 мл і внутрішнього – ємністю 100 мл, коркової підставки, на якій розміщують внутрішній стакан для зменшення тепловіддачі, картонної покришки і термометра.
Спочатку зважте внутрішній стакан калориметра з точністю до 1· 10-1 г (m1). Налийте в нього з циліндру 25 мл розчину кислоти (обережно!) концентрацією 1М. Поставте стакан у калориметр. Опустіть термометр у кислоту і визначте її температуру з точністю до 0,10.
Не витягуючи з розчину кислоти термометр, швидко (але обережно!) додайте до кислоти з циліндру 25 мл 1м розчину лугу; повільно перемішуючи спостерігайте зміну температури. Визначте максимальну температуру в досліді.
Після охолодження розчину до кімнатної температури, зважте внутрішній стакан калориметра з розчином з точністю до 1· 10-1 г (m2).
Результати. Оформлення роботи.
m1 – маса внутрішнього стакана, (г)
m2 – маса зовнішнього стакана, (г)
t1 – температура на початок експерименту, (0С)
t2 – максимальна температура під час експерименту, (0С)
Теплота, що виділяється при реакції нейтралізації, витрачається на нагрівання розчину: q = cm(t2 - t1) (13)
Теплоємкість розчину дорівнює теплоємності води, тобто 4,2 Дж/моль. Теплоту, що витрачається на нагрівання калориметру можна зневажати.
Знаходимо масу розчину: m = m2 – m1. (14)
Зверніть увагу, що дані для експерименту кислоти є одноосновними, а луги – однокислотними. Це означає, що для даних речовин співпадають числові значення молярної і еквівалентної (нормальної) концентрації. Тому маємо:
СН
= СМ
=
![]() (15),
(15),
де ν – кількість розчиненої речовини (кислоти або лугу) у розчині (моль)
V – об’єм даного розчину кислоти або лугу (л).
З рівняння (15) знаходимо кількість розчиненої речовини:
ν = СМ * V; ν = 1 * 0,025 = 0,025 моль
Визначену з рівняння (14) масу розчину підставляємо у рівняння (13). Отримуємо теплоту реакції нейтралізації в “Дж/г”.
Ентальпія реакції відноситься до одного моля і виражається у кілоджоулях. Тому:
ΔН
=
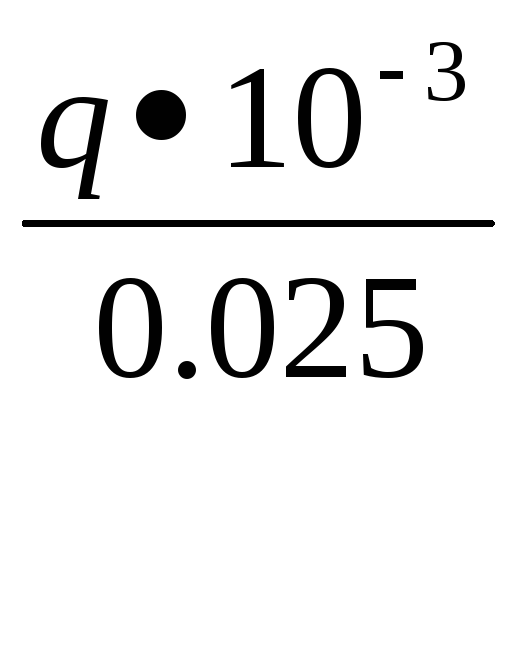 , кДж/моль.
, кДж/моль.
Теоретичне значення ентальпії (ΔН) реакції нейтралізації сильної кислоти лугом дорівнює 56,5 кДж/моль. Визначте відносну помилку (у %) експериментально знайденого теплового ефекту:
η
=
![]()
